Điều chế khí oxi - Phản ứng phân hủy
I. ĐIỀU CHẾ KHÍ OXI TRONG PHÒNG THÍ NGHIỆM
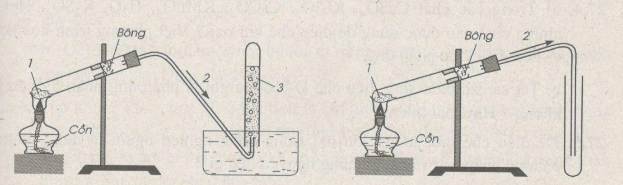
Trong PTN, khí oxi được điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân huỷ ở nhiệt độ cao như KMnO4 và KClO3
2KMnO4 $\xrightarrow{{{t}^{o}}}$ K2MnO4 + MnO2 + O2
2KClO3 $\xrightarrow{{{t}^{o}}}$ 2KCl + 3O2
2KNO3 $\xrightarrow{{{t}^{o}}}$ 2KNO2 + O2
* Cách thu khí oxi:
- Vì khí oxi ít tan trong nước => thu khí oxi bằng cách đẩy nước
- Khí oxi có ${{d}_{{{O}_{2}}/kk}}\approx 1,1$ => oxi nặng hơn không khí => thu khí oxi bằng cách đẩy không khí
II. SẢN XUẤT KHÍ OXI TRONG CÔNG NGHIỆP
* Nguyên liệu trong thiên nhiên: Không khí và nước.
1. Sản xuất khí oxi từ không khí:
- Bằng cách hạ không khí xuống dưới -200oC, sau đó nâng dần nhiệt độ lên -196oC ta thu được khí N2, sau đó nâng đến -183oC ta thu được khí oxi.
2. Sản xuất khí oxi từ nước:
2H2O $\xrightarrow{điện\,phân}$ 2H2 ↑ + O2 ↑
III. PHẢN ỨNG PHÂN HUỶ
* Định nghĩa: Phản ứng phân huỷ là phản ứng hoá học trong đó một chất phản ứng sinh ra hai hay nhiều chất mới.
Ví dụ:
2KMnO4 $\xrightarrow{{{t}^{o}}}$ K2MnO4 + MnO2 + O2
2KClO3 $\xrightarrow{{{t}^{o}}}$ 2KCl + 3O2
2H2O $\xrightarrow{điện\,phân}$ 2H2 + O2
CaCO3 $\xrightarrow{{{t}^{o}}}$ CaO + CO2
