Một số bazơ quan trọng
I. NATRI HIĐROXIT
1. Tính chất vật lí
- NaOH là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt.
- Dung dịch NaOH có tính nhờn làm bục vải, giấy và ăn mòn da => khi sử dụng hết sức cẩn thận
2. Tính chất hóa học
NaOH là bazơ tan và có đầy đủ tính chất hóa học của một bazơ tan
- Làm đổi màu chất chỉ thị (quỳ tím chuyển xanh; phenolphtalein chuyển đỏ)
- Tác dụng với axit tạo thành muối và nước: NaOH + HCl → NaCl + H2O
- Tác dụng với oxit axit: 2NaOH + CO2 → Na2CO3 + H2O
- Tác dụng với dung dịch muối: 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl
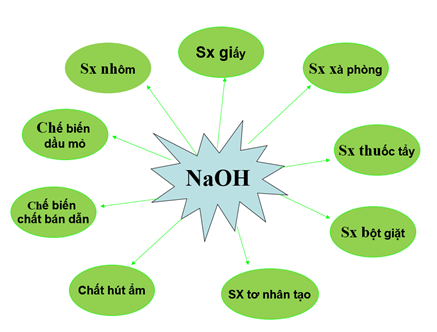
3. Ứng dụng của NaOH
4. Sản xuất natri hiđroxit
- Trong công nghiệp, NaOH được điều chế bằng cách điện phân dung dịch NaCl
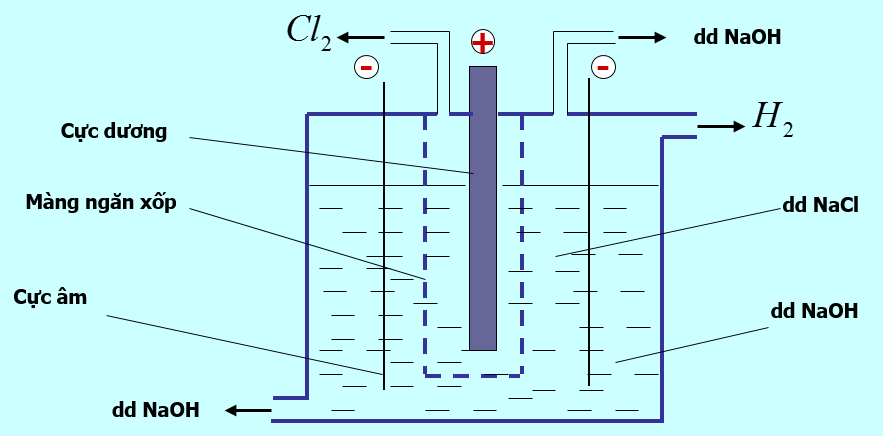
- Phương trình điện phân:
2NaCl + 2H2O $\xrightarrow[mang\,\,ngan\,\,xop]{đpdd}$ 2NaOH + H2 + Cl2
- Tác dụng của màng ngăn xốp: không cho khí clo thoát ra tác dụng với dung dịch NaOH vì xảy ra phản ứng:
Cl2 + 2NaOH → NaCl + NaClO + H2O
B. CANXI HIĐROXIT
1. Tính chất vật lí
- Ca(OH) ít tan trong nước, một phần Ca(OH)2 hòa tan được trong nước gọi là dung dịch nước vôi trong
2. Tính chất hóa học
- Ca(OH)2 là bazơ tan => có đầy đủ tính chất hóa học của bazơ tan
- Tác dụng với chất chỉ thị: làm quỳ tím chuyển xanh và phenolphtalein chuyển đỏ
- Tác dụng với oxit axit tạo muối và nước: Ca(OH)2 + CO2 → CaCO3 + H2O
- Tác dụng với axit tạo muối và nước: Ca(OH)2 + 2HCl → CaCl2 + 2H2O
- Tác dụng với dung dịch muối: Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
3. Ứng dụng
- Làm vật liệu xây dựng, khử chua đất trồng trọt và khử độc các chất thải công nghiệp, diệt trùng chất thải sinh hoạt và xác chết động vật.
C. THANG pH
* Thang pH biểu thị độ axit hoặc bazơ của dung dịch
pH = 7: dung dịch trung tính
pH < 7: dung dịch có tính axit, pH càng nhỏ độ axit càng lớn
pH > 7: dung dịch có tính bazơ, pH càng lớn độ bazơ càng lớn
