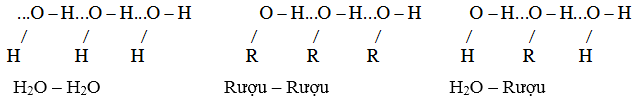Lí thuyết chung về ancol
I. ĐỊNH NGHĨA, PHÂN LOẠI
1. Định nghĩa
Ancol là những hợp chất hữu cơ mà phân tử có nhóm –OH liên kết trực tiếp với nguyên tử C no.
2. Phân loại
- Theo cấu tạo gốc hiđrocacbon: ancol no, ancol không no, ancol thơm (phân tử chứa vòng benzen).
- Theo số lượng nhóm OH: ancol đơn chức, ancol đa chức.
- Theo bậc ancol (bằng bậc của C mang nhóm –OH).
a. Ancol no, đơn chức, mạch hở : CnH2n+1OH (hoặc CnH2n+2O) (n ≥ 1).
b. Ancol no, đa chức, mạch hở: CnH2n+2-m(OH)m (hoặc CnH2n+2Om ) (m >1, n ≥ m ).
c. Ancol không no chứa 1 liên kết đôi C=C, đơn chức, mạch hở : CnH2n-1OH (hoặc CnH2nO) (n ≥ 3).
II. ĐỒNG PHÂN, DANH PHÁP
* Điều kiện bền của ancol:
+ nhóm -OH đính vào C no
+ chỉ có 1 nhóm -OH đính vào 1 cacbon
1. Đồng phân
CTPT CnH2n+2O no, đơn chức mạch hở có đồng phân:
+ Mạch cacbon (n ≥ 4).
+ Nhóm chức (chức ancol và chức ete) ((n ≥ 2).
+ Vị trí nhóm chức (n ≥ 3).
Ví dụ: CTPT C3H8O có bao nhiêu đồng phân ?
+ Đồng phân ancol: CH3-CH2-CH2OH và CH3-CH(OH)-CH3
+ Đồng phân ete: CH3-CH2-O-CH3
2. Danh pháp
a. Tên thông thường (tên gốc chức)
Tên gốc chức: Ancol + Tên gốc hiđrocacbon + ic
Ví dụ: CH3OH: ancol metylic, C2H5OH: ancol etylic.
b. Tên thay thế
Tên thay thế: Tên gốc hiđrocacbon tương ứng + số chỉ vị trí nhóm –OH + ol
Chú ý: + Chọn mạch chính là mạch cacbon dài nhất liên kết với nhóm –OH.
+ Đánh số thứ tự từ nguyên tử cacbon gần nhóm –OH hơn.
Ví dụ:
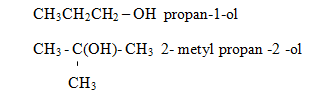
III. TÍNH CHẤT VẬT LÝ VÀ LIÊN KẾT HIĐRO
- Ancol có nhiệt độ nóng chảy, nhiệt độ sôi và độ tan trong nước cao hơn so với hiđrocacbon, dẫn xuất halogen, ete có khối lượng phân tử tương tự.
Nguyên nhân: ancol có liên kết –O–H phân cực nên hình thành được liên kết hiđro với nhau (làm tăng nhiệt độ nóng chảy, nhiệt độ sôi) và với nước (làm tăng độ tan trong nước).