Lí thuyết chung về axit cacboxylic
I. ĐỊNH NGHĨA, PHÂN LOẠI
1. Định nghĩa
Axit cacboxylic là hợp chất hữu cơ mà phân tử có nhóm –COOH liên kết với gốc hiđrocacbon, với H hoặc với nhau.
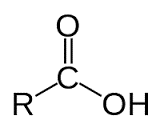
- Công thức tổng quát của axit:
+ CxHyOz (x, y, z là các số nguyên dương; y chẵn; z chẵn; 2 ≤ y ≤ 2x + 2 – 2z) : thường dùng khi viết phản ứng cháy.
+ CxHy(COOH)z hay R(COOH)z: thường dùng khi viết phản ứng xảy ra ở nhóm COOH.
+ CnH2n+2-2k-z(COOH)z (k = số liên kết pi + số vòng): thường dùng khi viết phản ứng cộng H2, cộng Br2,…
2. Phân loại
- Dựa vào cấu tạo gốc hiđrocacbon: axit no, không no, thơm.
- Dựa vào số nhóm –COOH: axit đơn chức, đa chức.
a. Axit no, đơn chức, mạch hở : CnH2n+1COOH (n ≥ 0) hoặc CmH2mO2 (m ≥ 1).
b. Axit không no chứa 1 liên kết đôi C=C, đơn chức, mạch hở: CnH2n-1COOH (n ≥ 2) hoặc CmH2m-2O2 (m ≥ 3).
c. Axit no, 2 chức, mạch hở: CnH2n(COOH)2 (n ≥ 0) hoặc CmH2m-2O4 (m ≥ 1).
II. DANH PHÁP
1. Tên thay thế
Tên thay thế = Axit + Tên hiđrocacbon tương ứng theo mạch chính (mạch chính bắt đầu từ nguyên tử C của nhóm –COOH) + oic
2. Tên thường của một số axit thường gặp
|
Axit cacboxylic |
Tên axit cacboxylic |
Axit cacboxylic |
Tên axit cacboxylic |
|
HCOOH |
Axit fomic |
(CH2)3(COOH)2 |
Axit glutaric |
|
CH2=CH-COOH |
Axit acrylic |
(CH2)4(COOH)2 |
Axit ađipic |
|
(COOH)2 |
Axit oxalic |
C15H31COOH |
Axit panmitic |
|
CH2=C(CH3)-COOH |
Axit metacrylic |
C17H35COOH |
Axit stearic |
|
C6H5-COOH |
Axit benzoic |
C17H33COOH |
Axit oleic |
|
CH2-(COOH)2 |
Axit Malonic |
C17H31COOH |
Axit linoleic |
|
(CH2-COOH)2 |
Axit Succinic |
|
|
III. TÍNH CHẤT VẬT LÍ
1. Nhiệt độ sôi
- Ở điều kiện thường, các axit cacboxylic đều là những chất lỏng hoặc rắn.
- Axit có nhiệt độ sôi cao hơn ancol có khối lượng phân tử tương đương vì phân tử axit tạo được 2 liên kết hiđro và liên kết hiđro giữa các phân tử axit bền hơn liên kết hiđro giữa các phân tử ancol.
2. Tính tan
- Từ C1 đến C3 tan vô hạn trong nước do có khả năng tạo liên kết H liên phân tử với nước.
- C4 đến C5 ít tan trong nước; từ C6 trở lên không tan do gốc R cồng kềnh và có tính kị nước.
