Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Đặng Huy Trứ
Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Đặng Huy Trứ
-
Hocon247
-
40 câu hỏi
-
90 phút
-
30 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Phát biểu nào sau đay sai?
Phát biểu sai: Xenlulozơ và tinh bột có phân tử khối bằng nhau.
Xà phòng hóa hoàn toàn este X mạch hở trong dung dịch NaOH, thu được hỗn hợp các chất hữu cơ gồm: (COONa)2, CH3CHO và C2H5OH. Công thức phân tử của X là
Công thức phân tử của X là C6H8O4
Cho các thí nghiệm sau:
Cho Fe3O4 tác dụng với lượng dư dung dịch HCl.
Cho a mol Fe tác dụng với 3,5a mol HNO3 thu được NO là sản phẩm khử duy nhất cúa N+5.
Cho CrO3 tác dụng với lượng dư dung dịch NaOH.
Cho a mol Fe tác dụng với dung dịch chứa 2,5a mol AgNO3.
Số thí nghiệm mà dung dịch có chứa hai muối sau phản ứng là
Số thí nghiệm mà dung dịch có chứa hai muối sau phản ứng là 3
Khi thủy phân hoàn toàn một triglixerit X trong môi trường axit thu được hỗn hợp sản phầm gồm glixerol, axit panmitic và axit oleic. Số công thức cấu tạo của thoản mãn tính chất trên là
Số công thức cấu tạo của thoản mãn tính chất trên là 4
Cho các dung dịch loãng: (1) AgNO3, (2) FeCl2, (3) HNO3, (4) FeCl3, (5) hỗn hợp gồm NaNO3 và HCl. Số dung dịch phản ứng được với Cu là
Số dung dịch phản ứng được với Cu là 4
Cho các loại tơ sau: nilon-6, lapsan, visco, xenlulozơ axetat, nitron, enang. Số tơ thuộc tơ hóa học là
Số tơ thuộc tơ hóa học là 3
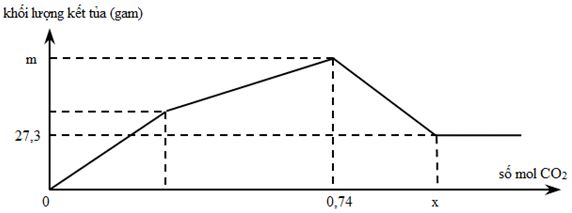
Sục từ từ khí CO2 đến dư vào dung dịch chứa Ca(OH)2 và NaAlO2. Khối lượng kết tủa thu sau phản ứng được biểu diễn trên đồ thị như hình vẽ:
Giá trị của m và x lần lượt là
Đáp án A
Đặt số mol Ca(OH)2 = a và nNaAlO2 = b ta có phản ứng:
Ca(OH)2 + CO2 → CaCO3↓ + H2O.
NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
Sau khi CO2 dư vào ⇒ CaCO3 + CO2 + H2 → Ca(HCO3)2
nAl(OH)3 = 27,3 ÷ 78 = b = 0,35 mol.
⇒ nCa(OH)2 = 0,74 – 0,35 = 0,39 mol.
⇒ m = 0,39×100 + 27,3 = 66,3 gam Và x = 0,39 + 0,35 + 0,39 = 1,13 mol
Đốt cháy hoàn toàn một lượng este X (no, đơn chức, mạch hở) thì số mol O2 phản ứng bằng số mol CO2 sinh ra. Mặt khác, cho 6,0 gam X tác dụng vừa đủ với dung dịch KOH, thu được dung dịch chứa m gam muối. Giá trị của m là
Đáp án C
Este no đơn chức mạch hở ⇒ CTPT là CnH2nO2.
+ Phản ứng cháy: CnH2nO2 + (3n-2)/2 O2 → nCO2 + nH2O.
Vì nO2 pứ = nCO2 ⇔ (3n-2)/2 = n ⇔ n = 2
⇒ X là HCOOCH3. Ta có nHCOOCH3 = 0,1 mol.
⇒ mMuối = mHCOOK = 0,1×(45+39) = 8,4 gam
Hỗn hợp X chứa Al và Na có khối lượng a gam. Cho hỗn hợp X vào lượng nước dư, thấy thoát ra 4,48 lít khí H2. Nếu cho hỗn hợp X vào lượng KOH dư, thấy thoát ra 7,84 lít khí H2. Các thể tích khí đo ở điều kiện chuẩn. Giá trị của a là
Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam
Tiến hành các thí nghiệm sau:
(1) Nhúng thanh Fe vào dung dịch CuSO4.
(2) Dẫn khí CO qua Fe2O3 nung nóng.
(3) Điện phân dung dịch NaCl bão hòa, có màng ngăn.
(4) Đốt bột Fe trong khí oxi.
(5) Cho kim loại Ag vào dung dịch HNO3 loãng.
(6) Nung nóng Cu(NO3)2.
(7) Cho Fe3O4 vào dung dịch H2SO4 đặc, nóng.
Số thí nghiệm có xảy ra sự oxi hóa kim loại là
Số thí nghiệm có xảy ra sự oxi hóa kim loại là 3
Có các phát biểu sau:
1. Zn có thể khử được Cr3+ trong môi trường axit thành Cr2+.
2. Nhỏ dung dịch NaOH vào dung dịch Na2Cr2O7 thì dung dịch từ màu vàng chuyển sang màu cam.
3. P, S, C tự bốc cháy khi tiếp xúc với CrO3.
4. Oxi hóa Cr3+ bằng Br2 trong môi trường kiềm sẽ thu được Cr2O72-.
5. Nhỏ dung dịch BaCl2 vào dung dịch Na2CrO4 cho kết tủa màu vàng.
6. Hợp chất Cr2O3 lưỡng tính, tan dễ dàng trong dung dịch axit hay kiềm ở mọi nhiệt độ.
7. Crom là kim loại chuyển tiếp, thuộc nhóm VIB, chu kì 4, có số hiệu nguyên tử là 24.
8. Kim loại crom có thể cắt được thuỷ tinh.
9. Crom là kim loại có tính khử mạnh hơn sắt.
Số phát biểu đúng là
Số phát biểu đúng là 6
Điện phân 200 ml dung dịch gồm CuSO4 1,0 M và NaCl a M (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) với cường độ dòng điện không đổi 2A trong thời gian 14475 giây. Dung dịch thu được có khối lượng giảm 14,75 gam so với dung dịch ban đầu. Giá trị của a là
Đáp án D
∑ne trao đổi = 0,3 mol < 2nCu2+.
⇒ Cu chưa bị điện phân hết và khí thoát ra là Cl2 và có thể có cả O2.
Nếu chỉ có khí Cl2 ⇒ Quy đổi mDung dịch giảm = mCuCl2 = 0,15×135 = 20,25 ≠ 14,75 ⇒ Loại.
+ Vậy có cả O2 thoát ra ⇒ mDung dịch giảm = mCuCl2 + mCuO.
+ Đặt số mol 2 chất lần lượt là a và b ta có:
a + b = 0,15 mol (PT bảo toàn Cu).
135a + 80b = 14,75 (PT theo m dung dịch giảm).
+ Giải hệ ⇒ a = nCuCl2 = 0,05 mol ⇒ nNaCl = 0,05×2 = 0,1 mol.
⇒ CM NaCl = 0,1/0,2 = 0,5M
Cho 0,15 mol bột Cu và 0,3 mol Fe(NO3)2 vào dung dịch chứa 0,5 mol H2SO4 (loãng). Sau khi các phản ứng xảy ra hoàn toàn, thu được V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
Đáp án B
Có quá trình khử : 4H+ + NO3- + 3e → NO +2H2O
Có nH+ = 1 mol, nNO3- = 0,6 mol ⇒ số e nhận tối đa là 3 × 1 ÷ 4 = 0,75 mol
Quá trình oxi hoá : Cu → Cu2+ + 2e và Fe2+ → Fe3+ + 1e
Số e nhường tối đa là là 2×0,15 + 0,3 = 0,6 mol < ne nhận tối đa
Vậy chứng tỏ NO được tính theo số e nhường ⇒ NO = 0,6 : 3 = 0,2 mol.
⇒ V = 4,48 lít
Hỗn hợp X gồm Ba, BaO và Ba(OH)2 có tỉ lệ số mol tương ứng 1: 2 : 3. Cho m gam X vào nước thì thu được a lít dung dịch Y và V lít khí H2 (đktc). Hấp thụ 8V lít CO2 (đktc) vào a lít dung dịch Y đến phản ứng xảy ra hoàn toàn thì thu được 98,5 gam kết tủa. Giá trị của m là
Đáp án B
Đặt nBa = a, nBaO = 2a và nBa(OH)2 = 3a
⇒ nH2 = nBa = a ⇒ ∑nBa(OH)2 = a + 2a 3a = 6a = 6V/22,4
⇒ ∑nOH– = 12V/22,4 ⇒ nCO32– = 12V/22,4 - 8V/22,4 = 4V/22,4 .
⇒ nBaCO3 = 4V/22,4 × 197 = 98,5 V = 2,8.
⇒ nBa = 2,8/22,4 = 0,125 mol ⇒ nBaO = 0,25, nBa(OH)2 = 0,375.
⇒ m = 0,125×137 + 0,25×153 + 0,375×171 = 119,5 gam
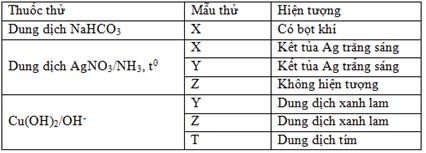
Kết quả thí nghiệm của các chất X, Y, Z, T (dạng dung dịch) với thuốc thử được ghi ở bảng sau:
Các chất X, Y, Z, T lần lượt là
Đáp án B
X + NaHCO3 → Khí ⇒ X là axit ⇒ Loại A.
X có phản ứng tráng gương ⇒ Loại D.
T có pứ màu biure ⇒ T không thể là đipeptit ⇒ Loại C.
Hỗn hợp khí X gồm etilen và propin. Cho a mol X tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được 17,64 gam kết tủa. Mặt khác a mol X phản ứng tối đa với 0,44 mol H2. Giá trị của a là
Đáp án C
Đặt số mol C2H4 = b và nC3H4 = c.
+ PT theo nH2: b + 2c = 0,44 (1).
+ PT theo khối lượng kết tủa là: 147c = 17,64 (2).
⇒ Giải hệ PT (1) và (2) ⇒ b = 0,2 và c = 0,12
⇒ nX = a = b + c = 0,32
Hòa tan hoàn toàn m gam hỗn hợp X gồm Mg , Fe, FeCO3, Cu(NO3)2 vào dung dịch chứa NaNO30,045 mol và H2SO4, thu được dung dịch Y chỉ chứa các muối trung hòa có khối lượng là 62,605 gam (không chứa ion Fe3+) và 3,808 lít (đktc) hỗn hợp khí Z (trong đó có 0,02 mol H2). Tỉ khối của Z so với O2 bằng 19/17. Thêm tiếp dung dịch NaOH 1 M vào Y đến khi thu được lượng kết tủa lớn nhất là 31,72 gam thì vừa hết 865 ml. Mặt khác, thêm dung dịch BaCl2 vừa đủ vào dung dịch Y, lọc bỏ kết tủa được dung dịch G, sau đó cho thêm lượng dư AgNO3 vào G thu được 150,025 gam kết tủa. Giá trị của m là
Đáp án B
Đốt cháy hỗn hợp gồm 2,6 gam Zn và 2,24 gam Fe với hỗn hợp khí X gồm clo và oxi, sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không còn khí dư). Hòa tan Y bằng một lượng vừa đủ 120 ml dung dịch HCl 1M, thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z, thu được 28,345 gam kết tủa. Phần trăm thể tích của clo trong hỗn hợp X là
Khi tác dụng với HCl chỉ có các oxit bị hòa tan
→ nHCl = 4nO2 → nO2 = 0,03 mol
Gọi số mol của Cl2 và Ag lần lượt là x, y mol
Bảo toàn nguyên tố Cl → nAgCl = 2nCL2 + nHCl = 2. x + 0,12
→ 143,5( 2. x + 0,12) + 108y = 28,345
Bảo toàn electron cho toàn bộ quá trình 3nFe + 2nZn = 2nCl2 + 4nO2 + nAg
→ 3. 0,04 + 2.0,04 = 2.x + 4. 0,03 + y
Giải hệ → x= 0,035 và y = 0,01
%Cl2 = 0,035/(0,035+0,03) . 100% = 53,85%.
Hỗn hợp E gồm ba peptit mạch hở: đipeptit X, tripeptit Y, tetrapeptit Z có tỉ lệ mol tương ứng là 2:1:1. Cho một lượng E phản ứng hoàn toàn với dung dịch NaOH dư, thu được 0,25 mol muối của glyxin, 0,2 mol muối của alanin và 0,1 mol muối của valin. Mặt khác, đốt cháy hoàn toàn m gam E, thu được tổng khối lượng của CO2 và H2O là 39,14 gam. Giá trị của m là
Đáp án A
Đặt nX = 2a ⇒ nY = a; nZ = a ⇒ ∑na.a = 2×2a + 3×a + 4×a = 0,25 + 0,2 + 0,1.
⇒ a = 0,05 mol ⇒ ∑nPeptit = 4a = 0,2 mol. Quy E về C2H3NO, CH2 và H2O.
⇒ nC2H3NO = 0,55 mol; nCH2 = 0,2 + 0,1×3 = 0,5 mol; nH2O = 0,2 mol.
+ Đốt E thu được nCO2 = (0,55 × 2 + 0,5) = 1,6 và nH2O = (0,55×1,5 + 0,5 + 0,2) = 1,525
⇒ ∑m(CO2 + H2O) = 97,85 gam ⇒ TN1 gấp 2,5 lần TN2.
⇒ m = (0,55 × 57 + 0,5 × 14 + 0,2 × 18) ÷ 2,5 = 16,78 gam
X, Y (MX < MY) là hai axit kế tiếp thuộc cùng dãy đồng đẳng axit fomic; Z là este hai chức tạo bởi X, Y và ancol T. Đốt cháy 25,04 gam hỗn hợp E chứa X, Y, Z, T (đều mạch hở) cần dùng 16,576 lít O2(đktc) thu được 14,4 gam nước. Mặt khác, đun nóng 12,52 gam E cần dùng 380 ml dung dịch NaOH 0,5M. Biết rằng ở điều kiện thường, ancol T không tác dụng được với Cu(OH)2. Phần trăm khối lượng của X có trong hỗn hợp E gần nhất với:
Đáp án D
Bảo toàn khối lượng khi đốt E ⇒ mCO2 = 34,32 gam nCO2 = 0,78 mol < nH2O.
⇒ Ancol T thuộc loại no 2 chức mạch hở.
+ PT bảo toàn oxi: 2a + 4b + 2c = 0,88 (1).
+ PT theo nH2O – nCO2: –b + c = 0,02 (2).
+ PT theo số mol NaOH pứ: a + 2b = 0,38 (3).
+ Giải hệ (1) (2) và (3) ta có: a = 0,3, b = 0,04 và c = 0,06 mol.
⇒ nHỗn hợp = 0,4 mol ⇒ CTrung bình = 1,95 ⇒ 2 Axit là HCOOH và CH3COOH.
⇒ Hỗn hợp ban đầu gồm: CnH2mO2: 0,3; CmH2m-2O4: 0,04; CxH2xO2: 0,06
⇒ PT theo khối lượng hỗn hợp:
0,3(14n+32) + 0,04.[12(x+3) + 2x+4 + 64)] + 0,06.(14x + 34) = 25,04.
4,2n + 1,4x = 9,24 [Với 1 < n < 2 ⇒ 0,6 < x < 3,6].
+ Vì Ancol T không hòa tan Cu(OH)2 ⇒ T là HO–[CH2]3–OH với x = 3.
⇒ n = 1,2 ⇒ nHCOOH = 0,3×(1–0,2) = 0,24 mol ⇒ %mHCOOH = 0,24.46/25,04 = 44,01 %
Phát biểu nào dưới đây đúng?
Thứ tự liên kết giữa các nguyên tử gọi là cấu tạo hóa học.
Ô nhiễm môi trường không khí không do nguyên nhân nào sau đây?
Ô nhiễm môi trường không khí không do nguyên nhân: Khí sinh ra từ quá trình quang hợp của cây xanh.
Lọ thủy tinh không được dùng để đựng dung dịch của chất nào sau đây?
Lọ thủy tinh không được dùng để đựng dung dịch HF
Chất nào sau đây không tác dụng với dung dịch H2SO4 loãng?
Al(OH)3 không tác dụng với dung dịch H2SO4 loãng
Xà phòng hóa chất nào sau đây thu được glixerol?
Xà phòng hóa tristearin thu được glixerol
Kim loại có khối lượng riêng lớn nhất là
Os có khối lượng riêng lớn nhất
Phương pháp điều chế NaOH trong công nghiệp là
Phương pháp điều chế NaOH trong công nghiệp là điện phân dung dịch NaCl bão hòa có màng ngăn.
Tính chất hóa học của sắt là
Tính chất hóa học của sắt là tính khử trung bình
Trong nọc của ong, kiến, ... có chứa nhiều axit fomic. Vì vậy ở chỗ đau do bị ong đốt, người ta thường bôi vào đó chất nào sau đây để đỡ đau?
Ở chỗ đau do bị ong đốt, người ta thường bôi vào đó vôi để đỡ đau
Polime chính của loại tơ nào sau đây được điều chế bằng phản ứng trùng hợp?
Polime chính của loại tơ nitron được điều chế bằng phản ứng trùng hợp
Glucozơ không có tính chất nào sau đây?
Glucozơ không tham gia phản ứng thủy phân
Cho dung dịch NaOH dư vào dung dịch K2Cr2O7, thu được dung dịch có màu
Cho dung dịch NaOH dư vào dung dịch K2Cr2O7, thu được dung dịch có màu vàng
Chất nào dưới đây là chất điện li yếu?
H3PO4 là chất điện li yếu
Cho các phát biểu sau:
(a) Cr và Cr(OH)3 đều có tính lưỡng tính và tính khử.
(b) CrO3 tan trong dung dịch H2SO4 loãng và dung dịch NaOH loãng.
(c) Cr2O3 tan trong dung dịch H2SO4 loãng và dung dịch NaOH loãng.
(d) CrO3 và K2Cr2O7 đều có tính oxi hoá mạnh.
(e) Crom bền trong không khí do có lớp màng oxit bảo vệ.
(g) Ở điều kiện thường, crom (VI) oxit là chất rắn, màu đỏ thẫm.
Số phát biểu đúng là
Số phát biểu đúng là 4
Dãy gồm các chất được sắp xếp theo chiều tăng dần nhiệt độ sôi từ trái sang phải là
HCOOCH3, C2H5OH, HCOOH, CH3COOH
Có các dung dịch sau (dung môi nước): CH3NH2, anilin, HOOCCH2CH(NH2)-COOH, amoniac, H2NCH2CH(NH2)COOH, lysin, axit glutamic. Số chất làm quỳ tím chuyển thành màu xanh là
Số chất làm quỳ tím chuyển thành màu xanh là 4
Cho sơ đồ phản ứng:
(a) X (C5H8O2) + NaOH → X1 (muối) + X2.
(b) Y (C5H8O2) + NaOH → Y1 (muối) + Y2.
Biết X1 và Y1 có cùng số nguyên tử cacbon; X1 có phản ứng với nước brom, còn Y1 thì không. Tính chất hóa học nào giống nhau giữa X2 và Y2?
Tính chất hóa học nào giống nhau giữa X2 và Y2: Bị oxi hóa bởi O2 (xúc tác) thành axit cacboxylic
Cho các phát biểu sau:
(a) Nguyên tắc sản xuất gang là oxi hóa các oxit sắt bằng khí CO ở nhiệt độ cao.
(b) Cu và Fe2O3 tỉ lệ mol 1 : 1 tan hoàn toàn trong dung dịch HCl dư.
(c) Trong các kim loại, crom là kim loại cứng nhất, xesi là kim loại mềm nhất.
(d) Al(OH)3, Cr(OH)3, Cr2O3 đều tan trong dung dịch NaOH loãng.
(e) Thạch cao sống được sử dụng để bó bột trong y học.
(f) Sr, Na, Ba và Be đều tác dụng mạnh với H2O ở nhiệt độ thường.
Số phát biểu đúng là
Số phát biểu đúng là 2
Phản ứng nào sau đây có phương trình ion thu gọn là : H+ + OH- → H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O