Đề thi thử THPT QG năm 2022 môn Hóa học - Trường THPT Hoàng Mai
Đề thi thử THPT QG năm 2022 môn Hóa học - Trường THPT Hoàng Mai
-
Hocon247
-
40 câu hỏi
-
90 phút
-
146 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Cấu hình electron của nguyên tử Na là
Na (Z =11): 1s22s22p63s1 hay [Ne] 3s1
Đáp án D
Cho các cặp chất sau đây: dung dịch Fe(NO3)2 và dung dịch HCl (1), CO2 và dung dịch Na2CO3 (2), dung dịch KHSO4 và dung dịch HCl (3), dung dịch NH3 và AlCl3 (4), SiO2 và dung dịch HCl (5), C và CaO (6). Số cặp chất xảy ra phản ứng hóa học (điều kiện cần thiết có đủ) là
Các cặp chất xảy ra phản ứng hóa học là:
(1) 9Fe(NO3)2 + 12HCl → 4FeCl3 + 5Fe(NO3)3 + 3NO + 6H2O
(2) CO2 + Na2CO3 + H2O → 2NaHCO3
(4) 3NH3 + 3H2O + AlCl3 → Al(OH)3↓ + 3NH4Cl
⟹ có 3 cặp chất xảy ra phản ứng
Đáp án B
Dẫn khí CO dư qua hỗn hợp X (đốt nóng) gồm Fe2O3, Al2O3, ZnO, CuO phản ứng hoàn toàn thu được chất rắn Y gồm
CO chỉ khử được các oxit của các kim loại đứng sau Al trong dãy điện hóa.
→ CO khử được Fe2O3, ZnO, CuO.
→ Chất rắn sau pư chứa: Fe, Zn, Cu, Al2O3.
Đáp án C
Chất nào sau đây không làm mất tính cứng của nước cứng tạm thời?
Nước cứng tạm thời chứa các muối Ca(HCO3)2 và Mg(HCO3)2
Để làm mất được tính cứng của nước cứng tạm thời thì phải chuyển được các ion Ca2+ và Mg2+ có trong dung dịch về dạng kết tủa.
Ca(OH)2, NaOH và Na2CO3 đều chuyển các ion này được về dạng CaCO3, MgCO3 hoặc Mg(OH)2
=> Làm mất được tính cứng
HCl không làm mất được tính cứng do:
HCl + Ca(HCO3)2 → CaCl2 + CO2 + H2O
HCl + Mg(HCO3)2 → MgCl2 + CO2 + H2O
CaCl2, MgCl2 vẫn tan trong dd => không loại bỏ được
Đáp án B
Chất nào sau đây có trạng thái lỏng ở điều kiện thường
(C17H33COO)3C3H5: là este tạo bởi C3H5(OH)3 và axit béo không no có chứa 1 nối đôi C=C là C17H33COOH
=> ở trạng thái lỏng ở đk thường.
Đáp án A
Hòa tan hoàn toàn hỗn hợp gồm 4,6 gam Na và 2,7 gam Al vào nước dư thu được V lít H2 (đktc) và dung dịch X. Giá trị của V là
nNa = 4,6 : 23 = 0,2 (mol)
nAl = 2,7 : 27 = 0,1 (mol)
PTHH: 2Na + 2H2O → 2NaOH + H2↑
0,2 →0,2 0,1 (mol)
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
0,1 → 0,15 (mol)
→ nH2 = 0,1 + 0,15 = 0,25 (mol)
→ VH2(đktc) = 0,25.22,4 = 5,6 (l)
Đáp án B
Cho các phát biểu sau:
(1) Axit axetic có nhiệt độ sôi cao hơn ancol etylic.
(2) Vinyl axetat có khả năng làm mất màu nước brôm.
(3) Tinh bột khi thủy phân trong môi trường kiềm chỉ tạo ra glucozơ.
(4) Dung dịch anbumin trong nước khi đun sôi bị đông tụ.
(5) Phenol dùng để sản xuất thuốc nổ (2,4,6-trinitrophenol).
Số phát biểu đúng là
Các phát biểu đúng là: (1), (2), (4), (5)
(3) sai vì tinh bột thủy phân trong môi trường axit ra glucozơ chứ không phải môi trường kiềm.
=> có 4 phát biểu đúng
Đáp án B
Khí sinh ra trong trường hợp nào sau đây không gây ô nhiễm không khí?
A. 2Al2O3 \(\xrightarrow{{dpnc}}\) 4Al + 3O2
B. C2H5OH + O2 \(\xrightarrow{{men.giam}}\) CH3COOH + H2O
C. C6H12O6 \(\xrightarrow{{men.ruou}}\) 2C2H5OH + 2CO2↑
D. 2NaCl + 2H2O \(\xrightarrow{{dpmn}}\) 2NaOH + H2 + Cl2
Khí CO2, Cl2 sinh ra đều gây ô nhiễm không khí. Khí O2 sinh ra không gây ô nhiễm không khí.
Đáp án A
Cho 13,2 gam hỗn hợp gồm Mg và MgCO3 (tỉ lệ số mol 2 : 1) vào dung dịch H2SO4 loãng, dư thu được V lít khí (đktc). Giá trị của V là
Đặt nMg = 2x ; nMgCO3 = x (mol)
Ta có: 24.2x + 84.x = 13,2 => x = 0,1
Vậy nMg = 0,2 (mol); nMgCO3 = 0,1 (mol)
PTHH: Mg + H2SO4 → MgSO4 + H2
0,2 → 0,2 (mol)
MgCO3 + H2SO4 → MgSO4 + CO2↑ + H2O
0,1 → 0,1 (mol)
=> ∑nH2+CO2 = 0,2+ 0,1 = 0,3 (mol)
=> Vkhí = 0,3.22,4 = 6,72 (l)
Đáp án B
Cho m gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư thu được 2,688 lít khí NO (sản phẩm khử duy nhất, đktc) và dung dịch X. Cho dung dịch X tác dụng với dung dịch NaOH dư thu được kết tủa. Lọc kết tủa nung trong không khí đến khối lượng không đổi được 25,6 gam chất rắn khan. Giá trị của m là
nNO = 2,688: 22,4 = 0,12 (mol)
nFe2O3 = 25,6 : 160 = 0,16 (mol)
Coi hỗn hợp X gồm có Fe và O có số mol lần lượt là a và b (mol)
Quá trình nhường e Quá trình nhận e
Fe → Fe +3e O +2e→ O-2
a 3a b 2b
N+5 + 3e → N+2
0,36 ← 0,12 (mol)
\(\left\{ \begin{array}{l}{n_{e\,nhuong}} = {n_{e\,nhan}}\\BT:F{\rm{e}} \to {n_{F{\rm{e}}}} = 2{n_{F{{\rm{e}}_2}{O_3}}}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}3{\rm{a}} = 2b + 0,36\\a = 2.0,16\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,32\\b = 0,3\end{array} \right.\)
=> m = mFe + mO = 0,32.56 + 0,3.16 = 22,72 (g)
Đáp án D
Phenol và etanol đều phản ứng với
C6H5OH và C2H5OH đều phản ứng được với Na:
C6H5OH + Na → C6H5ONa + 1/2 H2
C2H5OH + Na → C2H5ONa + 1/2 H2
Đáp án A
Cho phản ứng: NaOH + HClO → NaClO + H2O. Phương trình ion thu gọn của phản ứng trên là
PT phân tử: NaOH + HClO → NaClO + H2O
+ PT ion đầy đủ: Na+ + OH- + HClO → Na + + ClO- + H2O
+ PT ion rút gọn: OH- + HClO → ClO- + H2O
Đáp án D
Cho 7,2 gam hỗn hợp X gồm ancol etylic, ancol anlylic và glixerol tác dụng với Na kim loại dư thu được 2,24 lít khí H2 (đktc). Mặt khác, đốt 7,2 gam hỗn hợp X, sản phẩm cháy cho qua bình đựng dung dịch H2SO4 đặc, dư thấy khối lượng bình tăng 6,3 gam, khí còn lại được dẫn qua bình đựng 800 ml dung dịch Ba(OH)2 0,2M. Sau khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây?
nOH (ancol) = 2nH2 = 2.0,1 = 0,2 (mol) ⟹ nO(trong ancol) = nOH = 0,2 (mol)
BTNT "H": nH(trong ancol) = 2nH2O = 0,7 (mol)
BTKL: mC = mX – mH – mO = 7,2 – 0,7 – 0,2.16 = 3,3 (g)
⟹ nC = 3,3 : 12 = 0,275 (mol)
BTNT “C”: nCO2 = nC = 0,275 (mol)
nOH- = 2nBa(OH)2 = 0,32 mol
Xét tỉ lệ: \(1 < \dfrac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}} = \dfrac{{0,32}}{{0,275}} = 1,16 < 2\) ⟹ Tạo 2 muối BaCO3 và Ba(HCO3)2
Ba(OH)2 + CO2 → BaCO3↓ + H2O
a a a (mol)
Ba(OH)2 + 2CO2 → Ba(HCO3)2
b 2b (mol)
\(\left\{ \begin{array}{l}{n_{C{O_2}}} = a + 2b = 0,275\\{n_{Ba{{\left( {OH} \right)}_2}}} = a + b = 0,16\end{array} \right. \to \left\{ \begin{array}{l}a = 0,045\\b = 0,115\end{array} \right.\)
⟹ mBaCO3↓ = 0,045×197 = 8,865 (g) gần nhất với 9 gam
Để đánh giá độ dinh dưỡng của phân kali người ra dựa vào hàm lượng phần trăm của
Độ dinh dưỡng của phân kali được đánh giá bằng hàm lượng phần trăm khối lượng K2O tương ứng với lượng K có trong thành phần của nó.
Đáp án D
Cho 100 ml dung dịch gồm MgCl2 1M và AlCl3 2M tác dụng với 500 ml dung dịch Ba(OH)2 0,85M thu được m gam kết tủa.Giá trị của m là
nMgCl2 = 0,1 (mol); nAlCl3 = 0,2 (mol)
nBa(OH)2 = 0,5. 0,85 = 0,425 (mol) => nOH- = 2nBa(OH)2 = 0,85 (mol)
Các PT ion xảy ra là:
Mg2+ + 2OH- → Mg(OH)2 (1)
0,1 → 0,2 → 0,1 (mol)
Sau phản ứng (1): nOH- còn lại là: 0,85 – 0,2 = 0,65 (mol)
Ta có: \(3 < {{{n_{O{H^ - }}}} \over {{n_{A{l^{3 + }}}}}} = {{0,65} \over {0,2}} = 3,25 < 4\) => xảy ra 2 phản ứng tạo kết tủa Al(OH)3 sau đó kết tủa tan 1 phần.
3OH- + Al3+ → Al(OH)3↓ (2)
OH- + Al(OH)3↓→ AlO2- + 2H2O (3)
CT nhanh: nAl(OH)3 còn lại = 4nAl3+ - nOH- = 4.0,2 – 0,65 = 0,15 (mol)
=> m↓ = mMg(OH)2 + mAl(OH)3 còn lại = 0,1. 58 + 0,15.78 = 17,5 (g)
Đáp án C
Cho các polime: Polietilen, poli(metyl metacrylat), polibutađien, polistiren, poli(vinyl axetat) và tơ nilon-6,6. Số polime có thể bị thủy phân trong dung dịch axit và dung dịch kiềm là
Các polime bị thủy phân trong môi trường axit và kiềm là:
Poli(metyl metacrylat); poli (vinyl axetat), nilon -6,6 => có 3 polime
Đáp án B
Ở điều kiện thường, kim loại Al không tan trong dung dịch nào sau đây?
Dd NH3 có môi trường bazơ quá yếu nên không hòa tan được Al
Đáp án D
Cho các phát biểu sau:
(1) Sắt là kim loại phổ biến thứ 2 trong vỏ trái đất.
(2) Để điều chế kim loại nhôm, người ta có thể dùng phương pháp thủy luyện, nhiệt luyện hoặc điện phân.
(3) Trong công nghiệp, quặng sắt có giá trị để sản xuất gang là hemantit và manhetit.
(4) Sắt tây (sắt tráng thiếc), tôn (sắt tráng kẽm) khi để trong không khí ẩm và bị xây xước sâu đến lớp bên trong thì sắt tây bị ăn mòn nhanh hơn tôn.
(5) NaHCO3 có thể dùng làm thuốc chứa bệnh, tạo nước giải khát có ga.
(6) Thứ tự bị khử ở catot khi điện phân bằng điện cực trơ là Ag+, Fe3+, Cu2+, Fe2+, Al3+, H2O.
(7) Fe bị oxi hóa bởi hơi nước ở nhiệt độ cao có thể tạo FeO (trên 570°C) hoặc Fe3O4 (dưới 570°C).
(8) Trong pin Zn-Cu, điện cực Zn là catot, xảy ra quá trình oxi hóa.
Số phát biểu đúng là?
(1) đúng Fe là kim loại phổ biến thứ 2 trong vỏ trái đất, chỉ sau kim loại Al
(2) sai vì Al chỉ điều chế được bằng phương pháp thủy luyện hoặc điện phân
(3), (4), (5) đúng
(6) sai vì Al3+ không bị điện phân
(7) đúng
\(3Fe + 4{H_2}O\xrightarrow{{{t^0} < {{570}^0}C}}F{e_3}{O_4} + 4{H_2} \uparrow \)
\(Fe + {H_2}O\xrightarrow{{{t^0} > {{570}^0}C}}FeO + {H_2} \uparrow \)
(8) sai vì Trong pin Zn – Cu, điện cực Zn là anot, xảy ra quá trình oxi hóa
=> có 5 phát biểu đúng
Đáp án C
Lên men m gam glucozơ với hiệu suất 72%. Lượng CO2 sinh ra được hấp thụ hoàn toàn vào 500ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra 9,85 gam kết tủa.Giá trị lớn nhất của m là
nNaOH = 0,05 (mol); nBa(OH)2 = 0,5.0,2 = 0,1 (mol) => ∑nOH- = 0,25 (mol)
nBaCO3 = 9,85 : 197 = 0,05 (mol)
Để giá trị m lớn nhất thì lượng CO2 cần là lớn nhất => xảy ra tạo cả CO32- và HCO3-
CO2 + OH- → HCO3- (1)
0,15 ← (0,25-0,1) (mol)
CO2 + 2OH- → CO32- + 2H2O (2)
0,05←0,1 ← 0,1 (mol)
Ba2+ + CO32- → BaCO3↓ (3)
0,05 ← 0,05 (mol)
Do nBaCO3 = 0,05 (mol) < nBa2+ nên Ba2+ dư, mọi tính toán (3) theo BaCO3↓ và CO32-
nCO2(2) = nCO32-(2) = nBaCO3 = 0,05 (mol)
nOH-(1) = ∑nOH- - nOH-(2) = 0,25- 0,1= 0,15(mol)
nCO2(1) = nOH-(1) = 0,15 (mol)
=> ∑ nCO2(1)+(2) = 0,15 + 0,05 = 0,2 (mol)
C6H12O6 → 2CO2 + 2C2H5OH
0,1 ← 0,2 (mol)
=> mC6H12O6 lí thuyết = 0,1.180 = 18 (g)
Vì %H = 72% => mC6H12O6 thực tế = 18. 100% : 72% = 25 (g)
Đáp án C
Hỗn hợp X gồm Al, Fe2O3, Fe3O4 và CuO, trong đó oxi chiếm 25,39% khối lượng hỗn hợp. Cho m gam hỗn hợp X tác dụng với 13,44 lít khí CO (đktc), sau một thời gian thu được chất rắn Y và hỗn hợp khí Z có tỉ khối hơi so với H2 bằng 19. Cho chất rắn Y tác dụng với lượng dư dung dịch HNO3 loãng, thu được dung dịch T và 10,752 lít khí NO (ở đktc, là sản phẩm khử duy nhất). Cô cạn dung dịch T, thu được 5,184m gam muối khan. Giá trị của m gần nhất với giá trị nào dưới đây?
Đặt số mol các khí trong hỗn hợp Z: CO (x mol) và CO2 (y mol)
BTNT “C”: nCO = nCO dư + nCO2 => x + y = 0,6 mol
mZ = mCO + mCO2 => 28x + 44y = 0,6.38
Giải hệ trên được x = 0,225 và y = 0,375
Đặt nO(X) = a mol
CO + [O] → CO2
nO pư = nCO2 = 0,375 mol => nO(Y) = a – 0,375 (mol)
Sơ đồ bài toán:
\(m(g)\,X\left\{ \begin{gathered}
Al \hfill \\
Fe \hfill \\
Cu \hfill \\
O(25,39\% ):a \hfill \\
\end{gathered} \right. + CO:0,6 \to Z\left\{ \begin{gathered}
CO:0,225 \hfill \\
C{O_2}:0,375 \hfill \\
\end{gathered} \right.({\overline M _Z} = 38) + Y\left\{ \begin{gathered}
Al \hfill \\
Fe \hfill \\
Cu \hfill \\
O\,du:a - 0,375 \hfill \\
\end{gathered} \right.\xrightarrow{{ + HN{O_3}\,du}}\underbrace {T\left\{ \begin{gathered}
A{l^{3 + }} \hfill \\
F{e^{3 + }} \hfill \\
C{u^{2 + }} \hfill \\
N{O_3}^ - \hfill \\
\end{gathered} \right.}_{5,184m(g)} + NO:0,48\)
nNO3- = n e trao đổi = 3nNO + 2nO(Y) = 3.0,48 + 2(a-0,375)
m muối = mKL + mNO3- => mKL + 62(2a+0,69) = 5,184a (1)
mX = mKL + mO => mKL + 16a = m (2)
Mà trong X oxi chiếm 25,39% về khối lượng nên ta có: 16a = 0,2539m (3)
Giải (1) (2) (3) thu được m = 17,32 gam gần nhất với 17 gam
Đáp án C
Đốt cháy 4,425 gam hỗn hợp gồm Zn và Fe (có tỉ lệ mol tương ứng là 1 : 2) với hỗn hợp khí X gồm clo và oxi, sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không còn khí dư). Hòa tan Y bằng một lượng vừa đủ 120 ml dung dịch HCl 1M, thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z, thu được 28,345 gam kết tủa. Phần trăm khối lượng của clo trong hỗn hợp X là
Đặt số mol Zn và Fe lần lượt là x, y (mol)
Theo đề bài ta có hệ phương trình:
65x + 56y = 4,425 (1)
x : y = 1 : 2 (2)
Giải hệ thu được x = 0,025 và y = 0,05
Cho H+ phản ứng với Y có phản ứng:
2H+ + O2- → H2O
nO(Y) = nH+ : 2 = 0,06 mol => nO2 (X) = 0,03 mol
Bảo toàn electron cho cả quá trình ta có:
2nZn + 3nFe = 4nO2 + 2nCl2 + nAg => 0,025.2 + 0,05.3 = 4.0,03 + 2a + b (i)
BTNT “Cl” ta có: 2nCl2 + nHCl = nAgCl => 2a + 0,12 = c (ii)
Khối lượng kết tủa thu được: 108b + 143,5c = 28,345 (iii)
Giải (i) (ii) (iii) thu được a = 0,035; b = 0,01; c = 0,19
\( \to \% {m_{C{l_2}}} = \frac{{71.0,035}}{{32.0,03 + 71.0,035}}.100\% = 72,13\% \)
Đáp án A
Cho các phát biểu sau:
(a) Có thể dùng AgNO3/NH3 dư, to để phân biệt fructozo và glucozo;
(b) Trong môi trường bazo, fructozo và glucozo có thể chuyển hóa qua lại;
(c) Trong dung dịch nước, glucozo chủ yếu tồn tại dưới dạng mạch vòng;
(d) Xenlulozo và tinh bột là đồng phân của nhau;
(e) Saccarozo có tính chất của ancol đa chức và anđehit đơn chức;
(g) Amilozo là polime có mạch không phân nhánh, amilopectin là polime có mạch phân nhánh.
Số phát biểu đúng là
(a) sai vì glucozo và fructozo đều có phản ứng tráng gương với AgNO3/NH3 dư, to
(b) đúng
(c) đúng
(d) sai vì tuy chúng đều có công thức chung là (C6H10O5)n những số lượng mắt xích không giống nhau nên không là đồng phân của nhau
(e) sai vì saccarozo không có nhóm –CHO nên không có tính chất của anđehit
(g) đúng
=> Có 3 phát biểu đúng
Đáp án B
Hợp chất X có công thức phân tử C10H8O4. Từ X thực hiện phản ứng (theo đúng tỉ lệ mol):
C10H8O4 + 2NaOH → X1 + X2.
X1 + 2HCl → X3 + 2NaCl
nX3 + nX2 → Poli(etylen terephtalat) + 2nH2O
Cho các phát biểu sau:
(1) Số nguyên tử H của X3 lớn hơn X2.
(2) Dung dịch X2 hòa tan Cu(OH)2 tạo dung dịch màu xanh lam.
(3) Dung dịch X3 có thể làm quỳ tím chuyển màu hồng.
(4) Nhiệt độ nóng chảy của X1 cao hơn X3.
Số phát biểu đúng là
C10H8O4 có độ bất bão hòa k = (10.2 + 2-8)/2 = 7
C8H10O4 pư với NaOH theo tỉ lệ 1: 2 => X là este 2 chức
X1 +2HCl → X3 + 2NaCl
X1 là muối của axit 2 chức
X3 là axit => X3 là: C6H4(COOH)2
X2 là: C2H4(OH)2
X1 là: C6H4(COONa)2
X là: C6H4(COO)2C2H4
C6H4(COO)2C2H4 + 2NaOH → C6H4(COONa)2 + C2H4(OH)2
X X1 X2
C6H4(COONa)2 + 2HCl → C6H4(COOH)2 + 2NaCl
X1 X3
nC6H4(COOH)2 + nC2H4(OH)2 → -(CO-C6H4-CO-O-CH2-CH2-O-)n + 2nH2O
X3 X2
(1) Sai vì số nguyên tử H trong X3 là 2 < số nguyên tử H trong X2 là 6
(2) đúng
(3) đúng
(4) đúng
=> có 3 phát biểu đúng
Đáp án C
Cho các phát biểu sau:
(a) Anđehit vừa có tính oxi hóa vừa có tính khử.
(b) Phenol tham gia phản ứng thế brom khó hơn benzen.
(c) Anđehit tác dụng với H2 (dư) có xúc tác Ni đun nóng, thu được ancol bậc 1.
(d) Dung dịch axit axetic có khả năng hòa tan Cu(OH)2.
(e) Dung dịch phenol quỳ tím hóa đỏ.
(g) Trong công nghiệp, ancol etylic có thể sản xuất từ etylen hoặc tinh bột.
Số phát biểu đúng là
(b) Sai vì phenol tham gia phản ứng thế dễ hơn benzen.
(e) Sai vì tính axit của phenol rất yếu nên không làm quỳ tím chuyển màu
Đáp án C
Mưa axit là một trong những hiện tượng thể hiện sự ô nhiễm môi trường, thường gặp ở các khu công nghiệp và những khu vực lân cận. Mưa axit phá hủy nhiều công trình xây dựng, ảnh hưởng lớn đến môi trường đất, nước... Tác hại của mưa axit được gây ra chủ yếu bởi axit
Mưa axit gây ra bởi HNO3 và H2SO4.
Đáp án B
Cho m gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư thu được 2,688 lít khí NO (sản phẩm khử duy nhất, đktc) và dung dịch X. Cho dung dịch X tác dụng với dung dịch NaOH dư thu được kết tủa. Lọc kết tủa nung trong không khí đến khối lượng không đổi được 25,6 gam chất rắn khan. Giá trị của m là
nNO = 2,688: 22,4 = 0,12 (mol)
nFe2O3 = 25,6 : 160 = 0,16 (mol)
Coi hỗn hợp X gồm có Fe và O có số mol lần lượt là a và b (mol)
Quá trình nhường e Quá trình nhận e
Fe → Fe +3e O +2e→ O-2
a 3a b 2b
N+5 + 3e → N+2
0,36 ← 0,12 (mol)
\(\left\{ \matrix{
{n_{e\,nhuong}}\, = n{\,_{e\,nhan}} \hfill \cr
BTNT\,Fe:{n_{Fe}} = 2{n_{F{e_2}{O_{^3}}}} \hfill \cr} \right. \Rightarrow \left\{ \matrix{
3a = 2b + 0,36 \hfill \cr
a = 2.0,16 \hfill \cr} \right. \Rightarrow \left\{ \matrix{
a = 0,32 \hfill \cr
b = 0,3 \hfill \cr} \right.\)
=> m = mFe + mO = 0,32.56 + 0,3.16 = 22,72 (g)
Đáp án D
Cho dãy các chất sau: metan, axetilen, isopren, benzen, axit axetic, stiren, axeton, metylacrylat. Số chất trong dãy tác dụng được với H2 nung nóng, xúc tác Ni là
Các chất tác dụng được với H2 nung nóng, xt Ni là: axetilen (CH≡CH), isopren (CH2=CH(CH3)CH2CH3), benzen (C6H6), stiren (C6H5CH=CH2), axeton (CH3COCH3), metyacrylat (CH2=CH-COOCH3)
⟹ Có 6 chất.
Đáp án A
Cho các chất sau: C2H5OH, C12H22O11, C2H5COOH, C2H5NH3Cl, H3PO4, NaClO, BaSO4, Fe(OH)3. Số chất điện li yếu là
Các chất điện li yếu là: C2H5OH, C2H5COOH, H3PO4, Fe(OH)3 ⟹ có 4 chất
Đáp án A
Phản ứng nào sau đây xảy ra trong dung dịch tạo kết tủa Fe(OH)2:
Fe(NO3)2 + 2NH3 + 2H2O → Fe(OH)2↓ + 2NH4NO3
Đáp án A
Cho X, Y, Z là ba peptit đều mạch hở và MX > MY > MZ. Đốt cháy hoàn toàn a mol mỗi peptit X, Y hoặc Z đều thu được số mol CO2 nhiều hơn số mol H2O là a mol. Mặt khác, nếu đun nóng 69,8 gam hỗn hợp E (chứa X, Y và 0,16 mol Z; số mol của X nhỏ hơn số mol của Y) với dung dịch NaOH vừa đủ, thu được dung dịch chỉ chứa 2 muối của alanin và valin có tổng khối lượng 101,04 gam. Phần trăm khối lượng của X có trong hỗn hợp E gần nhất với giá trị nào sau đây?
Do khi đốt a mol mỗi peptit đều thu được số mol CO2 nhiều hơn số mol H2O là a mol mà các peptit đều được tạo từ các aminoaxit no, có 1 nhóm NH2 và 1 nhóm COOH nên các peptit này có số lượng mắt xích như nhau.
Giả sử số mắt xích mỗi peptit là k => CTTQ: CnH2n+2-2k+kNkOk+1
CnH2n+2-2k+kNkOk+1→ nCO2 + (n+1-0,5k)H2O
a na a(n+1-0,5k)
=> na – a(n+1-0,5k) = a => k = 4
Vậy các peptit đều là tetrapeptit
Đặt npeptit = a mol => nNaOH = 4a mol; nH2O = a mol
BTKL: m peptit + mNaOH = m muối + mH2O => 69,8 + 4a.40 = 101,04 + 18a => a = 0,22 mol
Đặt số mol muối của Ala và Val lần lượt là a và b (mol)
BTNT “Na”: a + b = nNaOH = 0,88 (1)
m muối = 111a + 139b = 101,04 (2)
Giải (1) và (2) được a = 0,76 mol và b = 0,12 mol
Sơ đồ bài toán:
\(69,8(g)\left\{ \begin{gathered}
X \hfill \\
Y \hfill \\
Z:0,16 \hfill \\
\end{gathered} \right.\xrightarrow{{ + NaOHvd}}\left\{ \begin{gathered}
Ala - Na:0,76 \hfill \\
Val - Na:0,12 \hfill \\
\end{gathered} \right.\)
BTNT “C”: nC(X) = 2nAla-Na + 5nVal-Na = 2.0,76 + 5.0,12 = 2,12 mol
=> C trung bình = 2,12 : 0,22 = 9,6 chứng tỏ trong X có peptit có số C nhỏ hơn 9,6
Số mắt xích Val trung bình = 0,12 : 0,22 = 0,54 => Có peptit không chứa Val
=> C(Z) = 8 => Z là Ala4 (M = 89.4-18.3 = 302)
=> nAla(X, Y) = 0,76 – 0,16.4 = 0,12
Mặt khác:
nX + nY = 0,22 – 0,16 = 0,06 mol
mX + mY = m hh – mZ = 69,8 – 0,16.302 = 21,48 gam
=> M(X, Y) = 21,48 : 0,06 = 358 => Y là Ala3Val (M = 330)
Do Ala2Val2 (M = 358) nên X không thể là chất này. Có 2 trường hợp sau:
TH1:
X là AlaVal3 (x mol)
Y là Ala3Val (y mol)
x + y = 0,06
x + 3y = nAla(X,Y) = 0,12
=> x = y = 0,03 loại do không thỏa mãn nX < nY
TH2:
X là Val4 (x mol)
Y là Ala3Val (y mol)
nAla(X,Y) = 3y = 0,12 => y = 0,04 => x = 0,02 (thỏa mãn)
=> %mX = (0,02.414/69,8).100% = 11,86% gần nhất với 12%
Đáp án D
Điện phân (với điện cực trơ, cường độ dòng điện không đổi) dung dịch muối nitrat của một kim loại M (có hóa trị không đổi). Sau thời gian t giây, khối lượng dung dịch giảm 5,22 gam và tại catot chỉ thu được a gam kim loại M. Sau thời gian 2t giây, khối lượng dung dịch giảm 8,835 gam và tại catot thoát ra 0,168 lít khí (đktc). Giá trị của a gần nhất với
* t giây: Đặt ne = x (mol)
Catot: Mn+ + ne → M0
x → x/n
Anot: H2O -2e → 2H+ + 0,5O2
x → 0,25x (mol)
=> m dd giảm = mM + mO2 = \(\frac{x}{n}.M + 0,25x.32\) = 5,22 hay \(\frac{x}{n}.M + 8x\) = 5,22 (1)
* 2t giây => ne = 2x (mol)
nH2 = 0,168 : 22,4 = 0,0075 mol
Catot: Mn+ + ne → M0
2x – 0,015 → (2x-0,015)/n
H2O + 1e → OH- + 0,5H2
0,015 ← 0,0075
Anot: H2O -2e → 2H+ + 0,5O2
2x → 0,5x (mol)
=> m dd giảm = mM + mH2 + mO2 = \(\frac{{2x - 0,015}}{n}.M + 0,0075.2 + 0,5x.32\) = 8,835
hay \(\frac{{2x}}{n}.M + 16x - 0,015\frac{M}{n}\) = 8,82(2)
Lấy 2(1) – (2) được 0,015.M/n = 1,62 => M = 108n
=> n = 1, M = 108 thỏa mãn => x = 0,045
=> M là Ag
Xét điện phân sau t giây: nAg = x = 0,045 mol => a = 0,045.108 = 4,86 gam gần nhất với 4,9 gam
Đáp án B
Hỗn hợp E chứa chất X (C8H15O4N3) và chất Y (C10H19O4N); trong đó X là một peptit, Y là este của axit glutamic. Đun nóng 73,78 gam hỗn hợp E với dung dịch NaOH vừa đủ, thu được dung dịch có chứa m gam muối của alanin và hỗn hợp F chứa 2 ancol. Đun nóng toàn bộ F với H2SO4 đặc ở 140oC, thu được 21,12 gam hỗn hợp ete. Các phản ứng xảy ra hoàn toàn. Giá trị m là
Ta thấy: mX = MY = 217 g/mol => n hỗn hợp = 73,78 : 217 = 0,34 mol
X là Ala2Gly (x mol); Y là ROOC-C-C-C(NH2)-COOR’ (y mol)
Ancol là ROH và R’OH có tổng cộng 5C nên đặt công thức chung của ancol là CnH2n+2O (vì ancol có số mol bằng nhau nên n = 2,5) => C2,5H7O
2C2,5H7O → C5H12O + H2O
0,48 ← 0,24 (mol)
→ n ancol = 2y = 0,48 => y = 0,24 mol
→ x = 0,34 – 0,24 = 0,1 mol
→ nAla = 2x = 0,2 mol => nAla-Na= 0,2 mol
→ m = 0,2.111 = 22,2 gam
Đáp án C
Nhỏ từ từ dung dịch Ba(OH)2 vào dung dịch chứa đồng thời HCl và Al2(SO4)3. Đồ thị phụ thuộc khối lượng kết tủa và số mol Ba(OH)2 được biểu diễn như hình sau:
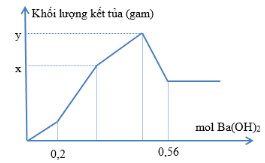
Tổng (x + y) gần nhất bằng
- Tại nBa(OH)2 = 0,2 mol thì H+ vừa bị trung hòa hết ⟹ nH+ = 2nBa(OH)2 = 0,4 mol
- Tại nBa(OH)2 = 0,56 mol thì Al(OH)3 vừa bị hòa tan hết
⟹ nOH- = nH+ + 4nAl3+ ⟹ 0,56.2 = 0,4 + 4nAl3+
⟹ nAl3+ = 0,18 mol ⟹ nAl2(SO4)3 = 0,09 mol
⟹ nSO42- = 0,27 mol
- Khi m kết tủa = y gam ⟹ Các kết tủa đều đạt cực đại: Al(OH)3 (0,18 mol) và BaSO4 (0,27 mol)
⟹ y = 0,18.78 + 0,27.233 = 76,95 gam
- Khi m kết tủa = x gam ⟹ BaSO4 đạt cực đại ⟹ nBaSO4 = 0,27 mol
⟹ BTNT “Ba”: nBa(OH)2 = nBaSO4 = 0,27 mol ⟹ nOH- = 2nBa(OH)2 = 0,54 mol
Khi đó: nOH- = nH+ + 3nAl(OH)3 ⟹ 0,54 = 0,4 + 3nAl(OH)3 ⟹ nAl(OH)3 = 7/150 mol
⟹ x = mAl(OH)3 + mBaSO4 = (7/150).78 + 0,27.233 = 66,55 gam
⟹ x + y = 66,55 + 76,95 = 143,5 gam gần nhất với 143 gam
Cho các chất hữu cơ mạch hở: X là axit no, hai chức; Y và Z là hai ancol không no, đơn chức (MY>MZ); T là este của X, Y, Z (chỉ chứa chức este). Đốt cháy hoàn toàn a gam hỗn hợp M gồm Z và T, thu được 0,27 mol CO2 và 0,18 mol H2O. Cho 0,06 mol M phản ứng vừa đủ với dung dịch NaOH, co cạn dung dịch sau phản ứng thu được muối khan E và hỗn hợp ancol G. Đốt cháy hoàn toàn E thu được CO2, H2O và 0,04 mol Na2CO3. Đốt cháy hoàn toàn G, thu được 0,3 mol CO2. Phần trăm khối lượng của T trong M có giá trị gần nhất với giá trị nào sau đây?
nE = nT = nNa2CO3 = 0,04 mol
=> nZ(M) = nM – nE = 0,02 mol
Vậy G gồm ZOH (0,04 + 0,02 = 0,06 mol) và YOH (0,04 mol). Đặt n, m là số C tương ứng của ZOH và YOH
nCO2 = 0,06n + 0,04m = 0,3
=> 3n + 2m = 15
Các ancol không no nên n, m ≥ 3 => n = m = 3 là nghiệm duy nhất
Z là CH≡C-CH2OH
Y là CH2=CH-CH2OH
Trong 0,06 mol M gồm có:
CH≡C-CH2-OOC-CnH2n-COO-CH2-CH=CH2 (0,04 mol)
CH≡C-CH2OH (0,02 mol)
=> nC = 0,04(n+8) + 0,02.3 = 0,04n + 0,38
Và nH = 0,04(2n+8) + 0,02.4 = 0,08n + 0,4
=> nC/nH = (0,04n + 0,38)/(0,08n + 0,4) = 0,27/0,18.2
=> n = 4
=> %mT = 88,89%
Một bình kín chỉ chứa một ít bột niken và hỗn hợp X gồm 0,05 mol điaxetilen (HC≡C-C≡CH), 0,1 mol hiđro. Nung nóng bình một thời gian, thu được hỗn hợp khí Y có tỉ khối hơi so với H2 bằng 22,5. Cho Y phản ứng vừa đủ với 0,04 mol AgNO3 trong dung dịch NH3, sau phản ứng thu được 5,84 gam kết tủa và thoát ra 0,672 lít (đktc) hỗn hợp khí Z. Khí Z phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
BTKL ⟹ mX = mY = 2,7 g. ⟹ nY = 2,7/45 = 0,06 mol
nkhí giảm = nH2 pư = nX – nY = (0,05 + 0,1) – 0,06 = 0,09 mol
Các chất có khả năng phản ứng với AgNO3 là:
HC≡C-C≡CH (a mol)
HC≡C-CH=CH2 (b mol)
HC≡C-CH2-CH3 (c mol)
⟹ a + b + c = nY – nZ = 0,03 (1)
⟹ nAgNO3 = 2a + b + c = 0,04 (2)
m kết tủa = mAgC≡C-C≡CAg + mAgC≡C-CH=CH2 + mAgC≡C-CH2-CH3
⟹ 264a + 159b + 161c = 5,84 (3)
Từ (1)(2)(3) ⟹ a = b = c = 0,01 mol.
Bảo toàn số mol liên kết π ⟹ npi(X) = nH2 pư + 4a + 3b + 2c + nBr2
⟹ 0,05.4 = 0,09 + 4.0,01 + 3.0,01 + 2.0,01 + nBr2
⟹ nBr2 = 0,02 mol.
Đáp án A
Cao su lưu hóa (loại cao su được tạo thành khi cho cao su thiên nhiên tác dụng với lưu huỳnh) có khoảng 1,849% lưu huỳnh về khối lượng. Giả thiết rằng cầu nối –S–S– đã thay thế cho H ở cầu metylen trong mạch cao su. Vậy khoảng bao nhiêu mắt xích isopren có một cầu đisunfua –S–S– ?
Cao su thiên nhiên có công thức cấu tạo: CH2=C(CH3)-CH=CH2 (CTPT: C5H8)
Gọi số mắt xích isopren có chứa 1 cầu đisunfua là n
=> Công thức cao su lưu hóa là: C5nH8n-1S2
\(\% {m_S} = \frac{{2.32}}{{12.5n + (8n - 1) + 2.32}}.100\% = 1,849\% \) => n = 50
Đáp án C
Cho các phát biểu sau(1) H2NCH2CONHCH2-CH2COOH là đipeptit.(2) Muối natri của axit glutamic được sử dụng sản xuất mì chính.(3) Tính bazơ của NH3 yếu hơn tính bazơ của metyl amin(4) Tetrapetit có chứa 4 liên kết peptit.(5) Ở điều kiện thường metylamin và đimetylamin là những chất khí có mùi khai.Số phát biểu đúng là
(1) sai vì mắt xích H2NCH2-CH2COOH không phải là α-amino axit
(2) đúng, muối HOOC-CH2-CH2-CH(NH2)-COONa là thành phần chính của mì chính.
(3) đúng, vì CH3NH2 có gốc CH3- đẩy e làm cho mật độ điện tích âm trên nguyên tử N tăng, khả năng nhận H+ cũng tăng nên tính bazo mạnh hơn so với NH3.
(4) sai, vì tetrapeptit được tạo nên từ 4 mắt xích α-amino axit nhưng chỉ có 3 liên kết peptit.
(5) đúng
Vậy có 3 phát biểu đúng
Đáp án A
Cho sơ đồ chuyển hóa sau :
(1). C4H6O2 + NaOH \(\buildrel {{t^0}} \over\longrightarrow \) (X) + (Y)
(2). (X) + AgNO3 + NH3 +H2O \(\buildrel {{t^0}} \over\longrightarrow \) (F) + Ag↓ + NH4NO3
(3). (Y) + NaOH \(\buildrel {{t^0}} \over\longrightarrow \) CH4 + Na2CO3
Công thức cấu tạo thu gọn của Y là
Từ (3) suy ra (Y) là CH3COONa
Từ (2) suy luận X có phản ứng tráng Ag => X là: CH3CHO
Từ (1) suy ra CTCT của C4H6O2 là: CH3COOCH=CH2
Đáp án C
Cho 19,2 gam hỗn hợp gồm hai amino axit no chứa một chức axit và một chức amin (tỷ lệ khối lượng phân tử của chúng là 1,373) tác dụng với 110 ml dung dịch HCl 2M, được dung dịch X. Để tác dụng hết với các chất trong dung dịch X cần dùng 140 ml dung dịch KOH 3M. Phần trăm số mol của mỗi aminoaxit trong hỗn hợp ban đầu bằng:
nHCl = 0,11.2 = 0,22 (mol); nKOH = 0,14.3 = 0,42 (mol)
Ta coi như hỗn hợp 2 amin và ax HCl phản ứng với KOH
Gọi công thức chung của 2 amin là: H2NCnH2nCOOH
HCl + KOH → KCl + H2O
0,22→ 0,22 (mol)
H2NCnH2nCOOH + KOH → H2NCnH2nCOOK + H2O
0,2 ← (0,42 -0,22) (mol)
=> nH2NCnH2nCOOH = 0,2 (mol)
\(\overline M \,aminoaxit = {{19,2} \over {0,2}} = 96\) => phải chứa Gly (M=75) hoặc Ala (M = 89)
TH1: aminoaxit nhỏ là Gly => Mcòn lại = 75. 1,373 = 103 (C4H9NO2)
Đặt: C2H5NO2: a (mol) ; C4H9NO2: b (mol)
\(\eqalign{
& \left\{ \matrix{
a + b = 0,2 \hfill \cr
75a + 103b = 19,2 \hfill \cr} \right. \Rightarrow \left\{ \matrix{
a = 0,05 \hfill \cr
b = 0,15 \hfill \cr} \right. \cr
& \Rightarrow \% {V_{{C_2}{H_5}N{O_2}}} = {{0,05} \over {0,2}}.100\% = 25\% \cr
& \% {C_4}{H_9}N{O_2} = 100\% - 25\% = 75\% \cr} \)
TH2: aminoaxit nhỏ là Ala => Mcòn lại = 89.1,373 = 122,2 vô nghiệm
Đáp án B
Để thu được Ag tinh khiết từ quặng bạc có lẫn Cu, người ta cho quặng bạc đó vào dung dịch chứa chất X dư. X là chất nào sau đây ?
Ta cho quặng Ag tác dụng với muối Fe(NO3)3
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
Đáp án A

