Đề thi tham khảo THPT QG môn Hóa học năm 2019 - Bộ GD&ĐT
Đề thi tham khảo THPT QG môn Hóa học năm 2019 - Bộ GD&ĐT
-
Hocon247
-
40 câu hỏi
-
90 phút
-
25 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Ở điều kiện thường, kim loại nào sau đây ở trạng thái lỏng?
Thủy ngân của có nhiệt độ nóng chảy rất thấp ở -39oC nên ở nhiệt độ thương thì Hg là chất lỏng ở điều kiện thường.
Kim loại nào sau đây là kim loại kiềm?
Kim loại kiềm là các kim loại nhóm IA (gồm Li, Na, K, Rb, Cs và Fr)
Chất bột X màu đen, có khả năng hấp phụ các khí độc nên được dùng trong nhiều loại mặt nạ phòng độc. Chất X là
C hoạt tính có khả năng hấp phụ cao nên được dùng trong nhiều loại mặt nạ phòng độc.
Đáp án C
Etyl propionat là este có mùi thơm của dứa. Công thức của etyl propionat là
Etyl propionat là este có mùi thơm của dứa. Công thức của etyl propionat là C2H5COOC2H5.
Cho dung dịch NaOH vào dung dịch chất X, thu được kết tủa màu nâu đỏ. Chất X là
Đáp án A
FeCl3 + 3NaOH → Fe(OH)3↓ (nâu đỏ) + 3NaCl
MgCl2 + 2NaOH → Mg(OH)2↓ (trắng) + 2NaCl
CuCl2 + 2NaOH → Cu(OH)2↓ (xanh thẫm) + 2NaCl
FeCl2 + 2NaOH → Fe(OH)2↓ (trắng xanh) + 2NaCl
Dung dịch Ala-Gly phản ứng được với dung dịch nào sau đây?
Các peptit không bền dễ bị thủy phân trong môi trường axit
Đáp án A
Kim loại Al không tan được trong dung dịch nào sau đây?
Al tác dụng được với dd NaOH, HCl và Ba(OH)2 còn không tác dụng được với BaCl2
Al + NaOH + H2O → NaAlO2 + 3/2H2↑
2Al + 6HCl → 2AlCl3 + 3H2↑
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2↑
Đáp án B
Oxit nào sau đây là oxit axit?
CrO (oxit bazo), Cr2O3 (oxit lưỡng tính) và CrO3 (oxit axit)
Polietilen (PE) được điều chế từ phản ứng trùng hợp chất nào sau đây?
PE được trùng hợp từ CH2=CH2
Đáp án A
Kim loại nào sau đây có thể điều chế được bằng phản ứng nhiệt nhôm?
Kim loại có thể điều chế được bằng phản ứng nhiệt nhôm là những kim loại đứng sau Al trong dãy điện hóa
Chất nào sau đây thuộc loại monosaccarit?
Glucozơ thuộc loại monosaccarit
Thành phần chính của đá vôi là canxi cacbonat. Công thức của canxi cacbonat là
Thành phần chính của đá vôi là canxi cacbonat. Công thức của canxi cacbonat là CaCO3.
CaCO3 → CaO + CO2
Cho 6 gam Fe vào 100 ml dung dịch CuSO4 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được m gam hỗn hợp kim loại. Giá trị của m là
\(\begin{array}{l}
Fe + CuS{O_4} \to FeS{O_4} + Cu\\
0,1.....0,1.......................0,1
\end{array}\)
\( \Rightarrow m = 6 - 0,1.56 + 0,1.64 = 6,8\,gam\)
Cho V ml dung dịch NaOH 2M vào 200 ml dung dịch AlCl3 1M, sau khi các phản ứng xảy ra hoàn toàn thu được 3,9 gam kết tủa. Giá trị lớn nhất của V là
nAl3+ = nAlCl3 = 0,2 mol
nAl(OH)3 = 0,05 mol
Lượng NaOH lớn nhất khi Al3+ đã kết tủa hết sau đó bị hòa tan trở lại một phần.
→ nOH- = 4nAl3+ - nAl(OH)3 = 0,75 mol
→ V = 0,375 lít= 375 ml
Cho các chất sau: metylamin, alanin, metylamoni clorua, natri axetat. Số chất phản ứng được với dung dịch HCl là
CH3NH2 + HCl → CH3NH3Cl
NH2-CH(CH3)-COOH + HCl → NH3Cl-CH(CH3)COOH
CH3COONa + HCl → CH3COOH + NaCl
Lên men m gam glucozơ thành ancol etylic với hiệu suất 50%, thu được 4,48 lít CO2. Gi| trị của m là
nC6H12O6 = nCO2 = 0,2 mol
H = 50% nên mC6H12O6 = 0,1.180/50% = 36 gam
Đốt cháy hoàn toàn amin X (no, đơn chức, mạch hở), thu được 0,2 mol CO2 và 0,05 mol N2. Công thức phân tử của X là
Amin đơn chức nên nX = 2nN2 = 0,1 mol
→ Số C = nCO2/nX = 2
→ X là C2H7N
Bộ dụng cụ chiết (được mô tả như hình vẽ bên) dùng để
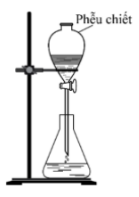
Bộ dụng cụ chiết (được mô tả như hình vẽ bên) dùng để tách hai chất lỏng không tan vào nhau.
Chất lỏng nhẹ hơn ở trên, chất lỏng nặng hơn ở dưới. Mở khóa để chất lỏng nặng hơn chảy xuống. Bỏ đi một lượng nhỏ chỗ giao tiếp giữa 2 chất lỏng, phần còn lại sẽ là chất lỏng nhẹ hơn.
Phản ứng nào sau đây có phương trình ion rút gọn là H+ + OH- → H2O?
A. \(HCO_3^ - + {\rm{ }}O{H^ - } \to {\rm{ CO}}_3^{2 - } + {H_2}O\)
B. \(O{H^ - } + {\rm{ }}{H^ + } \to {\rm{ }}{H_2}O\)
C. \(B{a^{2 + }} + {\rm{ }}O{H^ - } + SO_4^{2 - } \to {\rm{ BaS}}{{\rm{O}}_4} + {H_2}O\)
D. \(Cu{\left( {OH} \right)_2} + {\rm{ 2}}{H^ - } \to C{u^{2 + }} + 2{H_2}O\)
Thủy phân hoàn toàn tinh bột, thu được monosaccarit X. Hiđro hóa X, thu được chất hữu cơ Y. Hai chất X, Y lần lượt là:
\({\left( {{C_6}{H_{10}}{O_5}} \right)_n} + n{H_2}O \to n{C_6}{H_{12}}{O_6}\left( {glucozo} \right)\)
\({C_6}{H_{12}}{O_6} + {H_2} \to {C_6}{H_{14}}{O_6}\,\,\left( {sorbitol} \right)\)
Tiến hành các thí nghiệm sau:
(a) Nhúng thanh đồng nguyên chất vào dung dịch FeCl3.
(b) Cắt miếng sắt tây (sắt tráng thiếc), để trong không khí ẩm.
(c) Nhúng thanh kẽm vào dung dịch H2SO4 loãng có nhỏ vài giọt dung dịch CuSO4.
(d) Quấn sợi dây đồng vào đinh sắt rồi nhúng vào cốc nước muối.
Trong các thí nghiệm trên, số thí nghiệm chỉ xảy ra ăn mòn hóa học là
Các thí nghiệm chỉ xảy ra ăn mòn hóa học (không có sự xuất hiện của 2 điện cực):
(a) \(Cu + 2FeC{l_3} \to CuC{l_2} + 2FeC{l_2}\)
Các trường hợp còn lại đều là ăn mòn điện hóa:
(b) \(Fe\left( - \right),\,Sn\left( + \right)\)
(c) \(Zn\left( - \right),\,Cu\left( + \right)\)
(d) \(Fe\left( - \right),\,Cu\left( + \right)\)
Thủy phân este mạch hở X có công thức phân tử C4H6O2, thu được sản phẩm có phản ứng tráng bạc. Số công thức cấu tạo phù hợp của X là
X có 4 công thức cấu tạo thõa mãn:
HCOO-CH=CH-CH3 → HCOOH + CH3-CH2-CHO.
HCOO-CH2-CH=CH2 → HCOOH + CH2=CH-CH2OH
HCOO-C(CH3)=CH2 → HCOOH + CH3-CO-CH3
CH3-COO-CH=CH2 → CH3COOH + CH3CHO
Cho các chất sau: CrO3, Fe, Cr(OH)3, Cr. Số chất tan được trong dung dịch NaOH là
Có 2 chất tan trong dung dịch NaOH:
\(Cr{O_3} + 2NaOH \to N{a_2}Cr{O_4} + {H_2}O\)
\(Cr{\left( {OH} \right)_3} + NaOH \to N{a_2}Cr{O_2} + 2{H_2}O\)
Cho các polime: poli(vinyl clorua), xenlulozơ, policaproamit, polistiren, xenlulozơ triaxetat, nilon-6,6. Số polime tổng hợp là
Số polime tổng hợp là: poli(vinyl clorua), policaproamit, polistiren, nilon-6,6.
Dung dịch X gồm KHCO3 1M và Na2CO3 1M. Dung dịch Y gồm H2SO4 1M và HCl 1M. Nhỏ từ từ 100 ml dung dịch Y vào 200 ml dung dịch X, thu được V lít khí CO2 và dung dịch E. Cho dung dịch Ba(OH)2 tới dư vào E, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m và V lần lượt là
X gồm nKHCO3 = nNa2CO3 = 0,2 mol
→ nHCO3- = nCO32- = 0,2 mol
Y gồm nH2SO4 = nHCl = 0,1 mol
→ nH+ = 0,3
H+ + CO32- → HCO3-
HCO3- + H+ → CO2 + H2O
→ nH+ = nCO32- + nCO2 → nCO2 = 0,1 mol → V = 2,24 lít
Bảo toàn C → nBaCO3 = nHCO3- + nCO32- - nCO2 = 0,3 mol
Bảo toàn S → nBaSO4 = 0,1 mol
→ m kết tủa = mBaCO3 + mBaSO4 = 82,4 gam
Este X có công thức phân tử C6H10O4. Xà phòng hóa hoàn toàn X bằng dung dịch NaOH, thu được ba chất hữu cơ Y, Z, T. Biết Y tác dụng với Cu(OH)2 tạo dung dịch màu xanh lam. Nung nóng Z với hỗn hợp rắn gồm NaOH và CaO, thu được CH4. Phát biểu nào sau đây sai?
Phản ứng vôi tôi xút: Z + NaOH (CaO, to) → CH4 + Na2CO3
→ Z là CH3COONa (→ D đúng).
Chú ý: Y, Z, T có chứa 2 muối nên Y tác dụng với Cu(OH)2 tạo dung dịch màu xanh lam thì Y phải là ancol hai chức (2 nhóm –OH này phải liền kề nhau).
Phân tích: 6 = 2 + 2 + 2 = 1 + 2 + 3.
→ cấu tạo thỏa mãn của X là: HCOOCH2CH(CH3)OOCCH3.
Chú ý: đảo vị trí HCOO và CH3COO có thêm một đồng phân nữa của X thỏa mãn (→ A đúng).
Tương ứng cấu tạo của Y là CH3CH(OH)CH2OH có mạch cacbon không phân nhánh (→ B sai).
Cấu tạo của T là HCOONa có khả năng tham gia phản ứng tráng bạc (→ C đúng).
Chọn B.
Thực hiện các thí nghiệm sau:
(a) Nung nóng Cu(NO3)2.
(b) Cho Fe(OH)2 vào dung dịch H2SO4 đặc, nóng (dư).
(c) Sục khí CO2 vào dung dịch Ca(OH)2 dư.
(d) Cho dung dịch KHSO4 vào dung dịch NaHCO3.
(e) Cho dung dịch Fe(NO3)2 vào dung dịch HCl loãng.
(g) Cho đinh sắt vào dung dịch H2SO4 loãng.
Sau khi các phản ứng xảy ra, số thí nghiệm sinh ra chất khí là
(a) 2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑
(b) Fe(OH)2 + H2SO4 đặc → Fe2(SO4)3 + SO2↑ + H2O.
(c) CO2 + Ca(OH)2 dư → CaCO3 + H2O.
(d) H+ + HCO3– → CO2↑ + H2O.
(e) Fe2+ + H+ + NO3– → Fe3+ + NO↑ + H2O.
(g) Fe + H2SO4 loãng → FeSO4 + H2↑.
Vậy chỉ có thí nghiệm (c) không sinh ra khí.
Chọn B.
Cho các phát biểu sau:
(a) Sục khí CO2 tới dư vào dung dịch NaAlO2, thu được kết tủa trắng.
(b) Nhỏ dung dịch Ba(HCO3)2 vào dung dịch KHSO4, thu được kết tủa trắng và có khí thoát ra.
(c) Dung dịch Na2CO3 làm mềm được nước cứng toàn phần.
(d) Thạch cao nung dùng để nặn tượng, bó bột khi gãy xương.
(e) Hợp kim liti – nhôm siêu nhẹ, được dùng trong kĩ thuật hàng không.
Số phát biểu đúng là
(a) CO2 + NaAlO2 + H2O → Al(OH)3 + NaHCO3. (Đúng)
(b) Ba(HCO3)2 + 2KHSO4 → BaSO4 + K2SO4 + 2CO2 + 2H2O. (Đúng)
(c) M2+ + CO32- → MCO3 (M là Ca, Mg) (Đúng)
(d) và (e) (Đúng)
Đốt cháy hoàn toàn m gam hiđrocacbon mạch hở X (28 < MX < 56), thu được 5,28 gam CO2. Mặt kh|c, m gam X phản ứng tối đa với 19,2 gam Br2 trong dung dịch. Giá trị của m là:
X dạng CnH2n+2-2k
CnH2n+2-2k + kBr2 →CnH2n+2-2kBr2k
nCO2 = 0,12 mol
→ Số C = n = nCO2/nX = k
Do X có n = k và 28< MX < 56 nên n= k =4 là nghiệm duy nhất.
X là CHCCCH ( diaxetilen)
nX = 0,12/k = 0,03 → mX = 1,5 gam
Đốt cháy hoàn toàn 0,06 mol hỗn hợp X gồm ba triglixerit cần vừa đủ 4,77 mol O2, thu được 3,14 mol H2O. Mặt khác, hiđro hóa hoàn toàn 78,9 gam X (xúc tác Ni, t°), thu được hỗn hợp Y. Đun nóng Y với dung dịch KOH vừa đủ, thu được glixerol và m gam muối. Giá trị của m là
Ba triglixerit trong X có dạng tổng quát: (RCOO)3C3H5 có k liên kết πC=C.
Giải đốt: 0,06 mol (RCOO)3C3H5 + 4,77 mol O2 → ? mol CO2 + 3,14 mol H2O.
Bảo toàn nguyên tố O có nCO2 = (0,06 × 6 + 4,77 × 2 – 3,14) ÷ 2 = 3,38 mol.
Tương quan đốt: (k + 3 – 1)nX = ∑nCO₂ – ∑nH₂O = 0,24 mol ⇒ k = 2.
Bảo toàn khối lượng phản ứng đốt có mX = 52,6 gam. Lập tỉ lệ tương ứng:
78,9 gam X tương ứng với 0,09 mol. 1X + 2H2 → 1Y nên mY = 78,9 + 0,09 × 2 × 2 = 79,26 gam.
Giải thủy phân: 1Y + 3KOH → m gam muối + 1C3H5(OH)3 (glixerol).
Từ số mol và tỉ lệ có: nKOH phản ứng = 0,27 mol; nglixerol = 0,09 mol.
→ bảo toàn khối lượng có: m = 79,26 + 0,27 × 56 – 0,09 × 92 = 86,10 gam.
Chọn A.
Dẫn từ từ đến dư khí CO2 vào dung dịch Ba(OH)2. Sự phụ thuộc của khối lượng kết tủa (y gam) vào thể tích khí CO2 tham gia phản ứng (x lít) được biểu diễn bằng đồ thị bên.
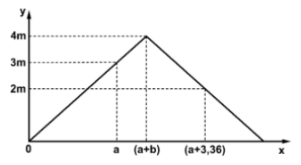
Giá trị của m la
Giải bằng đồ thị:
Đoạn OA biểu diễn tỉ lệ phản ứng: 1CO2 + 1Ba(OH)2 → 1BaCO3↓ + 1H2O.
Đoạn AB biểu diễn tỉ lệ phản ứng: 1CO2 + 1BaCO3 → 1Ba(HCO3)2.
Giả sử: m gam kết tủa tương ứng y mol BaCO3; a lít khí tương ứng x mol (quan sát đồ thị).
Theo đó, ta có: OH = HF → x = 3y || KB = KE = 2y → 2AI = OB = OK + KB.
→ có phương trình: 8y = (x + 0,15) + 2y → 6y = x + 0,15 → y = 0,05 và x = 0,15.
Vậy, giá trị của m = 197y = 9,85 gam.
Chọn đáp án C
Cho các phát biểu sau:
(a) Sau khi mổ cá, có thể dùng giấm ăn để giảm mùi tanh.
(b) Dầu thực vật và dầu nhớt bôi trơn máy đều có thành phần chính là chất béo.
(c) Cao su sau khi được lưu hóa có tính đàn hồi và chịu nhiệt tốt hơn.
(d) Khi làm trứng muối (ngâm trứng trong dung dịch NaCl bão hòa) xảy ra hiện tượng đông tụ protein.
(e) Thành phần chính của bông nõn là xenlulozơ.
(g) Để giảm đau nhức khi bị kiến đốt, có thể bôi vôi tôi vào vết đốt.
Số phát biểu đúng là
(b) sai. Dầu thực vật có thành phần chính là chất béo, dầu nhớt bôi trơn máy có thành phần chính là hiđrocacbon.
Các phát biểu còn lại đều đúng.
Chọn A.
Điện phân dung dịch X chứa 3a mol Cu(NO3)2 và a mol KCl (với điện cực trơ, màng ngăn xốp) đến khi khối lượng catot tăng 12,8 gam thì dừng điện phân, thu được dung dịch Y. Cho 22,4 gam bột Fe vào Y, sau khi các phản ứng xảy ra hoàn toàn, thu được khí NO (sản phẩm khử duy nhất của N+5) và 16 gam hỗn hợp kim loại. Giả thiết hiệu suất điện phân là 100%. Giá trị của a là
Y + Fe thu được hỗn hợp kim loại nên Y còn Cu2+ dư.
Mặt khác, khí NO thoát ra nên Y chứa H+, vậy Cl- bị điện phân hết
Catot: nCu = 0,2 → nCu2+ dư = 3a -0,2
Anot: nCl2 = 0,5a và nO2 = b
bảo toàn electron: 0,2.2 = 0,5a.2 + 4b (1)
nH+ = 4nO2 → nNO = nH+/4 = b
bảo toàn electron → nFe phản ứng = 3a - 0,2 + 1,5b
→ 22,4 - 56(3a + 1,5b - 0,2) + 64(3a - 0,2) = 16 (2)
Từ (1) và (2) → a = 0,08 và b = 0,08
Hỗn hợp T gồm ba este X, Y, Z mạch hở (MX < MY < MZ). Cho 48,28 gam T tác dụng vừa đủ với dung dịch chứa 0,47 mol NaOH, thu được một muối duy nhất của axit cacboxylic đơn chức và hỗn hợp Q gồm các ancol no, mạch hở, có cùng số nguyên tử cacbon trong phân tử. Đốt cháy hoàn toàn Q, thu được 13,44 lít khí CO2 và 14,4 gam H2O. Phần trăm khối lượng của nguyên tố H trong Y là
Giải đốt Q: CnH2n + 2Om + O2 → 0,6 mol CO2 + 0,8 mol H2O.
Tương quan đốt: nQ = nH₂O – nCO₂ = 0,2 mol → n = 0,6 ÷ 0,2 = 3.
“Giả thiết chữ”: một muối + các ancol; MX < MY < MZ
Q gồm 3 ancol là C3H8O; C3H8O2 và C3H8O3.
Theo đó, mQ = mC + mH + mO → mQ = 0,6 × 12 + 0,8 × 2 + 0,47 × 16 = 16,32 gam.
Thủy phân: 48,28 gam T + 0,47 mol NaOH → 0,47 mol RCOONa + 16,32 gam hỗn hợp ancol Q.
Bảo toàn khối lượng, ta có mRCOONa = 50,76 gam → R = 41 tương ứng với gốc C3H5.
Vậy, este Y tương ứng là (C3H5COO)2C3H6 → công thức phân tử: C11H16O4.
%mnguyên tố H trong Y = 16 ÷ 212 × 100% ≈ 7,55%.
Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, K2O, Ba và BaO (trong đó oxi chiếm 10% về khối lượng) vào nước, thu được 300 ml dung dịch Y và 0,336 lít khí H2. Trộn 300 ml dung dịch Y với 200 ml dung dịch gồm HCl 0,2M và HNO3 0,3M, thu được 500 ml dung dịch có pH = 13. Giá trị của m là
nHCl = 0,04 và nHNO3 = 0,06 → nH+ = 0,1 mol
pH = 13 → [OH-] dư = 0,1 → nOH- dư = 0,05
→ nOH- trong Y = 0,1 + 0,05 = 0,15
nOH- = 2nH2 + 2nO → nO = 0,06 mol
→ mX = 0,06.16/10% = 9,6 gam
Tiến hành thí nghiệm điều chế etyl axetat theo các bước sau đây:
Bước 1: Cho 1 ml C2H5OH, 1 ml CH3COOH và vài giọt dung dịch H2SO4 đặc vào ống nghiệm.
Bước 2: Lắc đều ống nghiệm, đun cách thủy (trong nồi nước nóng) khoảng 5 - 6 phút ở 65 - 70oC.
Bước 3: Làm lạnh, sau đó rót 2 ml dung dịch NaCl bão hòa vào ống nghiệm.
Phát biểu nào sau đây sai?
A. đúng vì H2SO4 đặc là xúc tác, đồng thời có tính háo nước, sẽ làm chuyển dịch cân bằng ở phản ứng este hóa theo chiều thuận → tăng hiệu suất phản ứng.
B sai. Thêm dung dịch NaCl bão hòa vào dung dịch, làm tăng khối lượn riêng của dung dịch và làm giảm độ tan của CH3COOC2H5 sinh ra ⇒ CH3COOC2H5 nổi lên trên, chất lỏng trong ống nghiệm tách thành 2 lớp.
C đúng. Phản ứng este hóa là phản ứng thuận nghịch nên trong ống nghiệm vẫn còn C2H5OH và CH3COOH.
D đúng. Như đã phân tích ở phát biểu B.
Hòa tan hoàn toàn hai chất rắn X, Y (có số mol bằng nhau) vào nước thu được dung dịch Z.
Tiến hành các thí nghiệm sau:
Thí nghiệm 1: Cho dung dịch NaOH dư vào V ml dung dịch Z, thu được n1 mol kết tủa.
Thí nghiệm 2: Cho dung dịch NH3 dư vào V ml dung dịch Z, thu được n2 mol kết tủa.
Thí nghiệm 3: Cho dung dịch AgNO3 dư vào V ml dung dịch Z, thu được n3 mol kết tủa.
Biết các phản ứng xảy ra hoàn toàn và n1 < n2 < n3. Hai chất X, Y lần lượt là:
Giả sử nX = nY = 1 (mol)
A sai vì TN1 và TN2 chỉ tạo ra Fe(OH)2 khi đó n1 = n2 =1 mol → không thỏa mãn n1 < n2
B sai vì TN1 thu được 1 mol Fe(OH)2; TN3 thu được 1 mol Ag → n1 = n3 → không thỏa mãn n1 < n3
C sai vì TN1 sinh ra 1 mol Fe(OH)2 và TN2 sinh ra 1 mol Fe(OH)3 → n1 = n2 → không thỏa mãn n1 < n2
D đúng vì TN1 tạo ra 1 mol Fe(OH)2 → n1 = 1 (mol)
TN2 tạo ra 1 mol Fe(OH)2 và 1mol Al(OH)3 → n2 = 2 (mol)
TN3 tạo ra 2 mol AgCl và 1 mol Ag → n3 = 3 (mol)
→ thỏa mãn n1 < n2 < n3
Đáp án D
Cho X, Y là hai axit cacboxylic đơn chức (MX < MY); T là este ba chức, mạch hở được tạo bởi X, Y với glixerol. Cho 23,06 gam hỗn hợp E gồm X, Y, T và glixerol (với số mol của X bằng 8 lần số mol của T) tác dụng vừa đủ với 200 ml dung dịch NaOH 2M, thu được hỗn hợp F gồm hai muối có tỉ lệ mol 1 : 3 và 3,68 gam glixerol. Đốt cháy hoàn toàn F cần vừa đủ 0,45 mol O2, thu được Na2CO3, H2O và 0,4 mol CO2. Phần trăm khối lượng của T trong E có giá trị gần nhất với giá trị nào sau đây?
Vì 2 muối có tỉ lệ 1 : 3 nên giả sử: R1COONa : 0,3 mol và R2COONa : 0,1 mol
Đốt muối có
Muối + 0,45 mol O2 → CO2 + H2O + Na2CO3
BTNT “Na”: nNa2CO3 = 1/2n NaOH = 0,2 (mol)
→ bảo toàn O có : 2nCOO- + 2nO2 = 2nCO2 + 3nNa2CO3 + nH2O
→ H2O = 2.0,4 + 2.0,45 -2.0,4-3.0,2 = 0,3 mol
Bảo toàn khối lượng:
mmuối + mO2 = mCO2 + mNa2CO3 + mH2O
→ mmuối = 0,4.44 + 0,2.106 + 0,3.18 – 0,45.32 = 29,8 (g)
Bảo toàn khối lượng có mmuối = 29,8 g = 0,3(R1 + 67) + 0,1.(R2 + 67)
→ 3R1 + R2 = 30
→ R1 = 1 và R2 = 27 là nghiệm thỏa mãn
Bảo toàn khối lượng phản ứng tác dụng với NaOH có
mE + mNaOH = mmuối + mGlixerol + mH2O
→ 23,06 + 0,4.40 = 29,8 + 3,68 + mH2O
→ mH2O = 5,58 (g)
→ nH2O = 0,31mol → nZ = (0,4 - 0,31) : 3 = 0,03 mol
→nX = 0,24 mol và nY = 0,07
→ có nX + 2nZ = nR1COONa nên Z tạo từ 2X và 1 Y
Z là (HCOO)2-C3H5-OOC-C2H3 : 0,03
→%Z = 26,28% gần nhất với 26%
Để m gam hỗn hợp E gồm Al, Fe và Cu trong không khí một thời gian, thu được 34,4 gam hỗn hợp X gồm các kim loại và oxit của chúng. Cho 6,72 lít khí CO qua X nung nóng, thu được hỗn hợp rắn Y và hỗn hợp khí Z có tỉ khối so với H2 là 18. Hòa tan hoàn toàn Y trong dung dịch chứa 1,7 mol HNO3, thu được dung dịch chỉ chứa 117,46 gam muối và 4,48 lít hỗn hợp khí T gồm NO và N2O. Tỉ khối của T so với H2 là 16,75. Giá trị của m là
dZ/H2= 36 → CO dư
Áp dụng quy tắc đường chéo → nCO = nCO2 = 0,15 mol
→ nO trong oxit đã phản ứng = 0,15 mol
→ mY = 34,4 – 0,15 . 16 = 32g
Áp dụng quy tắc đường chéo → nNO = 0,15mol và nN2O = 0,05mol
- Gọi x là số mol của O trong Y và y là số mol của NH4NO3 trong muối
Ta có nHNO3 = 4nNO + 10nN2O + 10nNH4NO3 + 2 nO trong Y
→ 2x + 10y = 0,6 (1)
- Khi cho Y tác dụng với HNO3
Bảo toàn khối lượng có mY + mHNO3 = m muối + m khí + mH2O
→ 32 + 1,7 . 62 = 117,46 + 0,2 . 16,75 . 2 + 18. nH2O
→ nH2O = 0,83 mol
- Bảo toàn nguyên tố H: nHNO3 = 4nNH4NO3 + 2nH2O
→ nNH4NO3 = 0,01 mol
Thay vào (1) → x = 0,25 mol
- mE = mY – mO = 32 – 0,25 . 16 = 28g
Cho hỗn hợp E gồm 0,1 mol X (C5H11O4N) và 0,15 mol Y (C5H14O4N2, là muối của axit cacboxylic hai chức) tác dụng hoàn toàn với dung dịch KOH, thu được một ancol đơn chức, hai amin no (kế tiếp trong dãy đồng đẳng) và dung dịch T. Cô cạn T, thu được hỗn hợp G gồm ba muối khan có cùng số nguyên tử cacbon trong phân tử (trong đó có hai muối của hai axit cacboxylic và muối của một α-amino axit). Phần trăm khối lượng của muối có phân tử khối lớn nhất trong G la
- Do sau phản ứng thu được 2 amin no kế tiếp trong dãy đồng đẳng nên suy ra cấu tạo của Y là: CH3NH3OOC-COONH3C2H5 (0,15 mol)
- Các muối có cùng số nguyên tử C (2C) và 1 ancol nên cấu tạo của X là: CH3COOH3N-CH2-COOCH3 (0,1 mol)
→ Muối G gồm có:
(COOK)2 (0,15 mol)
CH3COOK (0,1 mol)
H2N-CH2-COOK (0,1 mol)
→ m muối = 0,15.166 + 0,1.98 + 0,1.113 = 46 gam
→ %m(COOK)2 = 0,15.166/46.100% = 54,13%
Đáp án B

