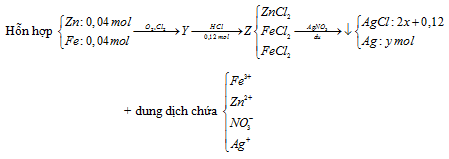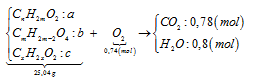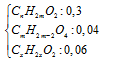Đề thi thử THPT QG môn Hóa học năm 2018 - Trường THPT Chuyên Lê Quý Đôn - Đà Nẵng
Đề thi thử THPT QG môn Hóa học năm 2018 - Trường THPT Chuyên Lê Quý Đôn - Đà Nẵng
-
Hocon247
-
40 câu hỏi
-
90 phút
-
21 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Tên gọi của hợp chất có công thức cấu tạo CH2=C(CH3)CH=CH2 là
Tên gọi của hợp chất có công thức cấu tạo CH2=C(CH3)CH=CH2 là isopren.
Ancol nào sau đây có số nguyên tử cacbon bằng số nhóm –OH?
Glixerol có số nguyên tử cacbon bằng số nhóm –OH
Kim loại có khối lượng riêng nhỏ nhất là
Kim loại có khối lượng riêng nhỏ nhất là Li
Polime nào sau đây được điều chế bằng phản ứng trùng hợp?
Poli(metyl metacrilat) được điều chế bằng phản ứng trùng hợp
Khi bị nhiệt phân, muối nitrat nào sau đây tạo sản phẩm là kim loại?
AgNO3 → Ag + NO2 + O2
Fe(NO3)2 → Fe2O3 + NO2 + O2
KNO3 → KNO2 + O2
Cu(NO3)2 → CuO + NO2 + O2
Dung dịch NaHCO3 không tác dụng với dung dịch
Dung dịch NaHCO3 không tác dụng với dung dịch Na2SO4.
Kim loại nào dưới đây không tan trong nước ở điều kiện thường?
Al không tan trong nước ở điều kiện thường
Thủy phân hoàn toàn xenlulozơ trong môi trường axit, thu được chất nào sau đây?
Khi thủy phân hoàn toàn xenlulozơ trong môi trường axit đun nóng ta thu được glucozo.
Đáp án A
Chất nào dưới đây khi tác dụng với dung dịch HCl thu được hai muối?
(a) sai vì chất đó không phải peptit.
(c) sai vì C6H5NH2 tính bazo rất yếu không đủ làm quỳ ẩm đổi màu.
(d) sai vì đipeptit không có khả năng tạo phức với Cu(OH)2.
Trong các cặp chất dưới đây, cặp chất nào cùng tồn tại trong một dung dịch?
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau:
+ Chất kết tủa.
+ Chất điện li yếu.
+ Chất khí.
Phát biểu nào sau đây đúng?
Glucozơ có nhiều trong quả nho chín.
Đáp án D
Cho hỗn hợp gồm K2O, BaO, Al2O3 và FeO vào lượng nước dư, thu được dung dịch X và chất rắn Y. Sục khí CO2 đến dư vào dung dịch X, thu được kết tủa là
Dung dịch X chứa các anion OH– và AlO2–.
Sục CO2 ta có các phản ứng:
CO2 + OH– → HCO3–.
CO2 + AlO2– + H2O → Al(OH)3↓ + HCO3–
Khi thủy phân không hoàn toàn pentapeptit Ala-Gly-Val-Gly-Ala được tối đa bao nhiêu tripeptit khác nhau?
Thủy phân X thu được các đipeptit là Gly-Ala, Ala-Gly, Gly-Gly
→ thu được tối đa 3 đipeptit
Số hiđrocacbon thơm có cùng công thức phân tử C8H10 bằng
Có 4 CTCT thỏa mãn là
C6H5-CH2CH3 và (m, p, o)-CH3-C6H4CH3
→ Chọn C
Silic phản ứng được với tất cả các chất trong dãy nào dưới đây?
Silic phản ứng được với tất cả các chất trong dãy chất : F2, Mg, dung dịch NaOH
Si + 2F2 → SiF4
Mg + Si → Mg2Si
2NaOH + Si + H2O → Na2SiO3 + 2H2
Phát biểu nào sau đây là sai?
Fructozơ không tham gia phản ứng tráng bạc → Sai → Đáp án A
Nước thải công nghiệp thường chứa các ion kim loại nặng như Hg2+, Pb2+, Fe3+,... Để xử lí sơ bộ nước thải trên, làm giảm nồng độ các ion kim loại nặng với chi phí thấp, người ta sử dụng chất nào sau đây?
Hầu hết các hidroxit của các kim loại nặng đều là hợp chất không tan
Để xử lý sơ bộ nước thải có chứa các ion kim loại nặng, người ta thường sử dụng nước vôi trong tạo các hidroxit không tan, lọc lấy phần dung dịch.
Anđehit axetic thể hiện tính oxi hoá trong phản ứng nào sau đây?
Anđehit axetic thể hiện tính oxi hoá trong phản ứng cộng hiđro sinh ra ancol
Đáp án A
Xà phòng hóa hoàn toàn 161,2 gam tripanmitin trong dung dịch KOH, thu được m gam kali panmitat. Giá trị của m là
Ta có phản ứng:
(C15H31COO)3C3H3 + 3KOH → 3C15H31COOK + C3H5(OH)3.
Ta có nTripanmitin = 161,2 ÷ 806 = 0,2 mol ⇒ nC15H31COOK = 0,6 mol.
⇒ mC15H31COOK = 0,6×176,4 gam ⇒ Chọn D.
Hoặc tăng giảm khối lượng ta có: mMuối = 161,2 + 0,2×(39×3 – 12×3 – 5) = 176,4 gam
Xét các phát biểu sau:
(a) Kim loại Na phản ứng mạnh với nước;
(b) Khí N2 tan rất ít trong nước;
(c) Khí NH3 tạo khói trắng khi tiếp xúc với khí HCl;
(d) P trắng phát quang trong bóng tối;
(e) Thành phần chính của phân supephotphat kép là Ca(H2PO4)2 và CaSO4.
Số phát biểu đúng là
(e) sai . đó là thành phần chính của phân supephotphat đơn
Còn phân supephotphat kép có thành phần chính là Ca(H₂PO₄)₂
Có các phát biểu sau:
(a) H2NCH2COHNCH2CH2COOH có chứa 1 liên kết peptit trong phân tử;
(b) Etylamin, metylamin ở điều kiện thường đều là chất khí, có mùi khai, độc;
(c) Benzenamin làm xanh quỳ ẩm;
(d) Các peptit, glucozơ, saccarozơ đều tạo phức với Cu(OH)2;
(e) Thủy phân đến cùng protein đơn giản chỉ thu được các α–amino axit;
(f) Protein được tạo nên từ các chuỗi peptit kết hợp lại với nhau.
Số phát biểu đúng là
(a) sai vì chất đó không phải peptit.
(c) sai vì C6H5NH2 tính bazo rất yếu không đủ làm quỳ ẩm đổi màu.
(d) sai vì đipeptit không có khả năng tạo phức với Cu(OH)2.
Phát biểu nào sau đây là sai?
Kim loại Cr tan được trong dung dịch HCl tạo muối CrCl3 và H2.
Đáp án D
Cho các phát biểu sau:
(a) Các kim loại Na, K, và Al đều phản ứng mạnh với nước;
(b) Dung dịch muối Fe(NO3)2 tác dụng được với dung dịch HCl;
(c) P cháy trong Cl2 có thể tạo thành PCl3 và PCl5;
(d) Than chì được dùng làm điện cực, chế tạo chất bôi trơn, làm bút chì đen;
(e) Hỗn hợp Al và NaOH (tỉ lệ số mol tương ứng 1 : 1) tan hoàn toàn trong nước dư;
(g) Người ta không dùng CO2 để dập tắt đám cháy magie hoặc nhôm.
Số phát biểu đúng là
Số phát biểu đúng là gồm (b), (c), (d), (e) và (g).
(a) Sai vì có Al không thỏa mãn ⇒ Chọn C
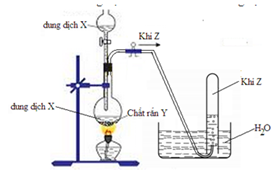
Cho hình vẽ mô tả thí nghiệm điều chế khí Z từ dung dịch X và chất rắn Y:
Hình vẽ trên minh họa cho phản ứng nào sau đây?
Hình vẽ mô tả một dung dịch X nhỏ vào chất rắn Y để tạo khí
→ Loại A do phản ứng này dẫn khí vào rắn.
Mặt khác phản ứng tạo thành khí Z thu bằng phương pháp đẩy nước → Z phải là 1 khí không tan hoặc rất ít tan trong nước.
→ Loại B, D do SO2 và NH3 tan nhiều trong nước.
Đáp án C
Cho dãy các chất: NH4Cl, (NH4)2SO4, NaCl, MgCl2, FeCl2, AlCl3. Số chất trong dãy tác dụng với lượng dư dung dịch Ba(OH)2 tạo thành kết tủa là
(NH4)2SO4 , FeCl2 , MgCl2
Cho 0,1 mol anđehit X phản ứng tối đa với 0,3 mol H2, thu được 9 gam ancol Y. Mặt khác 2,1 gam X tác dụng hết với lượng dư dung dịch AgNO3 trong NH3, thu được m gam Ag. Giá trị của m là
Ta có mAncol Y = 9 : 0,1 = 90.
Giả sử Y là ancol đơn chức ⇒ MY = MCnH2n+1OH = 90 ⇒ n = 5,14 ⇒ Loại.
Giả sử Y là ancol 2 chức ⇒ MY = MCnH2nOH2 = 90.
⇒ n = 4 (C4H4O2) ⇒ X là andehit 2 chức ⇒ X tráng gương tạo 4 Ag.
⇒ nAg = (2,1/84).4.108 = 10,8 gam
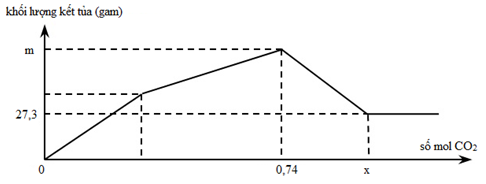
Sục từ từ khí CO2 đến dư vào dung dịch chứa Ca(OH)2 và NaAlO2 (hay Na[Al(OH)4]). Khối lượng kết tủa thu sau phản ứng được biểu diễn trên đồ thị như hình vẽ:
Giá trị của m và x lần lượt là
Đặt số mol Ca(OH)2 = a và nNaAlO2 = b ta có phản ứng:
Ca(OH)2 + CO2 → CaCO3↓ + H2O.
NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
Sau khi CO2 dư vào ⇒ CaCO3 + CO2 + H2 → Ca(HCO3)2
nAl(OH)3 = 27,3 ÷ 78 = b = 0,35 mol.
⇒ nCa(OH)2 = 0,74 – 0,35 = 0,39 mol.
⇒ m = 0,39×100 + 27,3 = 66,3 gam Và x = 0,39 + 0,35 + 0,39 = 1,13 mol
Đốt cháy hoàn toàn một lượng este X (no, đơn chức, mạch hở) thì số mol O2 phản ứng bằng số mol CO2 sinh ra. Mặt khác, cho 6,0 gam X tác dụng vừa đủ với dung dịch KOH, thu được dung dịch chứa m gam muối. Giá trị của m là
Este no đơn chức mạch hở ⇒ CTPT là CnH2nO2.
+ Phản ứng cháy: CnH2nO2 + (3n-2)/2 O2 → nCO2 + nH2O.
Vì nO2 pứ = nCO2 \(\Leftrightarrow \frac{{3n - 2}}{2} = n \Leftrightarrow n = 2\)
⇒ X là HCOOCH3. Ta có nHCOOCH3 = 0,1 mol.
⇒ mMuối = mHCOOK = 0,1×(45+39) = 8,4 gam
Hỗn hợp X chứa Al và Na có khối lượng a gam. Cho hỗn hợp X vào lượng nước dư, thấy thoát ra 4,48 lít khí H2. Nếu cho hỗn hợp X vào lượng KOH dư, thấy thoát ra 7,84 lít khí H2. Các thể tích khí đo ở điều kiện chuẩn. Giá trị của a là
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam
Cho 6,3 gam hỗn hợp X gồm axit axetic, axit propionic và axit acrylic vừa đủ để làm mất màu hoàn toàn dung dịch chứa 6,4 gam brom. Để trung hoàn toàn 3,15 gam hỗn hợp X cần 90 ml dung dịch NaOH 0,5M. Thành phần phần trăm khối lượng của axit axetic trong hỗn hợp X là
Đặt số mol 3 axit lần lượt là a b và c ta có:
60a + 74b + 72c = 6,3 gam (PT theo khối lượng hỗn hợp). (1)
c = 6,4:160 = 0,04 mol (PT theo số mol brom phản ứng). (2)
Để pứ hoàn toàn với 3,15 gam X cần 0,045 mol NaOH ⇒ 6,3 gam X cần 0,09 mol NaOH.
⇒ a + b + c = 0,09 (PT theo số mol NaOH pứ) (3).
+ Giải hệ (1) (2) và (3) ⇒ a = nAxit axetic = a = 0,02 mol ⇒ mAxit axetic = 1,2 gam.
⇒ %mAxit axetic/hh = \(\frac{{1,2.100}}{{6,3}} \approx 19,05\% \) ≈ 19,05%
Cho 7,35 gam axit glutamic và 15 gam glyxin vào dung dịch chứa 0,3 mol KOH, thu được dung dịch Y. Cho Y tác dụng hoàn toàn với dung dịch HC1 dư, thu được m gam muối. Giá trị của m là
Số mol HCl phản ứng = naxit glutamic + nglyxin + nKOH = 0,55 mol.
Vì nKOH = 0,3 mol ⇒ Sau pứ hoàn toàn nH2O sinh ra = 0,3 mol.
+ Áp dụng định luật bảo toàn khối lượng ta có:
mMuối = maxit glutamic + mglyxin + mKOH + mHCl – mH2O = 53,825 gam.
Điện phân 200 ml dung dịch gồm CuSO4 1,0 M và NaCl a M (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) với cường độ dòng điện không đổi 2A trong thời gian 14475 giây. Dung dịch thu được có khối lượng giảm 14,75 gam so với dung dịch ban đầu. Giá trị của a là
∑ne trao đổi = 0,3 mol < 2nCu2+.
⇒ Cu chưa bị điện phân hết và khí thoát ra là Cl2 và có thể có cả O2.
Nếu chỉ có khí Cl2 ⇒ Quy đổi mDung dịch giảm = mCuCl2 = 0,15×135 = 20,25 ≠ 14,75 ⇒ Loại.
+ Vậy có cả O2 thoát ra ⇒ mDung dịch giảm = mCuCl2 + mCuO.
+ Đặt số mol 2 chất lần lượt là a và b ta có:
a + b = 0,15 mol (PT bảo toàn Cu).
135a + 80b = 14,75 (PT theo m dung dịch giảm).
+ Giải hệ ⇒ a = nCuCl2 = 0,05 mol ⇒ nNaCl = 0,05×2 = 0,1 mol.
⇒ CM NaCl = 0,1/0,2 = 0,5M
Cho 0,15 mol bột Cu và 0,3 mol Fe(NO3)2 vào dung dịch chứa 0,5 mol H2SO4 (loãng). Sau khi các phản ứng xảy ra hoàn toàn, thu được V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
Có quá trình khử : 4H+ + NO3- + 3e → NO +2H2O
Có nH+ = 1 mol, nNO3- = 0,6 mol ⇒ số e nhận tối đa là 3 × 1 ÷ 4 = 0,75 mol
Quá trình oxi hoá : Cu → Cu2+ + 2e và Fe2+ → Fe3+ + 1e
Số e nhường tối đa là là 2×0,15 + 0,3 = 0,6 mol < ne nhận tối đa
Vậy chứng tỏ NO được tính theo số e nhường ⇒ NO = 0,6 : 3 = 0,2 mol.
⇒ V = 4,48 lít
Hỗn hợp X gồm Ba, BaO và Ba(OH)2 có tỉ lệ số mol tương ứng 1: 2 : 3. Cho m gam X vào nước thì thu được a lít dung dịch Y và V lít khí H2 (đktc). Hấp thụ 8V lít CO2 (đktc) vào a lít dung dịch Y đến phản ứng xảy ra hoàn toàn thì thu được 98,5 gam kết tủa. Giá trị của m là
Đặt nBa = a, nBaO = 2a và nBa(OH)2 = 3a
⇒ nH2 = nBa = a ⇒ ∑nBa(OH)2 = a + 2a 3a = 6a = \(\frac{{6V}}{{22,4}}\)
⇒ ∑nOH– = \(\frac{{12V}}{{22,4}}\) ⇒ nCO32– = \(\frac{{12V}}{{22,4}} - \frac{{8V}}{{22,4}} = \frac{{4V}}{{22,4}}\).
⇒ nBaCO3 = \(\frac{{4V}}{{22,4}}\) × 197 = 98,5 => V = 2,8.
⇒ nBa = \(\frac{{2,8}}{{22,4}}\) = 0,125 mol ⇒ nBaO = 0,25, nBa(OH)2 = 0,375.
⇒ m = 0,125×137 + 0,25×153 + 0,375×171 = 119,5 gam
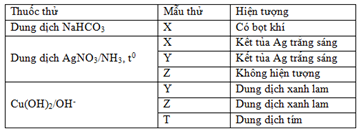
Kết quả thí nghiệm của các chất X, Y, Z, T (dạng dung dịch) với thuốc thử được ghi ở bảng sau:
Các chất X, Y, Z, T lần lượt là
X + NaHCO3 → Khí ⇒ X là axit ⇒ Loại A.
X có phản ứng tráng gương ⇒ Loại D.
T có pứ màu biure ⇒ T không thể là đipeptit ⇒ Loại C.
Hỗn hợp khí X gồm etilen và propin. Cho a mol X tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được 17,64 gam kết tủa. Mặt khác a mol X phản ứng tối đa với 0,44 mol H2. Giá trị của a là
Đặt số mol C2H4 = b và nC3H4 = c.
+ PT theo nH2: b + 2c = 0,44 (1).
+ PT theo khối lượng kết tủa là: 147c = 17,64 (2).
⇒ Giải hệ PT (1) và (2) ⇒ b = 0,2 và c = 0,12
⇒ nX = a = b + c = 0,32
Hòa tan hoàn toàn m gam hỗn hợp X gồm Mg , Fe, FeCO3, Cu(NO3)2 vào dung dịch chứa NaNO30,045 mol và H2SO4, thu được dung dịch Y chỉ chứa các muối trung hòa có khối lượng là 62,605 gam (không chứa ion Fe3+) và 3,808 lít (đktc) hỗn hợp khí Z (trong đó có 0,02 mol H2). Tỉ khối của Z so với O2 bằng 19/17. Thêm tiếp dung dịch NaOH 1 M vào Y đến khi thu được lượng kết tủa lớn nhất là 31,72 gam thì vừa hết 865 ml. Mặt khác, thêm dung dịch BaCl2 vừa đủ vào dung dịch Y, lọc bỏ kết tủa được dung dịch G, sau đó cho thêm lượng dư AgNO3 vào G thu được 150,025 gam kết tủa. Giá trị của m là
Đặt số mol các muối MgSO4, FeSO4, CuSO4, (NH4)2SO4 lần lượt là a, b, c, d
nNa2SO4(Y) = 0,5nNaNO3 = 0,0225 mol
120a + 152b + 160c + 132d + 0,0225.142 = 62,605 (1)
nNaOH = 2a + 2b + 2c + 2d = 0,865 (2)
m↓ = 58a + 90b + 98c = 31,72 (3)
Sản phẩm sau đó là Na2SO4 → nNa2SO4 = 0,4325 + 0,0225 = 0,455
nBaCl2 = 0,455 → Vừa đủ để tạo ra nBaSO4 = 0,455
Sau đó thêm tiếp AgNO3 dư → Tạo thêm AgCl = 0,455.2 = 0,91 mol và nAg = nFe2+ = b
→ m↓ = 108b + 0,91.143,5 + 0,455.233 = 256,04 (4)
Giải (1) (2) (3) (4) → a = 0,2; b = 0,18; c = 0,04; d = 0,0125
Như trên đã có nH2SO4 = nNa2SO4 tổng = 0,455
BTNT H: 2nH2SO4 = 8n(NH4)2SO4 + 2nH2 + 2nH2O → nH2O = 0,385 mol
BTKL: mA = m muối + m khí + mH2O – mNaNO3 – mH2SO4 = 27,2 gam
Đáp án B
Đốt cháy hỗn hợp gồm 2,6 gam Zn và 2,24 gam Fe với hỗn hợp khí X gồm clo và oxi, sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không còn khí dư). Hòa tan Y bằng một lượng vừa đủ 120 ml dung dịch HCl 1M, thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z, thu được 28,345 gam kết tủa. Phần trăm thể tích của clo trong hỗn hợp X là
Khi tác dụng với HCl chỉ có các oxit bị hòa tan
→ nHCl = 4nO2 → nO2 = 0,03 mol
Gọi số mol của Cl2 và Ag lần lượt là x, y mol
Bảo toàn nguyên tố Cl → nAgCl = 2nCL2 + nHCl = 2. x + 0,12
→ 143,5( 2. x + 0,12) + 108y = 28,345
Bảo toàn electron cho toàn bộ quá trình 3nFe + 2nZn = 2nCl2 + 4nO2 + nAg
→ 3. 0,04 + 2.0,04 = 2.x + 4. 0,03 + y
Giải hệ → x= 0,035 và y = 0,01
%Cl2 = \(\frac{{0,035}}{{0,035 + 0,03}}.100\% = 53,85\% \). 100% = 53,85%.
Hỗn hợp E gồm ba peptit mạch hở: đipeptit X, tripeptit Y, tetrapeptit Z có tỉ lệ mol tương ứng là 2:1:1. Cho một lượng E phản ứng hoàn toàn với dung dịch NaOH dư, thu được 0,25 mol muối của glyxin, 0,2 mol muối của alanin và 0,1 mol muối của valin. Mặt khác, đốt cháy hoàn toàn m gam E, thu được tổng khối lượng của CO2 và H2O là 39,14 gam. Giá trị của m là
Đặt nX = 2a ⇒ nY = a; nZ = a ⇒ ∑na.a = 2×2a + 3×a + 4×a = 0,25 + 0,2 + 0,1.
⇒ a = 0,05 mol ⇒ ∑nPeptit = 4a = 0,2 mol. Quy E về C2H3NO, CH2 và H2O.
⇒ nC2H3NO = 0,55 mol; nCH2 = 0,2 + 0,1×3 = 0,5 mol; nH2O = 0,2 mol.
+ Đốt E thu được nCO2 = (0,55 × 2 + 0,5) = 1,6 và nH2O = (0,55×1,5 + 0,5 + 0,2) = 1,525
⇒ ∑m(CO2 + H2O) = 97,85 gam ⇒ TN1 gấp 2,5 lần TN2.
⇒ m = (0,55 × 57 + 0,5 × 14 + 0,2 × 18) ÷ 2,5 = 16,78 gam
X, Y (MX < MY) là hai axit kế tiếp thuộc cùng dãy đồng đẳng axit fomic; Z là este hai chức tạo bởi X, Y và ancol T. Đốt cháy 25,04 gam hỗn hợp E chứa X, Y, Z, T (đều mạch hở) cần dùng 16,576 lít O2(đktc) thu được 14,4 gam nước. Mặt khác, đun nóng 12,52 gam E cần dùng 380 ml dung dịch NaOH 0,5M. Biết rằng ở điều kiện thường, ancol T không tác dụng được với Cu(OH)2. Phần trăm khối lượng của X có trong hỗn hợp E gần nhất với:
Bảo toàn khối lượng khi đốt E ⇒ mCO2 = 34,32 gam => nCO2 = 0,78 mol < nH2O.
⇒ Ancol T thuộc loại no 2 chức mạch hở.
Ta có sơ đồ:
+ PT bảo toàn oxi: 2a + 4b + 2c = 0,88 (1).
+ PT theo nH2O – nCO2: –b + c = 0,02 (2).
+ PT theo số mol NaOH pứ: a + 2b = 0,38 (3).
+ Giải hệ (1) (2) và (3) ta có: a = 0,3, b = 0,04 và c = 0,06 mol.
⇒ nHỗn hợp = 0,4 mol ⇒ CTrung bình = 1,95 ⇒ 2 Axit là HCOOH và CH3COOH.
⇒ Hỗn hợp ban đầu gồm:
⇒ PT theo khối lượng hỗn hợp:
0,3(14n+32) + 0,04.[12(x+3) + 2x+4 + 64)] + 0,06.(14x + 34) = 25,04.
Û 4,2n + 1,4x = 9,24 [Với 1 < n < 2 ⇒ 0,6 < x < 3,6].
+ Vì Ancol T không hòa tan Cu(OH)2 ⇒ T là HO–[CH2]3–OH với x = 3.
⇒ n = 1,2 ⇒ nHCOOH = 0,3×(1–0,2) = 0,24 mol ⇒ %mHCOOH = \(\frac{{0,24.46}}{{25,04}} = 44,01\% \)