Đề thi thử THPT QG môn Hóa học năm 2018 - Trường THPT Yên Định- Thanh Hóa
Đề thi thử THPT QG môn Hóa học năm 2018 - Trường THPT Yên Định- Thanh Hóa
-
Hocon247
-
40 câu hỏi
-
90 phút
-
37 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Lấy m gam một axit hữu cơ đơn chức X cho tác dụng với NaHCO3 dư thấy giải phóng 2,2 gam khí. Mặt khác, cho m gam X vào C2H5OH lấy dư trong H2SO4 đặc thì thu được 3,52 gam este (hiệu suất phản ứng là 80%). Giá trị của m là
Đáp án A
Ta có nAxit = nCO2 = 0,05 mol.
⇒ nEste = 0,05×0,8 = 0,04 mol ⇒ MEste = 3,52÷0,04 = 88
⇒ MRCOOC2H5 = 88 Û R = 15 Û Axit là CH3COOH.
⇒ mAxit = 0,05×60 = 3 gam
Dung dịch X có chứa AgNO3 và Cu(NO3)2 có cùng nồng độ mol. Thêm 1 hỗn hợp gồm 0,03 mol Al và 0,05 mol Fe vào 100 ml dung dịch X cho tới khi phản ứng kết thúc thu được chất rắn Y gồm 3 kim loại. Cho m gam Y vào HCl dư giải phóng 0,07 gam khí. Nồng độ của 2 muối ban đầu là:
Đáp án B
Cho Y chứa 3 kim loại, tác dụng với dung dịch HCl dư thu được 0,035 mol khí H2 → Y chứa Fe dư
Vậy Y chứa Cu : x mol , Ag: x mol và Fe dư : 0,035 mol
⇒ Fe pư : 0,05 - 0,035 = 0,015 mol
Bảo toàn electron → 2nCu(NO3)2 + nAgNO3 = 2nFe + 3nAl
⇒ 2x + x = 2. 0,015 + 0,03. 3 → x = 0,04 mol
⇒ CMCu(NO3)2 = CMAgNO3 = 0,04 : 0,1 = 0,4M
Hỗn hợp X gồm metan, etilen, propin và vinyl axetilen có tỉ khối so với hiđro là x. Hỗn hợp Y gồm O2 và O3 có tỉ khối so với hiđro là 1,2x. Đốt 5,376 lít hỗn hợp X cần 15,12 lít hỗn hợp Y. Hấp thụ hoàn toàn sản phẩm cháy vào dung dịch Ba(OH)2 dư thu được m gam kết tủa. Biết các khí được đo ở (đktc). Giá trị của m là:
Đáp án D
► X gồm các chất có dạng C?H₄ ⇒ nH = 4nX = 0,96 mol
Lại có: mX = mC + mH = 0,24 × 2x = 0,48x (g) ⇒ mC = (0,48x – 0,96) (g)
⇒ nC = (0,04x – 0,08) mol
● Y gồm O₂ hay O₃ thì chỉ cần quan tâm O thôi
||⇒ C + [O] → CO₂; 2H + [O] → H₂O ⇒ nO = nC + 0,5nH = (0,04x + 0,4) mol
⇒ mY = mO = 16 × (0,04x + 0,4) = 0,675 × 2,4x ||⇒ x = 15,06
Hòa tan hoàn toàn 20g hỗn hợp A gồm Mg và Fe2O3 bằng dung dịch HNO3 đặc dư thu được dung dịch B và V lít NO2 (đktc) là sản phẩm khử duy nhất. Thêm NaOH dư vào dung dịch B đến kết thúc phản ứng, lọc lấy kết tủa đem nung trong không khí đến khối lượng không đổi thu được 28 gam chất rắn. Giá trị của V là:
Đáp án D
Tăng giảm khối lượng ta có mO/MgO = 28 – 20 = 8 gam.
Bảo toàn nguyên tố Mg ta có nMg = nMgO = 8 ÷ 16 = 0,5 mol.
⇒ nNO2 = 2nMg = 1 mol Û VNO2 = 22,4 lít
Điện phân 1 lít dung dịch X chứa a mol CuSO4 và b mol HCl với điện cực trơ, màn ngăn xốp và dùng điện không đổi, trong thời gian t giây thu được dung dịch pH = 1. Nếu điện phân thêm t giây nữa thì thu được dung dịch có pH = 2. Dung dịch thu được không có khả năng tạo kết tủa với dung dịch AgNO3. Giả sử thể tích dung dịch giảm không đáng kể và khí sinh ra thoát ra hết khỏi dung dịch. Giá trị của a là
Đáp án B
► Dung dịch thu được không pứ với AgNO₃ ⇒ dung dịch thu được không còn Cl⁻
Ở đây ta cần chú ý, với H⁺ bị điện phân tại catot và anot bị điện phân H₂O
thì: 2H⁺ + 2e → H₂ || 2H₂O → 4H⁺ + O₂ + 4e ⇒ cộng lại cho khử e thì:
2H₂O → 2H₂ + O₂ ⇒ xem như điện phân H₂O ⇒ pH không đổi
Mà ta thấy sau t(s) đầu tới t(s) sau thì pH bị thay đổi
⇒ H₂O và H⁺ không bị điện phân cùng lúc ngay t(s) đầu
► Mặt khác, phần xem như điện phân H₂O không cần quan tâm vì không có gì đặc biệt
⇒ xét phần còn lại, thấy nH⁺ giảm = nH⁺ bị điện phân = 0,1 – 0,01 = 0,09 mol
nH⁺ sau khi điện phân t(s) = 0,1 mol = nHCl ban đầu ⇒ nCl⁻ = 0,1 mol
BTe: nCu = (0,1 – 0,09) = 0,005 mol
Nhỏ từ từ đến dung dịch HNO3 loãng vào ống nghiệm chứa 100 ml dung dịch HCl 1,5M và m gam đồng. Đồ thị biểu diễn thể tích khí NO và dung dịch HNO3 (đktc) thu được hình vẽ:
.PNG)
Giá trị của x và y lần lượt là
Đáp án D
Ta có nHCl = 0,15 mol ⇒ nH+ có sẵn = 0,15 mol.
+ Để tạo a mol HNO3 cần a mol HNO3
Ta có: 4H+ + NO3– + 3e → NO + 2H2O.
⇒ 4nNO3– = ∑nH+ Û 4a = a + 0,15 Û a = 0,05 mol.
⇒ CM HNO3 = 0,05×0,05 = 1M Và x = 0,05×22,4 = 1,12 lít.
nNO↑ thêm = 0,075 – 0,05 = 0,025 mol
⇒ nHNO3 cần dùng thêm = 4nNO thoát ra thêm = 0,025×4 = 0,1 mol.
⇒ VHNO3 cần dùng thêm = 0,1×1 = 100 ml.
⇒ y = 50 + 100 = 150ml
Cho hỗn hợp A gồm hai chất hữu cơ mạch hở X, Y (chỉ chứa C, H, O mà MX < MY) tác dụng vừa đủ với 200 ml dung dịch NaOH 1M, thu được 0,2 mol ancol đơn chức và 2 muối của hai axit hữu cơ đơn chức, kế tiếp nhau trong dãy đồng đẳng. Mặt khác đốt cháy 20,56 gam A cần 1,26 mol O2 thu được CO2 và 0,84 mol H2O. Phần trăm số mol của X trong A là:
Đáp án D
♦ Giải đốt cháy: bảo toàn khối lượng có nCO2 = 1,04 mol ||→ A gồm: 1,04 mol C + 1,68 mol H + 0,4 mol O.
• từ thủy phân có X, Y là các hữu cơ đơn chức (dạng -COO-), nancol = nNaOH ||→ X, Y là các este đơn chức.
Kết hợp thủy phân và đốt cháy ||→ nX, Y = 0,4 ÷ 2 = 0,2 mol; ∑nCO2 – nH2O = 0,2 mol
||→ chứng tỏ X, Y đều là este không no, 1 πC=C; MX < MY ||→ Y hơn X một nguyên tử C.
Lại có Ctrung bình = 1,04 ÷ 0,2 = 5,2 ||→ X là C5H8O2 và Y là C6H10O2
C5; C6 và số Ctrung bình ||→ đọc ra tỉ lệ nX ÷ nY = 4 ÷ 1 (sơ đồ chéo!).
||→ Yêu cầu %số mol X trong A = 4 ÷ (4 + 1) = 80%.

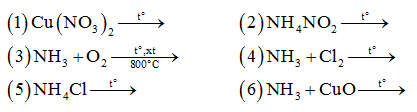
.PNG)
.PNG)
.PNG)
.PNG)
.PNG)
