Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Hoàng Hoa Thám
Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Hoàng Hoa Thám
-
Hocon247
-
40 câu hỏi
-
90 phút
-
24 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Cho các phát biểu sau:
(1). Hỗn hợp Fe2O3 + Cu (tỉ lệ mol 1:1) có thể tan hết trong dung dịch H2SO4 loãng dư.
(2). Nhỏ dung dịch NaOH tới dư vào dung dịch AlCl3 thu được kết tủa.
(3). Trong ăn mòn điện hóa, ở cực âm có quá trình oxi hóa, kim loại bị ăn mòn.
(4). Dùng bột lưu huỳnh để xử lí thủy ngân khi nhiệt kế bị vỡ.
(5). Cho kim loại Zn dư vào dung dịch FeCl3 sau phản ứng thu được dung dịch chứa 1 muối tan.
(6). Cho khí CO dư qua hỗn hợp bột Al2O3 và CuO nung nóng, thu được Al và Cu.
Số phát biểu đúng là
Số phát biểu đúng là 4
Thực hiện các thí nghiệm sau:
(a) Sục khí CO2 dư vào dung dịch Ca(OH)2.
(b) Cho dung dịch NH3 dư vào dung dịch AlCl3.
(c) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3 dư.
(d) Cho dung dịch NaOH vào dung dịch Ca(HCO3)2.
(e) Cho dung dịch AgNO3 vào dung dịch H3PO4.
(g) Sục khí H2S vào dung dịch FeCl3.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là:
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là: 4
Cho hỗn hợp X gồm các peptit mạch hở, đều được tạo thành từ các amino axit có dạng H2NCnHmCOOH. Đun nóng 4,63 gam X với dung dịch KOH dư, thu được dung dịch chứa 8,19 gam muối. Nếu đốt cháy hoàn toàn 4,63 gam X cần 4,2 lít O2 (đktc). Dẫn toàn bộ sản phẩm cháy (CO2, H2O, N2) vào dung dịch Ba(OH)2 dư, sau phản ứng thu được m gam kết tủa và khối lượng dung dịch giảm 21,87 gam. Giá trị của m gần nhất với giá trị nào sau đây?
Quy đổi hỗn hợp X thành C2H3ON (x mol), CH2 (y mol), H2O (z mol) Þ 57x + 14y + 18z = 4,63 (1)
Khi cho X tác dụng với KOH thì: 113x + 14y = 8,19 (2)
Khi cho X tác dụng với O2 thì: 2,25x + 1,5y = 0,1875 (3)
Từ (1), (2), (3) suy ra: x = 0,07 ; y = 0,02 ; z = 0,02
nCO2 = 0,16 mol; mkết tủa = 31,52 gam
Trong các chất: m-HOC6H4OH, p-CH3COOC6H4OH, CH3CH2COOH, (CH3NH3)2CO3, HOOCCH2CH(NH2)COOH, ClH3NCH(CH3)COOH. Có bao nhiêu chất mà 1 mol chất đó phản ứng được tối đa với 2 mol NaOH?
Có 4 chất mà 1 mol chất đó phản ứng được tối đa với 2 mol NaOH
Cho các phát biểu sau:
(1) Phản ứng este hoá là phản ứng một chiều.
(2) Phân tử amilopeptin có cấu trúc mạch nhánh.
(3) Các polipeptit luôn có phản ứng với Cu(OH)2 tạo thành dung dịch có màu tím xanh.
(4) Tơ visco và tơ tằm đều có nguồn gốc từ polime thiên nhiên.
Số câu phát biểu đúng là
Số câu phát biểu đúng là 2
Trong các kim loại sau: Zn, Mg, Fe và Cu, kim loại nào có tính khử mạnh nhất?
Mg có tính khử mạnh nhất
Trong công nghiệp, để điều chế NaOH người ta điện phân dung dịch chất X (có màng ngăn). X là gì?
Trong công nghiệp, để điều chế NaOH người ta điện phân dung dịch NaCl bão hòa
Trường hợp nào sau đây khí sinh ra không gây ô nhiễm không khí?
Quá trình quang hợp của cây xanh.
Sản phẩm của phản ứng este hóa giữa ancol etylic và axit axetic là gì?
Sản phẩm của phản ứng este hóa giữa ancol etylic và axit axetic là etyl axetat.
Sục khí CO2 vào lượng dư dung dịch Ca(OH)2 tạo thành kết tủa có màu gì?
Sục khí CO2 vào lượng dư dung dịch Ca(OH)2 tạo thành kết tủa có màu trắng
Dung dịch chất nào sau đây không làm quỳ tím đổi màu?
Anilin không làm quỳ tím đổi màu
Ở điều kiện thường, cho nhôm vào dung dịch nào không xảy ra phản ứng?
Ở điều kiện thường, cho nhôm vào dung dịch MgCl2 không xảy ra phản ứng
Chất nào vừa phản ứng với dung dịch NaOH vừa phản ứng với dung dịch HCl?
Al(OH)3 vừa phản ứng với dung dịch NaOH vừa phản ứng với dung dịch HCl
Polime nào được tổng hợp bằng phản ứng trùng hợp?
Poli(vinyl clorua) được tổng hợp bằng phản ứng trùng hợp
Kim loại crom tan được trong dung dịch nào?
Kim loại crom tan được trong dung dịch HCl nóng.
Thủy phân hoàn toàn tinh bột trong môi trường axit, thu được sản phẩm gì?
Thủy phân hoàn toàn tinh bột trong môi trường axit, thu được P2O5
Cho 20 gam hỗn hợp X gồm Ag và Al vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được 13,44 lít khí H2 (đktc). Phần trăm khối lượng của Al trong X là
Phần trăm khối lượng của Al trong X là 54,0%.
Cho dãy các chất sau: tripanmitin, axit aminoaxetic, Ala-Gly-Glu, etyl propionat. Số chất trong dãy có phản ứng với dung dịch NaOH (đun nóng) là bao nhiêu?
Số chất trong dãy có phản ứng với dung dịch NaOH (đun nóng) là 4
Phát biểu nào sau đay sai?
Phát biểu sai là: Xenlulozơ và tinh bột có phân tử khối bằng nhau.
Xà phòng hóa hoàn toàn este X mạch hở trong dung dịch NaOH, thu được hỗn hợp các chất hữu cơ gồm: (COONa)2, CH3CHO và C2H5OH. Công thức phân tử của X là gì?
Công thức phân tử của X là C6H8O4
Thực hiện các thí nghiệm sau:
(1) Cho lá kim loại Fe nguyên chất vào dung dịch CuSO4.
(2) Cho lá thép để trong không khí ẩm thời gian thấy thanh thép bị gỉ.
(3) Nhúng thanh sắt vào dung dịch FeCl3.
(4) Cho lá kim loại Fe-Cu vào dung dịch H2SO4 loãng.
Số thí nghiệm xảy ra ăn mòn điện hóa học là bao nhiêu?
Số thí nghiệm xảy ra ăn mòn điện hóa học là 3
Khi thủy phân hoàn toàn một triglixerit X trong môi trường axit thu được hỗn hợp sản phầm gồm glixerol, axit panmitic và axit oleic. Số công thức cấu tạo của X thoản mãn tính chất trên là bao nhiêu?
Số công thức cấu tạo của X thoản mãn tính chất trên là 4
Cho các dung dịch loãng: (1) AgNO3, (2) FeCl2, (3) HNO3, (4) FeCl3, (5) H2SO4, (6) hỗn hợp gồm NaNO3 và HCl. Số dung dịch phản ứng được với Cu là bao nhiêu?
Số dung dịch phản ứng được với Cu là 4
Cho các loại tơ sau: nilon-6, visco, xenlulozơ axetat, nitron, enang, nilon-6,6. Số tơ thuộc tơ tổng hợp là bao nhiêu?
Số tơ thuộc tơ tổng hợp là 4
Hòa tan hoàn toàn 21,24 gam hỗn hợp gồm muối hiđrocacbonat (X) và muối cacbonat (Y) vào nước thu được 200 ml dung dịch Z. Cho từ từ 200 ml dung dịch KHSO4 0,3M và HCl 0,45M vào 200 ml dung dịch X, thu được 1,344 lít khí CO2 (đktc) và dung dịch T. Cho dung dịch Ba(OH)2 dư vào T, thu được 49,44 gam kết tủa. Biết X là muối của kim loại kiềm. Nhận định nào sau đây là sai?
Chọn C.
- Khi cho dung dịch Z tác dụng với dung dịch chứa 0,06 mol KHSO4 và 0,09 mol HCl thì :
\({n_{C{O_3}^{2 - }(trong\,Z)}} = {n_{HCl}} + {n_{KHS{O_4}}} - {n_{C{O_2}}} = 0,09\,mol\)
- Khi cho dung dịch T tác dụng với Ba(OH)2 ta được :
\({n_{BaS{O_4}}} = {n_{NaHS{O_4}}} = 0,06\,mol \Rightarrow {n_{BaC{O_3}}} = \frac{{{m_ \downarrow } - 233{n_{BaS{O_4}}}}}{{197}} = 0,18\,mol\), vậy trong T chứa 0,18 mol HCO3-
\(\xrightarrow{{BT:\,C}}{n_{HC{O_3}^ - (trong\,Z)}} = {n_{BaC{O_3}}} + {n_{C{O_2}}} - {n_{C{O_3}^{2 - }}} = 0,15\,mol\)
- Vậy trong Z chứa 0,15 mol HCO3- và 0,09 mol CO32-
- Giả sử X là muối NaHCO3, gọi muối của Y là A2(CO3)n ta có :
\({n_{{A_2}{{(C{O_3})}_n}}} = \frac{{{n_{C{O_3}^{2 - }}}}}{n} = \frac{{0,15}}{n} \to {M_{{A_2}{{(C{O_3})}_n}}} = \frac{{{m_{{\text{mu\`e i}}}} - 84{n_{NaHC{O_3}}}}}{{{n_{{A_2}{{(C{O_3})}_n}}}}} = \frac{{8,64n}}{{0,09}}\xrightarrow{{n\, = 1}}{M_{{A_2}C{O_3}}} = 96\)
\( \Rightarrow {M_A} = \frac{{{M_{{A_2}C{O_3}}} - {M_{C{O_3}^{2 - }}}}}{2} = 18\,(N{H_4}^ + )\). Vậy muối X là NaHCO3 và Y là (NH4)2CO3.
- Không xét tiếp các trường hợp còn lại vì trường hợp trên đã thỏa mãn.
A. Đúng, NaHCO3 (X) là muối natri hiđrocacbonat chiếm 59,32% về khối lượng hỗn hợp.
B. Đúng, (X) NaHCO3 và (Y) (NH4)2CO3 đều có tính lưỡng tính.
C. Sai, (Y) (NH4)2CO3 là muối amoni cacbonat chiếm 40,67% về khối lượng hỗn hợp.
D. Đúng (X) NaHCO3 và (Y) (NH4)2CO3 đều bị phân hủy bởi nhiệt.
Đốt a mol X là trieste của glixerol và các axit đơn chức, mạch hở thu được b mol CO2 và c mol H2O, biết b - c = 4a. Hiđro hóa hoàn toàn m gam X cần 6,72 lít H2 (đktc) thu được 133,5 gam Y. Nếu đun m gam X với dung dịch chứa 500 ml NaOH 1M đến phản ứng xảy ra hoàn toàn, cô cạn dung dịch sau phản ứng khối lượng chất rắn khan thu được là bao nhiêu?
\({n_{C{O_2}}} - {n_{{H_2}O}} = {n_X}({k_X} - 1) \to 4a = a({k_X} - 1) \Rightarrow {k_X} = 5 = 3{\pi _{ - COO - }} + 2{\pi _{C - C}}\)
Hidro hóa m (g) X với \({n_X} = \frac{{{n_{{H_2}}}}}{2} = 0,15\;mol\xrightarrow{{BTKL}}{m_X} = {m_Y} - 2{n_{{H_2}}} = 132,9\,(g)\)
- Cho m (g) X tác dụng với NaOH thì \({n_X} = {n_{{C_3}{H_5}{{(OH)}_3}}} = 0,15\;mol\)
\(\xrightarrow{{BTKL}}{m_r} = {m_X} + 40{n_{NaOH}} - 92{n_{{C_3}{H_5}{{(OH)}_3}}} = \boxed{139,1\;(g)}\)
X có công thức phân tử C10H8O4. Từ X thực hiện các phản ứng (theo đúng tỉ lệ mol):
C10H8O4 + 2NaOH → X1 + X2 X1 + 2HCl → X3 + 2NaCl
nX3 + nX2 → poli(etylen-terephtalat) + 2nH2O
Phát biểu nào sau đây sai ?
\(\mathop {n(p - H{\text{OO}}C{C_6}{H_4}COOH)}\limits_{Axit\;t{\text{er}}ephtalic\;({X_3})} + \mathop {n(HOC{H_2}C{H_2}OH)}\limits_{Etylen\;glic{\text{o}}l\;({X_2})} \xrightarrow{{{t^o}}}\mathop {{\text{O}}C - {C_6}{H_4} - CO - OC{H_2} - C{H_2} - O{{}_n}}\limits_{Poli\;(etylen - t{\text{er}}ephtalat)\;hay\;to\;lapsan} + 2n{H_2}O\)
p–NaOOCC6H4COONa (X1) + 2HCl → p–HOOCC6H4COOH (X3) + 2NaCl
p–C6H4(COO)2C2H4 (X) + 2NaOH →p–NaOOCC6H4COONa (X1) + C2H4(OH)2 (X2) + H2O
D. Sai, số nguyên tử H trong p–HOOCC6H4COOH (X3) bằng 6
Tiến hành các thí nghiệm sau:
(a) Cho Cu dư vào dung dịch Fe(NO3)3.
(b) Sục khí CO2 dư vào dung dịch NaOH.
(c) Cho Na2CO3 dư vào dung dịch Ca(HCO3)2.
(d) Cho bột Fe dư vào dung dịch FeCl3.
(e) Hoà tan hỗn hợp rắn gồm Na và Al (có cùng số mol) vào lượng nước dư.
(f) Sục khí Cl2 dư vào dung dịch FeCl2.
Sau khi các phản ứng xảy ra hoàn toàn, dung dịch thu được chứa một muối tan là
Chọn C.
(a) Cu dư + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
(b) CO2 dư + NaOH→NaHCO3
(c) Na2CO3 dư + Ca(HCO3)2→CaCO3 + NaHCO3 (ngoài ra còn Na2CO3 dư)
(d) Fe dư + 2FeCl3→3FeCl2
(e) 2Na + 2H2O → 2NaOH + H2 sau đó 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
(f) Cl2 + 2FeCl2 → 2FeCl3
Các phản ứng thoả mãn là (b), (d), (e) và (f).
Tiến hành các thí nghiệm sau:
(a) Thổi CO2 đến dư vào dung dịch Ca(OH)2.
(b) Cho từ từ dung dịch chứa 4a mol NaOH vào dung dịch chứa 1,5a mol AlCl3.
(c) Cho dung dịch HCl đến dư vào dung dịch KOH và KAlO2.
(d) Cho KHSO4 vào dung dịch Ba(HCO3)2.
(e) Cho dung dịch chứa a mol FeCl2 vào dung dịch chứa amol AgNO3.
(g) Cho a mol Zn vào dung dịch chứa 3a mol HCl được dung dịch X. Cho từ từ 5a mol KOH vào X.
(h) Thổi CO2 đến dư vào dung dịch chứa đồng thời Ba(OH)2 và Ba(AlO2)2.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là 4
Cho các phát biểu sau:
(a) Saccarozơ được cấu tạo từ hai gốc a-glucozơ.
(b) Oxi hóa glucozơ, thu được sobitol.
(c) Trong phân tử fructozơ có một nhóm –CHO.
(d) Xenlulozơ trinitrat được dùng làm thuốc súng không khói.
(e) Trong phân tử xenlulozơ, mỗi gốc glucozơ có ba nhóm –OH.
(g) Saccarozơ bị thủy phân trong môi trường kiềm.
Số phát biểu đúng là
Số phát biểu đúng là 2
Một học sinh tiến hành nghiên cứu dung dịch X đựng trong lọ không dán nhãn thì thu được kết quả sau:
- X đều có phản ứng với dung dịch NaOH và dung dịch Na2CO3.
- X đều không phản ứng với dung dịch HCl và HNO3.
X là dung dịch nào sau đây?
X là dung dịch MgCl2
Đun nóng hỗn hợp X gồm 0,1 mol etilen; 0,1 mol vinylaxetilen và 0,3 mol hiđro với xúc tác Ni một thời gian, thu được hỗn hợp Y có tỉ khối so với hiđro bằng 10,75. Cho toàn bộ Y vào dung dịch brom dư thấy có tối đa a mol brom phản ứng. Giá trị của a là
mX = mY→ nY = mX: MY = (0,1.28 + 0,1.52 + 0,3.2)/(10,75.2) = 0,4
npi (pư) = ngiảm= 0,5 - 0,4 = 0,1
npi (Y) = 0,1.1 + 0,1.3 - 0,1 = 0,3
a = 0,3
Hòa tan hoàn toàn hỗn hợp X gồm CuSO4 và KCl vào H2O, thu được dung dịch Y. Điện phân Y (có màng ngăn, điện cực trơ) đến khi H2O bắt đầu điện phân ở cả hai điện cực thì dừng điện phân. Số mol khí thoát ra ở anot bằng 4 lần số mol khí thoát ra từ catot. Giả sử các khí sinh ra không hoà tan trong nước. Phần trăm khối lượng của CuSO4 trong X là
Chọn B.
- Giả sử số mol KCl trong X là 1 mol, khi đó quá trình điện phân xảy ra như sau :
|
Tại catot |
Tại anot |
|
Cu2+ + 2e → Cu a mol → 2a mol 2H2O + 2e → 2OH- + H2 2b mol → b mol |
2Cl- → Cl2 + 2e 1 mol 0,5 mol |
- Theo đề bài ta có : \(\left\{ \begin{gathered} \xrightarrow{{BT:\,e}}2{n_{Cu}} + 2{n_{{H_2}}} = {n_{C{l^ - }}} \hfill \\ {n_{C{l_2}}} = 4{n_{{H_2}}} \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered} 2a + 2b = 1 \hfill \\ 4b = 0,5 \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered} a = 0,375\,mol \hfill \\ b = 0,125\,mol \hfill \\ \end{gathered} \right.\)
- Vậy hỗn hợp X gồm CuSO4 (0,375 mol) và KCl (1 mol)
\(\% {m_{CuS{O_4}}} = \frac{{0,375.160}}{{0,375.160 + 1.74,5}}.100 = 44,61\% \)
Hỗn hợp X gồm một số amino axit (chỉ có nhóm chức –COOH và –NH2, không có nhóm chức khác). Trong hỗn hợp X, tỉ lệ khối lượng của oxi và nitơ tương ứng là 192 : 77. Để tác dụng vừa đủ với 19,62 gam hỗn hợp X cần 220 ml dung dịch HCl 1M. Mặt khác đốt cháy hoàn toàn 19,62 gam hỗn hợp X cần V lít O2 (đktc) thu được 27,28 gam CO2 (sản phẩm cháy gồm CO2, H2O, N2). Giá trị của V là
Chọn B.
- Khi cho X tác dụng với HCl thì: \({n_{N(X)}} = {n_{HCl}} = 0,22\;mol\) mà \(\frac{{{m_O}}}{{{m_N}}} = \frac{{192}}{{77}} \Rightarrow {n_O} = 0,48\;mol\)
- Khi đốt cháy X thì: \({n_{C{O_2}}} = {n_C} = 0,62\;mol \Rightarrow {n_{{H_2}O}} = 0,5{n_H} = 0,5({m_X} - {m_C} - {m_O} - {m_N}) = 0,71\;mol\)
\(\xrightarrow{{BT:\;O}}{n_{{O_2}}} = {n_{C{O_2}}} + 0,5{n_{{H_2}O}} - 0,5{n_{O(X)}} = 0,735\;mol \Rightarrow {V_{{O_2}}} = 16,464\;(l)\)
Một loại khoai chứa 30% tinh bột. Người ta dùng loại khoai đó để sản xuất ancol etylic bằng phương pháp lên men. Khối lượng khoai cần dùng để sản xuất 100 lít ancol etylic 400 (khối lượng riêng của ancol etylic là 0,8 g/ml, hiệu suất cả quá trình là 80%) có giá trị gần nhất với
m = (100.0,4.0,8.162)/(46.0,8.0,3) = 234,782 kg
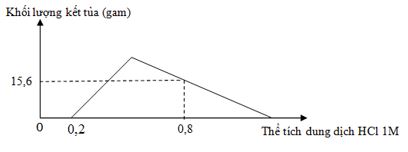
Hoà tan hoàn toàn m gam hỗn hợp X gồm Ba, BaO, Al và Al2O3 vào nước dư, thu được dung dịch Y và 5,6 lít H2 (đktc). Nhỏ từ từ đến dư dung dịch HCl 1M vào dung dịch Y. Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa Al(OH)3 theo thể tích dung dịch HCl 1M như sau:
Giá trị của m là
Chọn C.
- Quy đổi hỗn hợp X ban đầu thành Ba, Al và O.
- Dựa vào đồ thị thì dung dịch Y gồm Ba2+, AlO2– và OH– dư.
+ Tại vị trí \({n_{HCl}} = 0,2\;mol \Rightarrow {n_{O{H^ - }}}\)dư = 0,2 mol
+ Tại vị trí: \({n_{HCl}} = 0,8\;mol\)ta có: \(4{n_{Al{O_2}^--}} - 3{n_{Al{{(OH)}_3}}} + \)\({n_{O{H^ - }}}\)dư = nHCl → \({n_{Al{O_2}^--}} = 0,3\;mol\)
\(\xrightarrow{{BT{\text{D}}T}}{n_{B{a^{2 + }}}} = 0,5({n_{O{H^ - }}}du + {n_{Al{O_2}^--}}) = 0,25mol\)
- Khi cho X tác dụng với lượng nước dư thì: \(\xrightarrow{{BT:\;e}}{n_O} = \frac{{{n_{Ba}} + 3{n_{Al}} - 2{n_{{H_2}}}}}{2} = 0,45\;mol\)
Vậy \({m_X} = \boxed{49,55\;(g)}\)
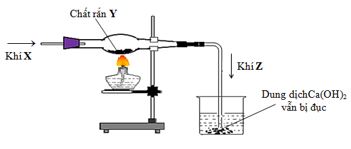
Hình vẽ sau đây mô tả thí nghiệm khí X tác dụng với chất rắn Y, nung nóng sinh ra khí Z:
Cho các phản ứng hoá học sau:
(1) CaSO3 + HCl → CaCl2 + SO2 + H2O (2) CuO + CO→Cu + CO2
(3) C + Fe3O4 → Fe + CO2 (4) Fe2O3 + 3H2→2Fe + 3H2O
Số phản ứng thoả mãn thí nghiệm trên là
Chọn C.
Khí X là CO chất rắn Y là oxit kim loại (đứng sau Al trong dãy điện hoá) và khí được tạo thành là CO2 được dẫn vào dung dịch Ca(OH)2 tạo kết tủa trắng làm dung dịch trở nên đục.
Cho X, Y là hai axit cacboxylic đơn chức, no mạch hở (MX < MY), T là este hai chức tạo bởi X, Y và một ancol no mạch hở Z. Đốt cháy hoàn toàn 8,58 gam hỗn hợp E gồm X, Y, T bằng một lượng vừa đủ O2, thu được 7,168 lít CO2 và 5,22 gam nước. Mặt khác 8,58 gam E tác dụng với dung dịch AgNO3 trong NH3 dư, đun nóng thu được 17,28 gam Ag. Khối lượng chất rắn khan thu được khi cho cùng lượng E trên tác dụng với 150 ml dd NaOH 1M là
Khối lượng chất rắn khan thu được khi cho cùng lượng E trên tác dụng với 150 ml dd NaOH 1M là 11,04 gam
Cho hỗn hợp X gầm 0,12 mol CuO; 0,1 mol Mg và 0,05 mol Al2O3 tan hoàn toàn trong dung dịch chứa đồng thời 0,15 mol H2SO4 (loãng) và 0,55 mol HCl, thu được dung dịch Y và khí H2. Nhỏ từ từ dung dịch hỗn hợp Ba(OH)2 0,1M và NaOH 0,6M vào Y đến khi thu được khối lượng kết tủa lớn nhất, lọc kết tủa đem nung đến khối lượng không đổi, thu được m gam chất rắn khan. Giá trị của m gần nhất với giá trị nào sau đây?
Chọn A.
- Dung dịch Y gồm Cu2+ (0,12 mol), Mg2+ (0,1 mol), Al3+ (0,1 mol), H+(dư) (0,11 mol), SO42- (0,15 mol) và Cl- (0,55 mol).
- Khi cho dung dịch hỗn hợp Ba(OH)2 0,1M và NaOH 0,6M vào Y đến khi thu được khối lượng kết tủa lớn nhất thì ta xét hai trường hợp sau :
- TH1 : BaSO4 kết tủa cưc đại.
+ Khi đó \({n_{Ba{{(OH)}_2}}} = {n_{S{O_4}^{2 - }}} = 0,15\,mol \Rightarrow {n_{NaOH}} = 6.{n_{Ba{{(OH)}_2}}} = 0,9\,mol\)
+ Nhận thấy \({n_{O{H^ - }}} > {n_{{H^ + }(d)}} + 2{n_{M{g^{2 + }}}} + 2{n_{C{u^{2 + }}}} + 4{n_{A{l^{3 + }}}}\)nên trong hỗn hợp kết tủa chỉ chứa BaSO4
(0,15 mol), Cu(OH)2 (0,12 mol) và Mg(OH)2 (0,1 mol).
+ Khi nung hỗn hợp kết tủa thì : \({m_{{\text{ran khan}}}} = 233{n_{BaS{O_4}}} + 80{n_{CuO}} + 40{n_{MgO}} = \boxed{48,55\,(g)}\)
- TH2 : Al(OH)3 kết tủa cưc đại.
+ Khi đó \({n_{O{H^ - }}} = {n_{{H^ + }(du)}} + 2{n_{M{g^{2 + }}}} + 2{n_{C{u^{2 + }}}} + 3{n_{A{l^{3 + }}}} \to 2{n_{Ba{{(OH)}_2}}} + {n_{NaOH}} = 0,85\) mol
\( \to x.0,1.2 + x.0,6 = 0,85 \Rightarrow x = 1,065\,mol\)
Þ Kết tủa gồm BaSO4 (0,1065 mol), Mg(OH)2 (0,1 mol), Cu(OH)2 (0,12 mol) và Al(OH)3 (0,1 mol)
+ Khi nung hỗn hợp kết tủa thì : \({m_{{\text{ran khan}}}} = 233{n_{BaS{O_4}}} + 80{n_{CuO}} + 40{n_{MgO}} + 102{n_{A{l_2}{O_3}}} = 43,45625\,(g) \)
Vậy khối lượng rắn khan cực đại là 48,55 gam