Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Trần Phú
Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Trần Phú
-
Hocon247
-
40 câu hỏi
-
90 phút
-
39 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Sắt tác dụng với lưu huỳnh (đun nóng), thu được sản phẩm là
Sắt tác dụng với lưu huỳnh (đun nóng), thu được sản phẩm là FeS
Kim loại nào sau đây tan được trong dung dịch HCl?
Zn tan được trong dung dịch HCl
Chất nào sau đây được dùng để khử chua đất trong nông nghiệp?
CaO được dùng để khử chua đất trong nông nghiệp
Dung dịch nào sau đây làm quỳ tím hoá đỏ?
HNO3 làm quỳ tím hoá đỏ
Chất bột X màu đen, có khả năng hấp phụ các khí độc nên được dùng trong trong các máy lọc nước, khẩu trang y tế, mặt nạ phòng độc. Chất X là
Chất X là than hoạt tính.
Công thức của axit fomic là
Công thức của axit fomic là HCOOH
Tơ nào sau đây thuộc loại tơ nhân tạo?
Tơ visco thuộc tơ nhân tạo
Dung dịch chất nào sau đây hòa tan được Al2O3?
Dung dịch NaOH hòa tan được Al2O3
Cặp dung dịch chất nào sau đây phản ứng với nhau tạo ra chất kết tủa?
Cặp dung dịch NH4Cl và AgNO3 phản ứng với nhau tạo ra chất kết tủa
Este nào sau đây tác dụng với dung dịch NaOH thu được ancol etylic?
Este CH3COOC2H5 tác dụng với dung dịch NaOH thu được ancol etylic
Cho 2 ml ancol etylic vào ống nghiệm khô có sẵn vài viên đá bọt, sau đó thêm từng giọt dung dịch H2SO4 đặc, lắc đều. Đun nóng hỗn hợp, sinh ra hiđrocacbon Y làm nhạt màu dung dịch KMnO4. Chất Y là
Chất Y là etilen
Thí nghiệm nào sau đây thu được muối sắt(II) sau khi kết thúc phản ứng?
Cho Fe vào dung dịch CuSO4 thu được muối sắt(II) sau khi kết thúc phản ứng
Thí nghiệm nào sau đây có xảy ra ăn mòn điện hóa học?
Nhúng thanh kẽm vào dung dịch hỗn hợp gồm CuSO4 và HCl loãng xảy ra ăn mòn điện hóa
Phát biểu nào sau đây đúng?
PE được điều chế bằng phản ứng trùng hợp.
Thủy phân hoàn toàn tinh bột, thu được monosaccarit X. Lên men X (xúc tác enzim) thu được chất hữu cơ Y và khí cacbonic. Hai chất X, Y lần lượt là
Hai chất X, Y lần lượt là glucozơ, etanol.
Phát biểu nào sau đây đúng?
Axit glutamic là hợp chất có tính lưỡng tính.
Cho 11,6 gam Fe vào 100 ml dung dịch CuSO4 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được m gam hỗn hợp kim loại. Giá trị của m ?
Chọn D.
Ta có: nFe pư = nCu = 0,1 mol Þ mrắn = (11,6 – 5,6) + 6,4 = 12,4 gam
Cho hơi nước đi qua than nóng đỏ được hỗn hợp khí X gồm CO2, CO và H2. Toàn bộ lượng X khử vừa hết 48 gam Fe2O3 thành Fe và thu được 10,8 gam H2O. Phần trăm thể tích của CO2 trong hỗn hợp X
Chọn A.
Quá trình: \({H_2}O + C\xrightarrow{{{t^o}}}CO,\;C{O_2},\,{H_2}\) (1)
Hỗn hợp khí CO, H2 + [O] → CO2, H2O (với \({n_{CO}} = {n_{C{O_2}}};{n_{{H_2}}} = {n_{{H_2}O}}\) )
Þ \({n_{CO}} + {n_{{H_2}}} = {n_{O\;({\text{ox}}it)}} = 3{n_{F{e_2}{O_3}}} \Rightarrow {n_{CO}} = 0,3\;mol\)
Theo (1) áp dụng BTNT H, O: \({n_{{H_2}}} = {n_{{H_2}O}} = {n_{CO}} + 2{n_{C{O_2}}} \Rightarrow {n_{C{O_2}}} = 0,15\;mol \Rightarrow \% {V_{C{O_2}}} = 14,28\% \)
Cho sơ đồ các phản ứng sau (theo đúng tỉ lệ mol):
(a) 2X1 + 2H2O \(\xrightarrow[{co\,mang\,ngan}]{{dien\,phan}}\) 2X2 + X3 + H2 (b) X2 + CO2 → X5
(c) 2X2 + X3 → X1 + X4 + H2O (d) X2 + X5 → X6 + H2O
Biết X1, X2, X4, X5, X6 là các hợp chất khác nhau của kali. Các chất X4 và X6 lần lượt là
Chọn D.
(a) 2KCl (X1) + 2H2O \(\xrightarrow[{co\,mang\,ngan}]{{dien\,phan}}\) 2KOH (X2) + Cl2 (X3) + H2
(b) KOH (X2) + CO2 →KHCO3 (X5)
(c) 2KOH (X2) + Cl2 (X3) →KCl (X1) + KClO (X4) + H2O
(d) KOH (X2) + KHCO3 (X5) → K2CO3 (X6) + H2O
Nung nóng 0,1 mol C4H10 có xúc tác thích hợp, thu được hỗn hợp khí gồm H2, CH4, C2H4, C2H6, C3H6, C4H8 và C4H10. Dẫn X qua bình đựng dung dịch Br2 dư, sau khi phản ứng hoàn toàn khối lượng bình tăng m gam và có hỗn hợp khí Y thoát ra. Đốt cháy hoàn toàn Y cần vừa đủ 6,832 lít khí O2. Giá trị của m là
Chọn A.
Quá trình nung: C4H10 → CnH2n + CmH2m + 2 (n ≥ 1; n ≥ 0)
Khi đốt cháy Y gồm CmH2m + 2 : x mol và C4H10 dư: 0,1 – x (mol) luôn có: \({n_{{H_2}O}} - {n_{C{O_2}}} = {n_Y} = 0,1\) (1)
và \(\xrightarrow{{BT:\;O}}{n_{{H_2}O}} + 2{n_{C{O_2}}} = 2.0,305\)(2). Từ (1), (2) ta có: \(\left\{ \begin{gathered} {n_{{H_2}O}} = 0,27\;mol \hfill \\ {n_{C{O_2}}} = 0,17\;mol \hfill \\ \end{gathered} \right. \Rightarrow {m_Y} = {m_C} + {m_H} = 2,58\;(g)\)
Theo BTKL: \({m_{{C_4}{H_{10}}}} = m + {m_Y} \Rightarrow m = 3,22\;(g)\)
Hòa tan hoàn toàn m gam hỗn hợp gồm Na2O và Al2O3 (tỉ lệ mol tương ứng là 4 : 3) vào nước, thu được dung dịch X. Cho từ từ dung dịch HCl 1M vào X, kết quả thí nghiệm được ghi ở bảng sau
Hỗn hợp gồm Na2O (4x mol) và Al2O3 (3x mol) Þ X chứa OH- dư (2x mol) và AlO2- (6x mol).
Khi cho từ từ HCl vào X thì: \(\left\{ \begin{gathered} {n_{O{H^ - }}} + {n_{Al{{(OH)}_3}}} = {n_{{H^ + }\;(1)}} \hfill \\ {n_{O{H^ - }}} + (4{n_{Al{O_2}^ - }} - 3{n_{Al{{(OH)}_3}}}) = {n_{{H^ + }\;(2)}} \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered} 2x + \frac{a}{{78}} = 0,3 \hfill \\ 26x - 3.\frac{{a + 2,6}}{{78}} = 0,6 \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered} x = 0,05 \hfill \\ a = 15,6 \hfill \\ \end{gathered} \right.\)
Þ m = 4.0,05.62 + 3.0,05.102 = 27,7 (g).
Cho các phát biểu sau :
(a) Cao su lưu hóa có tính đàn hồi, lâu mòn và khó tan hơn cao su thường.
(b) Glucozơ gọi là đường mía, fructozơ gọi là đường mật ong.
(c) Lực bazơ của amoniac yếu hơn lực bazơ của metylamin.
(d) Để giảm đau nhức khi bị ong hoặc kiến đốt có thể bôi vôi tôi vào vết đốt
(e) Mỡ lợn hoặc dầu dừa có thể dùng làm nguyên liệu để sản xuất xà phòng và glixerol.
Số phát biểu đúng là
Số phát biểu đúng là 4
Thực hiện các thí nghiệm sau :
(a) Sục khí CO2 vào dung dịch CaCl2 dư.
(b) Cho kim loại Na vào dung dịch Fe(NO3)3 dư.
(c) Cho dung dịch Ba(OH)2 dư vào dung dịch Al2(SO4)3.
(d) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3 dư.
(e) Hoà tan CaO vào dung dịch NaHCO3 dư.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được kết tủa là
(a) CO2 + CaCl2 : không phản ứng.
(b) 3Na + Fe(NO3)3 + 3H2O → 3NaNO3 + Fe(OH)3¯ + 3/2H2
(c) 4Ba(OH)2 dư + Al2(SO4)3 → 3BaSO4¯ + Ba(AlO2)2 + 4H2O
(d) Fe(NO3)2 + AgNO3 dư → Fe(NO3)3 + Ag¯
(e) CaO + H2O → Ca(OH)2 ; Ca(OH)2 + NaHCO3 → CaCO3¯ + NaOH + H2O
Từ X thực hiện các phản ứng sau (theo đúng tỉ lệ mol):
(a) X + 2NaOH →Y + Z + T (b) X + H2 →E
(c) E + 2NaOH →2Y + T (d) Y + HCl → NaCl + F
Biết X là chất hữu cơ mạch hở, có công thức phân tử là C8H12O4. Phân tử khối của chất F
Chọn B.
Công thức cấu tạo của X là CH3-CH2-COO-CH2-CH2-OOC-CH=CH2.
Phân tử khối của chất F là 74.
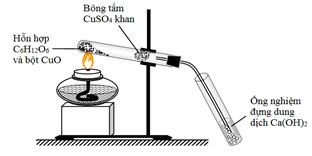
Cho mô hình thí nghiệm sau:
Cho các nhận xét sau:
(a) Thí nghiệm trên nhằm mục đích xác định định tính cacbon và hiđro trong hợp chất hữu cơ.
(b) Bông tẩm CuSO4 khan nhằm phát hiện sự có mặt của nước trong sản phẩm cháy.
(c) Ống nghiệm được lắp hơi chúi xuống để oxi bên ngoài dễ vào để đốt cháy chất hữu cơ.
(d) Ống nghiệm đựng nước vôi trong để hấp thụ khí CO2 và khí CO.
(e) Chất để sử dụng để oxi hóa chất hữu cơ trong thí nghiệm trên là CuO.
(f) Có thể sử dụng mô hình trên để xác định nitơ trong hợp chất hữu cơ.
Số phát biểu đúng
Chọn A.
(c) Sai, Ống nghiệm được lắp hơi chúi xuống để chất rắn nóng chảy không chảy ngược vào ống nghiệm.
(d) Sai, Ống nghiệm đựng nước vôi trong để hấp thụ khí CO2.
(f) Sai, Mô hình trên không được dùng xác định nitơ trong hợp chất hữu cơ.
Hòa tan hỗn hợp gồm gồm CuSO4 và NaCl vào nước, thu được dung dịch X. Tiến hành điện phân X với điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Tổng số mol khí thu được ở cả hai điện cực (n) phụ thuộc vào thời gian điện phân (t) được mô tả như đồ thị bên. Giả thiết hiệu suất điện phân là 100%, bỏ qua sự bay hơi của nước. Giá trị của m?
Chọn B.
Đoạn 1: Cl2 ; Đoạn 2: dốc tốc độ thoát khí nhanh Þ Cl2, H2 ; Đoạn 3: đi lên nhưng không dốc Þ H2, O2.
Tại thời điểm t (h) có khí Cl2 thoát ra với số mol là 0,1 Þ ne (1) = 0,2 mol
Tại thời điểm t đến 2t (h) có khí Cl2 và H2 thoát ra Þ H2 (0,1 mol)
Khi đó: \({n_{C{l_2}}} = 0,2\;mol \Rightarrow {n_{NaCl}} = 0,4\;mol\)và \(\xrightarrow{{BT:\;e}}{n_{Cu}} = \frac{{2{n_{C{l_2}}} - 2{n_{{H_2}}}}}{2} = 0,1\;mol\)
Vậy m = 0,1.160 + 0,4.58,5 = 39,4 (g).
Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Cu và FeS vào dung dịch chứa 0,32 mol H2SO4 (đặc), đun nóng, thu được dung dịch Y (chất tan chỉ gồm các muối trung hòa) và 0,24 mol SO2 (là chất khí duy nhất). Cho 0,25 mol NaOH phản ứng hết với dung dịch Y, thu được 7,63 gam kết tủa. Giá trị của m là
Chọn C.
\(\xrightarrow{{BT:\;H}}{n_{{H_2}O}} = {n_{{H_2}S{O_4}}} \Rightarrow {n_{{H_2}O}} = 0,32\;mol\xrightarrow{{BT:\;O}}4{n_{{H_2}S{O_4}}} = 4{n_{S{O_4}^{2 - }}} + 2{n_{S{O_2}}} + {n_{{H_2}O}} \Rightarrow {n_{S{O_4}^{2 - }}} = 0,12\;mol\)
Dung dịch thu được sau khi tác dụng NaOH là Na+ (0,25 mol); SO42- (0,12 mol) và AlO2-
\(\xrightarrow{{BTDT}}2{n_{S{O_4}^{2 - }}} + {n_{Al{O_2}^ - }} = {n_{N{a^ + }}} \Rightarrow {n_{Al{O_2}^ - }} = 0,01\;mol\) (OH- đã phản ứng với Al3+ là 0,04 mol)
Ta có: \({m_{Cu,Fe}} + {m_{O{H^ - }}} = 7,63 \Rightarrow {m_{Cu,Fe}} = 7,63 - 17.(0,25 - 0,01.4) = 4,06\;(g)\)
\({n_S} + {n_{{H_2}S{O_4}}} = {n_{S{O_4}^{2 - }}} + {n_{S{O_2}}} \Rightarrow {n_S} = 0,04\;mol\). Vậy m = 4,06 + 0,01.27 + 0,04.32 = 5,61 (g)
X, Y là hai axit cacboxylic no, đơn chức mạch hở; Z là este tạo từ X và Y với etilenglycol. Đốt cháy hoàn toàn 35,4 gam hỗn hợp E gồm X, Y, Z bằng khí O2 thu được 31,36 lít khí CO2 (đktc) và 23,4 gam H2O. Mặt khác, cho 35,4 gam E tác dụng với 400 ml dung dịch NaOH 1M và KOH 0,5M, đun nóng. Sau phản ứng hoàn toàn, cô cạn dung dịch thu được m gam chất rắn khan. Giá trị của m?
Chọn B.
Khi đốt cháy hỗn hợp E thì \({n_{O(trong{\text{ E)}}}} = \frac{{{m_E} - 12{n_{C{O_2}}} - 2{n_{{H_2}O}}}}{{16}} = 1 \Rightarrow {n_{ - COO}} = 0,5\,mol\)
\(\left\{ \begin{gathered} {n_X} + {n_Y} + 2{n_Z} = {n_{ - COO}} \hfill \\ ({k_X} - 1){n_X} + ({k_Y} - 1){n_Y} + ({k_Z} - 1){n_Z} = {n_{C{O_2}}} - {n_{{H_2}O}} \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered} {n_X} + {n_Y} + 2{n_Z} = 0,05 \hfill \\ {n_Z} = 0,1 \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered} {n_X} + {n_Y} = 0,3\,mol \hfill \\ {n_Z} = 0,1\,mol \hfill \\ \end{gathered} \right.\)
Khi cho hỗn hợp E tác dụng với dung dịch hỗn hợp gồm NaOH và KOH thì
\(\xrightarrow{{BTKL}}{m_{{\text{ran}}}} = {m_E} + 40{n_{NaOH}} + 56{n_{KOH}} - 62{n_{{C_2}{H_4}{{(OH)}_2}}} - 18{n_{{H_2}O}} = 51\,(g)\)
Hòa tan hết 23,18 gam hỗn hợp X gồm Fe, Mg và Fe(NO3)3 vào dung dịch chứa 0,92 mol HCl và 0,01 mol NaNO3, thu được dung dịch Y (chất tan chỉ có 46,95 gam hỗn hợp muối) và 2,92 gam hỗn hợp Z gồm ba khí không màu (trong đó hai khí có số mol bằng nhau). Dung dịch Y phản ứng được tối đa với 0,91 mol KOH, thu được 29,18 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm thể tích của khí có phân tử khối lớn nhất trong Z?
Chọn A.
\(\xrightarrow{{BTKL}}{m_X} + {m_{HCl}} + {m_{NaN{O_3}}} = {m_Y} + {m_Z} + {m_{{H_2}O}} \Rightarrow {n_{{H_2}O}} = 0,43\;mol\)
Dung dịch Y chứa Fe2+ ; Fe3+ ; Mg2+ ; NH4+ ; Na+ (0,01) và Cl- (0,92).
Ta có: mion kim loại + \(18{n_{N{H_4}^ + }}\)= 46,95 – 0,01.23 – 0,92.35,5 = 14,06 (1)
Khi cho Y tác dụng với KOH thì: \({m_{ion\;kim\;loai}} + {m_{O{H^ - }}} = 29,18 \Rightarrow {m_{ion\;kim\;loai}} + 17.(0,91 - {n_{N{H_4}^ + }}) = 29,18\) (2)
Từ (1), (2) suy ra: mion kim loại = 13,88 (g) ; \({n_{N{H_4}^ + }} = 0,01\;mol \to {n_{N{O_3}\;(X)}} = \frac{{{m_X} - {m_{KL}}}}{{62}} = 0,15\;mol\)
\(\xrightarrow{{BT:\;H}}{n_{HCl}} = 4{n_{N{H_4}^ + }} + 2{n_{{H_2}}} + 2{n_{{H_2}O}} \Rightarrow {n_{{H_2}}} = 0,01\;mol\)
\(\xrightarrow{{BT:\;N}}{n_{N\;(X)}} + {n_{NaN{O_3}}} = {n_{N{H_4}^ + }} + {n_{N\;(Z)}} \Rightarrow {n_{N\;(Z)}} = 0,15\;mol\)
\(\xrightarrow{{BT:\;O}}{n_{O\;(X)}} + 3{n_{NaN{O_3}}} = {n_{O\;(Z)}} + {n_{{H_2}O}} \Rightarrow {n_{O\;(Z)}} = 0,05\;mol\)
Hỗn hợp Z gồm 3 khí: trong đó có H2) và N2O; N2 hoặc N2O; NO hoặc N2; NO.
Nhận thấy nN (Z) : nO (Z) = 3 : 1 Þ 3N và 1O Þ 2 khí đó là N2 và NO (có số mol bằng nhau = 0,05)
Vậy %V khí N2O = 45,45%.
Hỗn hợp E gồm chất X (CnH2n+1O4N) và Y (CmH2m+2O5N2) trong đó X không chứa chức este, Y là muối của α-amino axit với axit nitric. Cho m gam E tác dụng vừa đủ với 100 ml NaOH 1,2M đun nóng nhẹ, thấy thoát ra 0,672 lít (đktc) một amin bậc III (ở điều kiện thường là thể khí). Mặt khác, m gam E tác dụng với dung dịch HCl (dư), thu được hỗn hợp sản phẩm trong đó có 2,7 gam một axit cacboxylic. Giá trị của m là
Chọn A.
X là muối của axit cacboxylic với (CH3)3N Þ X có dạng là HOOC-R-COONH(CH3)3
Y là muối của α-amino axit no với axit nitric Þ Y có dạng là HOOC-R’-NH3NO3.
\(E\left\{ \begin{gathered} HOOCRCOONH{(C{H_3})_3} \hfill \\ HOOCR'N{H_3}N{O_3} \hfill \\ \end{gathered} \right.\xrightarrow{{ + \;NaOH}}\left\{ \begin{gathered} NaOOCRCOONa,\,NaOOCR'N{H_2} \hfill \\ \,NaN{O_3} \hfill \\ \end{gathered} \right. + \underbrace {{{(C{H_3})}_3}N}_{0,03\,mol}\)
Ta có: \({n_X} = {n_{{{(C{H_3})}_3}N}} = 0,03\;mol \to {n_Y} = \frac{{{n_{NaOH}} - 2{n_X}}}{2} = 0,03\;mol\)
PTHH: HOOC-R-COONH(CH3)3 + HCl (CH3)3NHCl + HOOC-R-COOH
Ta có: \({n_{HOOC - R - COOH}} = {n_{{{(C{H_3})}_3}N}} = {n_{HCl}} = 0,03\;mol \Rightarrow {M_{HOOC - R - COOH}} = \frac{{2,7}}{{0,03}} = 90\;(R = 0)\)
Vậy X là HOOC-COONH(CH3)3 và Y là HOOC-C4H8-NH3NO3
mE= 9,87 gam
Trong quá trình bảo quản, một mẫu muối FeSO4.7H2O (có khối lượng m gam) bị oxi hóa bởi oxi không khí tạo thành hỗn hợp X chứa các hợp chất của Fe(II) và Fe(III). Hòa tan toàn bộ X trong dung dịch loãng chứa 0,025 mol H2SO4, thu được 100 ml dung dịch Y. Tiến hành hai thí nghiệm với Y:
Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 20 ml dung dịch Y, thu được 2,33 gam kết tủa.
Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 20 ml dung dịch Y, thu được dung dịch Z. Nhỏ từ từ dung dịch KMnO4 0,1M vào Z đến khi phản ứng vừa đủ thì hết 8,6 ml.
Giá trị của m và phần trăm số mol Fe(II) đã bị oxi hóa trong không khí lần lượt là
Chọn D.
Thí nghiệm 1: Cho 20 ml Y vào BaCl2 thì: \({n_{S{O_4}^{2 - }}} = {n_ \downarrow } = 0,01\;mol\)
\(\xrightarrow{{BT:\;S}}{n_{FeS{O_4}.7H_2^{}O}} = {n_{S{O_4}^{2 - }}} - {n_{{H_2}S{O_4}}} = 0,05 - 0,025 = 0,025\;mol \Rightarrow {m_{FeS{O_4}.7H_2^{}O}} = 6,95\;(g)\)
Thí nghiệm 2: Cho KMnO4 (8,6.10-4 mol) vào Y thì \(\xrightarrow{{BT:\;e}}{n_{F{e^{2 + }}}} = 5{n_{KMn{O_4}}} = {4,3.10^{ - 3}}\;mol\)
Trong không khí, Fe2+ bị oxi hoá thành Fe3+ với số mol tương ứng là 0,025 – 0,0215 = 3,5.10-3 mol
Vậy \(\% {n_{F{e^{2 + }}}} = \frac{{{{3,5.10}^{ - 3}}}}{{0,025}}.100\% = 14\% \)
Khí CO2 được coi là chất gây ô nhiễm, chủ yếu là vì
CO2 được coi là chất gây ô nhiễm, chủ yếu là vì nó là nguyên nhân chính gây hiệu ứng nhà kính.
Đáp án B
Xà phòng hóa chất nào sau đây thu được glixerol?
Metyl axetat là CH3COOCH3: CH3COOCH3 + NaOH → CH3COONa + CH3OH
Benzyl axetat là CH3COOC6H5: CH3COOCH3 + 2NaOH → CH3COONa + C6H5ONa + H2O
Etyl axetat là CH3COOC2H5: CH3COOC2H5 + NaOH →CH3COONa + C2H5OH
Tristearin là(C17H35COO)3C3H5: (C17H35COO)3C3H5 + 3NaOH → 3C17H35COONa + C3H5(OH)3
Xà phòng hóa tristearin thu được glixerol C3H5(OH)3
Đáp án D
Cho dãy các kim loại: Al, Cu, Fe, Ag, Na, Ba. Số kim loại trong dãy phản ứng được với dung dịch H2SO4 loãng
Những kim loại phản ứng được với H2SO4 loãng là Al, Fe, Na, Ba = 4 kim loại
Đáp án D
Kim loại nào sau đây tác dụng với H2O ngay ở nhiệt độ thường?
Kim loại tác dụng với H2O ngay ở nhiệt độ thường là K.
PTHH: 2K + 2H2O → 2KOH + H2
Đáp án A
Cho hỗn hợp gồm Fe và Mg vào dung dịch AgNO3, khi các phản ứng xảy ra hoàn toàn | thu được dung dịch X (gồm hai muối) và chất rắn Y (gồm hai kim loại). Hai muối trong X ?
Thứ tự phản ứng là Mg + 2AgNO3 → Mg(NO3)2 + 2Ag
Fe +2AgNO3 → Fe(NO3)2 + 2Ag
Nếu AgNO3 dư thì AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag
X có 2 muối và rắn Y có 2 kim loại nên Y có Ag và Fe dư; dung dịch X chứa Mg(NO3)2 và Fe(NO3)2 Đáp án A
Cho các chất sau: glucozơ, fructozơ, saccarozơ, tinh bột, xenlulozơ. Số chất hòa tan Cu(OH)2 tạo thành dung dịch màu xanh ?
Những chất hòa tan Cu(OH)2 tạo thành dung dịch màu xanh là: glucozơ, fructozơ, saccarozơ = 3 chất
Đáp án B
Cặp chất nào sau đây không tồn tại trong cùng một dung dịch?
A có H2SO4 không phản ứng với Cu(NO3)2 nên cùng tồn tại
B có FeCl3 không phản ứng với KNO3 nên cùng tồn tại
C có NaOH không phản ứng với NaNO3 nên cùng tồn tại
D không cùng tồn tại trong một dung dịch do có phản ứng: CuCl2 + 2NaOH2 →Cu(OH)2 + 2NaCl
Đáp án D
Dung dịch nào sau đây có pH < 7?
Dung dịch có pH < 7 là NaHSO4 do là muối axit. Muối này có khả năng phản ứng như axit sunfuric CH3COONa có pH >7
Na2CO3 có pH >7
KCl có pH=7
Đáp án C
Cho 2,74 gam Ba vào 1 lít dung dịch CuSO4 0,02M. Sau khi các phản ứng xảy ra hoàn toàn, thu được khối lượng kết tủa là:
nBa = 0,02 mol và nCuSO4 = 0,02 mol
PTHH:
Ba + H2O → Ba(OH)2
0,02 → 0,02 mol
CuSO4 + Ba(OH)2 → Cu(OH)2 + BaSO4
Trước 0,02 0,02 mol
Sau 0 0 0,02 0,02 mol
mkết tủa = mBaSO4 + mCu(OH)2 = 0,02.233+0,02.98 = 6,62 gam

.JPG)
