Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Võ Nguyên Giáp
Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Võ Nguyên Giáp
-
Hocon247
-
40 câu hỏi
-
90 phút
-
31 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Đốt cháy hoàn toàn 1,08 gam Al bằng lượng dư khí O2, thu được m gam chất rắn. Giá trị của m là
Đáp án D
PTHH: 4Al + 3O2 2Al2O3
Theo PTHH ⟹ nAl2O3 = nAl/2 = 0,02 (mol)
Vậy m = mAl2O3 = 2,04 g.
Thí nghiệm nào dưới đây không xảy ra phản ứng?
Thí nghiệm không xảy ra phản ứng: Cho Fe tác dụng với dung dịch ZnCl2.
Để khử mùi tanh của cá (gây ra do một số amin) ta có thể rửa cá với
Để khử mùi tanh của cá (gây ra do một số amin) ta có thể rửa cá với giấm
Kim loại nào sau đây có nhiệt độ nóng chảy cao nhất, được sử dụng làm dây tóc bóng đèn?
Kim loại W có nhiệt độ nóng chảy cao nhất, được sử dụng làm dây tóc bóng đèn
Glucozơ không tham gia phản ứng nào sau đây?
Glucozơ không tham gia phản ứng thủy phân
Một số cơ sở sản xuất thực phẩm thiếu lương tâm đã dùng fomon (dung dịch nước của fomanđehit) để bảo quản bún, phở. Công thức hóa học của fomanđehit là
Công thức hóa học của fomanđehit là HCHO
Polime thiên nhiên X màu trắng, dạng sợi, không tan trong nước, có nhiều trong thân cây đay, gai, tre, nứa... Polime X là
Polime X là xenlulozơ.
Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hiđro để điều chế 17 gam NH3? Biết rằng hiệu suất chuyển hóa thành amoniac là 25%. Các thể tích khí đo được ở đktc.
PTHH: N2 + 3H2 ⇄ 2NH3
0,5 1,5 ← 1 (mol)
Theo PTHH ⟹ nN2(LT) = 0,5 (mol) và nH2(LT) = 1,5 (mol)
Do H = 25% ⟹ nN2(TT) = 0,5/25% = 2 (mol) ⟹ VN2 = 44,8 (lít).
Do H = 25% ⟹ nH2(TT) = 1,5/25% = 6 (mol) ⟹ VH2 = 134,4 (lít).
Ở nhiệt độ thường, khí nitơ khá trơ về mặt hóa học. Nguyên nhân là do
Ở nhiệt độ thường, khí nitơ khá trơ về mặt hóa học. Nguyên nhân là do nguyên tử nitơ có độ âm điện kém hơn oxi.
Chất X có công thức cấu tạo CH3COOCH3. Tên gọi của X là
Chất X có công thức cấu tạo CH3COOCH3. Tên gọi của X là metyl axetat.
Cho dung dịch chứa 3,6 gam hỗn hợp glucozơ và fructozơ phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3 thu được m gam bạc. Khối lượng bạc sinh ra là
Đáp án B
Glucozơ và fructozơ có cùng công thức phân tử là C6H12O6
⟹ nhh = 3,6/180 = 0,02 (mol)
Glucozơ 2Ag
Fructozơ 2Ag
Theo PTHH ⟹ nAg = 2(nGlucozơ + nFructozơ) = 2nhh = 0,04 (mol)
Vậy mAg = 0,04.108 = 4,32 (g).
Các hình vẽ sau mô tả các cách thu khí, thường được sử dụng khi điều chế và thu khí trong phòng thí nghiệm:
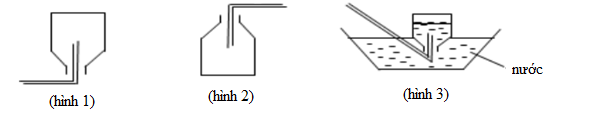
Hình 3 có thể dùng để thu được những khí nào trong các khí sau: H2, C2H2, NH3, SO2 , HCl, N2?
Hình 3 có thể dùng để thu được H2, N2, C2H2.
Cho 4,5 gam amin X đơn chức, bậc 1 tác dụng với lượng vừa đủ dung dịch HCl thu được 8,15 gam muối. Tên gọi của X là
Đáp án A
Gọi công thức của amin X là R – NH2
PTHH: R – NH2 + HCl → R – NH3Cl
Bảo toàn khối lượng ⟹ mX + mHCl = mmuối
⟹ mHCl = 3,65 (g) ⟹ nHCl = 0,1 (mol).
Theo PTHH ⟹ nX = nHCl = 0,1 (mol).
⟹ MX = MR + 16 = 45
⟹ MR = 29 (C2H5).
Vậy X là C2H5NH2 (etyl amin).
Hòa tan hoàn toàn m gam Cu trong dung dịch HNO3 loãng dư, sau khi phản ứng xảy ra hoàn toàn thấy thu được 672 ml khí NO (sản phẩm khử duy nhất, ở điều kiện chuẩn). Giá trị của m là
Đáp án D
PTHH: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Theo PTHH ⟹ nCu = 1,5.nNO = 0,045 (mol)
Vậy m = mCu = 2,88 g.
Chất nào trong số các chất dưới đây là chất điện li?
CaCO3 là chất điện li
Nhận định nào sau đây đúng?
Chất béo không thuộc hợp chất este.
Nung nóng 16,8 gam hỗn hợp Ag, Cu, Fe, Zn với một lượng dư khí O2, đến khi các phản ứng xảy ra hoàn toàn, thu được 23,2 gam chất rắn X. Thể tích dung dịch HCl 1M vừa đủ để phản ứng với chất rắn X là
Đáp án D
KL + O2 → Oxit
Bảo toàn khối lượng ⟹ mO2 = moxit – mKL = 6,4 gam.
⟹ nO2 = 0,2 (mol).
Oxit + HCl → Muối + H2O
Bảo toàn nguyên tố O ⟹ nO = 2nO2 = nO(oxit) = nH2O = 0,4 (mol)
Bảo toàn nguyên tố H ⟹ nH = nHCl = 2nH2O = 0,8 (mol)
Vậy VHCl = n/CM = 0,8 lít = 800 ml
Cho các chất gồm: tơ tằm, tơ visco, tơ axetat, tơ lapsan (poli(etylen-terephtalat). Số chất thuộc loại tơ nhân tạo là
Đáp án A
Các chất thuộc loại tơ nhân tạo là tơ visco và tơ axetat.
Chất nào sau đây không hòa tan Cu(OH)2 ở nhiệt độ thường?
Đáp án B
Tinh bột không hòa tan Cu(OH)2 ở nhiệt độ thường.
Chất nào sau đây vừa tác dụng được với H2NCH2COOH vừa tác dụng với CH3NH2?
Đáp án C
Chất vừa tác dụng với H2NCH2COOH vừa tác dụng với CH3NH2 là HCl.
Chất nào sau đây có đồng phân hình học?
Điều kiện để có đồng phân hình học
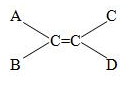
Chất trên có đồng phân hình học khi A ≠B và C ≠D.
CH3 – CH = CH – CH2 – CH3 có đồng phân hình học.
Cho phản ứng hoá học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng xảy ra
Đáp án C
Fe là chất khử và CuSO4 là chất oxi hóa.
Vậy trong phản ứng xảy ra sự oxi hoá Fe và sự khử Cu2+
Đốt cháy hoàn toàn một hiđrocacbon X thu được 0,11 mol CO2 và 0,132 mol H2O. Khi X tác dụng với khí clo (theo tỉ lệ số mol 1 : 1) thu được một sản phẩm hữu cơ duy nhất. Tên gọi của X là
Đáp án A
Đốt cháy hiđrocacbon X thu được nCO2 < nH2O
⟹ X là ankan.
Gọi công thức phân tử của X là CnH2n+2 (n ≥ 1)
Ta có nX = nH2O – nCO2 = 0,132 – 0,11 = 0,022 (mol)
Bảo toàn nguyên tố C ⟹
⟹ CTPT của X là C5H12.
Khi X tác dụng với khí clo (theo tỉ lệ số mol 1 : 1) thu được một sản phẩm hữu cơ duy nhất
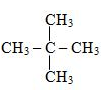 (CTCT của X)
(CTCT của X)
Vậy tên gọi của X là 2,2-đimetylpropan.
Cho các phát biểu sau:
(a) Độ dinh dưỡng của phân đạm được đánh giá theo phần trăm khối lượng nguyên tố nitơ.
(b) Fe2O3 phản ứng với axit HCl sẽ tạo ra 2 muối.
(c) Kim cương được dùng làm đồ trang sức, chế tạo mũi khoan, dao cắt thủy tinh.
(d) Amoniac được sử dụng để sản xuất axit nitric, phân đạm.
(e) Tính chất hóa học chung của kim loại là tính oxi hóa.
Số phát biểu đúng là
Đáp án C
(a), (c), (d) đúng.
(b) sai vì Fe2O3 phản ứng với axit HCl chỉ tạo một muối FeCl3.
(e) sai vì tính chất hóa học chung của kim loại là tính khử.
Hòa tan hết m gam P2O5 vào 400 gam dung dịch KOH 10% dư, sau phản ứng hoàn toàn cô cạn dung dịch thu được 3,5m gam chất rắn. Giá trị nào sau đây gần nhất với giá trị của m?
Đáp án C
nKOH = (400.10%)/56 = 5/7 (mol)
Gọi số mol P2O5 là x = m/142 (mol) (1)
Bảo toàn nguyên tố P => nH3PO4 = 2nP2O5 = 2x
3KOH + H3PO4 → K3PO4 + 3H2O
3x 2x → 2x
Dung dịch sau phản ứng gồm KOH dư (5/7 – 6x) mol và K3PO4 2x mol.
=> 3,5m = 56.(5/7-6x)+2x.212 (2)
Từ (1) và (2) => m = 13, 89
“Hiệu ứng nhà kính” là hiện tượng làm cho trái đất nóng dần lên, do các bức xạ bị giữ lại mà không thoát ra ngoài. Nguyên nhân chính gây ra hiệu ứng nhà kính là do sự gia tăng nồng độ của khí X trong không khí. Khí X là
Khí X là CO2
Đốt cháy hoàn toàn 2 amin no, đơn chức đồng đẳng liên tiếp, thu được hỗn hợp gồm khí và hơi, trong đó tỉ lệ VCO2 : VH2O = 8 : 17. Công thức của 2 amin là
CH3NH2 và C2H5NH2.
Cho hỗn hợp kim loại Mg, Zn, Fe vào dung dịch chứa AgNO3 và Cu(NO3)2. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch X gồm 3 muối và chất rắn Y gồm 3 kim loại. Ba muối trong X là
Mg + AgNO3 → Mg(NO3)2 + Ag (Mg hết)
Zn + AgNO3 → Zn(NO3)2 + Ag (AgNO3 hết)
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu (Zn hết)
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu (Cu(NO3)2 hết)
Vậy sau phản ứng dung dịch X gồm 3 muối là Mg(NO3)2, Zn(NO3)2, Fe(NO3)2 và Y gồm 3 kim loại là Ag, Cu và Fe.
Trong phòng thí nghiệm, etyl axetat được điều chế theo các bước:
Bước 1: Cho 1 ml ancol etylic, 1 ml axit axetic nguyên chất và 1 giọt axit sunfuric đặc vào ống nghiệm.
Bước 2: Lắc đều, đồng thời đun cách thủy 5 - 6 phút trong nồi nước nóng 65 - 70°C.
Bước 3: Làm lạnh rồi rót thêm vào ống nghiệm 2 ml dung dịch NaCl bão hòa.
Cho các phát biểu sau:
(a) Có thể thay dung dịch axit sunfuric đặc bằng dung dịch axit sunfuric loãng.
(b) Để kiểm soát nhiệt độ trong quá trình đun nóng có thể dùng nhiệt kế.
(c) Dung dịch NaCl bão hòa được thêm vào ống nghiệm để phản ứng đạt hiệu suất cao hơn.
(d) Có thể thay dung dịch NaCl bão hòa bằng dung dịch HCl bão hòa.
(e) Để hiệu suất phản ứng cao hơn nên dùng dung dịch axit axetic 15%.
Số phát biểu đúng là
Đáp án A
(a) sai, H2SO4 đặc là chất háo nước có tác dụng hút nước để phản ứng este hóa chuyển dịch theo
chiều thuận, khi đó hiệu suất điều chế este sẽ cao hơn; dùng H2SO4 loãng vừa không có tác dụng hút nước mà còn có thể làm este bị thủy phân.
(b) đúng.
(c) đúng, NaCl bão hòa có tác dụng làm tăng khối lượng riêng của lớp chất lỏng phía dưới khiến cho este dễ dàng nổi lên hơn.
(d) sai, thay NaCl bão hòa bằng HCl bão hòa khiến cho este bị thủy phân.
(e) sai, để hiệu suất cao ta nên sử dụng CH3COOH nguyên chất.
Vậy có 2 phát biểu đúng.
Cho 4,825 gam hỗn hợp bột Al và Fe (có tỉ lệ mol nAl : nFe = 3 : 2) vào 350 ml dung dịch AgNO3 1M. Khuấy kĩ cho phản ứng xảy ra hoàn toàn, thu được m gam chất rắn. Giá trị của m là
Đáp án A
Đặt số mol của Al và Fe lần lượt là 3x và 2x => mhỗn hợp = 3x.27 + 2x.56 = 4,825 ⟹ x = 0,025
⟹ nAl = 0,075 mol; nFe = 0,05 mol
Al + 3Ag+ → Al3+ + 3Ag
0,075 → 0,225 → 0,225 (mol)
Fe + 2Ag+ → Fe2+ + 2Ag
0,05 → 0,1 → 0,1 → 0,1 (mol)
nAg+còn lại = 0,35 - 0,225 - 0,1 = 0,025 mol
Fe2+ + Ag+ → Fe3+ + Ag
0,025 ← 0,025 → 0,025 (mol)
mchất rắn = mAg = 108.(0,225 + 0,1 + 0,025) = 37,8 gam.
Hòa tan hoàn toàn 216,55 gam hỗn hợp KHSO4, và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO, Al2O3 (trong đó mO = 64/205.mY) tan hết vào X. Sau khi các phản ứng kết thúc, thu được dung dịch Z chỉ chứa muối trung hòa và 2,016 lít (đktc) hỗn hợp khí T có tổng khối lượng 1,84 gam (trong đó H2 chiếm 4/9 về thể tích và nguyên tố oxi chiếm 8/23 khối lượng hỗn hợp). Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m là
m = 20,5 gam
Đáp án A
Hỗn hợp chất rắn X gồm Ba(HCO3)2, KOH và Ba(OH)2 có tỉ lệ số mol lần lượt là 1 : 2 : 1. Cho hỗn hợp X vào bình đựng nước dư, sau khi các phản ứng xảy ra hoàn toàn, chất còn lại trong bình (không kể H2O) là
Giả sử số mol Ba(HCO3)2, KOH, Ba(OH)2 lần lượt là 1; 2; 1 (mol)
HCO3- + OH- → CO32- + H2O
2 2 2
Ba2+ + CO32- → BaCO3
2 2 2
Vậy sau phản ứng còn K+(2 mol) và OH- (2 mol) ⟹ chất tan là KOH.
Cho các nhận định sau:
(1) Kim loại mềm nhất là K, Rb, Cs (có thể dùng dao cắt được).
(2) Độ dẫn điện của nhôm (Al) tốt hơn của đồng (Cu).
(3) Những kim loại có độ dẫn điện tốt thì cũng dẫn nhiệt tốt.
(4) Crom (Cr) là kim loại cứng nhất trong các kim loạ
Đáp án C
(1) đúng.
(2) đúng.
(3) đúng.
(4) đúng.
(5) sai, vì Na sẽ phản ứng với H2O trong dung dịch Cu2+ trước.
2Na + 2H2O → 2Na+ + 2OH- + H2
Cu2+ + 2OH- → Cu(OH)2 ↓
Vậy có 4 nhận định đúng.
Cho các phát biểu sau:
(a) Chất béo là trieste của glixerol với axit béo.
(b) Bột ngọt là muối đinatri của axit glutamic.
(c) Glucozơ thuộc loại monosaccarit.
(d) Các este bị thủy phân trong môi trường kiềm đều tạo muối và ancol.
(e) Tất cả các peptit đều có phản ứng với Cu(OH)2 tạo hợp chất có màu tím.
(g) Dung dịch saccarozơ không tham gia phản ứng tráng bạc.
Số phát biểu đúng là
Đáp án B
(a) đúng.
(b) sai, bột ngọt là muối mononatri của axit glutamic.
(c) đúng.
(d) sai, este khi thủy phân trong môi trường kiềm tạo muối của axit cacboxylic và có thể tạo các chất khác ngoài ancol như: muối của phenol, anđehit, xeton, …
(e) sai, đipeptit không có phản ứng màu biure.
(g) đúng.
Vậy có 3 phát biểu đúng
Thủy phân hoàn toàn một este hai chức, mạch hở E có công thức C7H10O4 bằng dung dịch NaOH thu được 2 muối X, Y (MX < MY) của axit cacboxylic no, đơn chức và ancol Z. Cho các nhận xét sau:
(1) E có 4 đồng phân cấu tạo.
(2) Z có khả năng làm mất màu dung dịch Br2.
(3) Z hòa tan được Cu(OH)2 ở điều kiện thường.
(4) X không có phản ứng tráng gương.
(5) Muối Y có công thức phân tử C2H3O2Na.
Số phát biểu đúng là
Có 3 phát biểu đúng
Hỗn hợp A gồm 3 este đơn chức, mạch hở tạo thành từ cùng một ancol B với 3 axit cacboxylic (phân tử chỉ có nhóm -COOH), trong đó có hai axit no và một axit không no (chứa một liên kết đôi C=C trong phân tử). Thủy phân hoàn toàn 4,5 gam A bằng dung dịch NaOH thu được hỗn hợp muối và m gam ancol B. Cho m gam ancol B vào bình đựng Na dư sau phản ứng thu được 0,56 lít khí (đktc) và khối lượng bình tăng 2,25 gam. Mặt khác, nếu đốt cháy hoàn toàn 9 gam A thì thu được CO2 và 6,84 gam H2O. Phần trăm số mol của este không no trong A là
Đáp án C
Do este đơn chức nên ancol đơn chức
→ nancol =2.nH2 = 0,05 mol
Mà mbình tăng = mancol - mH2
→ mancol = 2,25 + 0,025.2 = 2,3 gam
- Mancol = 2,3 : 0,05 = 46 (C2H5OH)
Thủy phân 4,5 gam A thì: nA = nC2H5OH = 0,05 mol
Tỉ lệ: 4,5 gam A tương ứng với 0,05 mol
9 gam …………………. 0,1 mol
Đốt 9 gam A thu được 0,38 mol H2O:
Đặt nO2 = x và nCO2 = y (mol)
+) BTKL → mA + mO2 = mCO2 + mH2O → 9 + 32x = 44y + 6,84 (1)
+) Bảo toàn O → 2nA + 2nO2 = 2nCO2 + nH2O → 2.0,1 + 2x = 2y + 0,38 (2)
Giải hệ được x = 0,51 và y = 0,42
Đốt este no thì thu được mol CO2 bằng số mol H2O nên sự chênh lệch số mol của CO2 và H2O là do este không no
→ neste không no = nCO2 - nH2O = 0,42 - 0,38 = 0,04 mol
→ %neste không no = 0,04/0,1.100 = 40%
Cho 0,3 mol hỗn hợp X gồm hai este đơn chức tác dụng vừa đủ với 250 ml dung dịch KOH 2M, thu được chất hữu cơ Y (no, đơn chức, mạch hở, có tham gia phản ứng tráng bạc) và 53 gam hỗn hợp muối. Đốt cháy toàn bộ Y cần vừa đủ 5,6 lít khí O2 (đktc). Khối lượng của 0,3 mol X là
Khối lượng của 0,3 mol X là 33,0 gam.
Cho hỗn hợp X gồm muối A (C5H16O3N2) và B (C4H12O4N2) tác dụng với một lượng dung dịch NaOH vừa đủ, đun nóng đến khi phản ứng xảy ra hoàn toàn rồi cô cạn thu được m gam hỗn hợp Y gồm hai muối D và E. (MD < ME) và 4,48 lít hỗn hợp X gồm hai amin no, đơn chức đồng đẳng kế tiếp có tỉ khối hơi đối với H2 là 18,3. Khối lượng của muối E trong hỗn hợp Y là
Khối lượng của muối E trong hỗn hợp Y là 8,04 gam.

