Đề thi thử tốt nghiệp THPT QG môn Hóa năm 2020 - Trường THPT Lê Hữu Trác
Đề thi thử tốt nghiệp THPT QG môn Hóa năm 2020 - Trường THPT Lê Hữu Trác
-
Hocon247
-
40 câu hỏi
-
90 phút
-
36 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Trong số các tơ sau: tơ tằm, tơ visco, tơ nilon–6,6, tơ axetat, tơ capron, tơ olon, những tơ nào thuộc loại tơ nhân tạo?
Đáp án D
Chất X (C4H8O2) tác dụng với dung dịch NaOH, thu được hai chất hữu cơ Y và Z. Oxi hóa Z bằng CuO, thu được anđehit E. Cho E phản ứng hết với lượng dư dung dịch AgNO3 trong NH3 đun nóng, sản phẩm của phản ứng chỉ là các chất vô cơ. Công thức cấu tạo của X là
Chất X (C4H8O2) tác dụng với dung dịch NaOH, thu được hai chất hữu cơ Y và Z. Oxi hóa Z bằng CuO, thu được anđehit E. Cho E phản ứng hết với lượng dư dung dịch AgNO3 trong NH3 đun nóng, sản phẩm của phản ứng chỉ là các chất vô cơ. Công thức cấu tạo của X là CH3CH2COOCH3
Khí nào sau đây gây hiện tượng mưa axit?
Khí gây hiện tượng mưa axit là SO2
Đốt cháy hoàn toàn m gam hỗn hợp gồm glucozơ và saccarozơ thu được 0,32 mol CO2 và 0,3 mol H2O. Giá trị của m là
Đáp án A
Khử hoàn toàn một lượng Fe3O4 bằng H2 dư, thu được chất rắn X và m gam H2O. Hòa tan hết X trong dung dịch HCl dư, thu được 1,008 lít khí H2 (đktc). Giá trị của m là
Fe3O4 + 4H2 → 3Fe + 4H2O
0,045 0,06
Fe + 2HCl → FeCl2 + H2
0,045 0,045
→ mH2O = 0,06.18 = 1,08g
Kim loại sắt khi tác dụng với chất nào (lấy dư) sau đây tạo muối sắt(III)?
Đáp án D
Trong các chất dưới đây, chất nào là amin bậc hai?
Trong các chất dưới đây, chất nào là amin bậc hai CH3NHCH3
Kim loại tan hoàn toàn trong nước (dư) ở nhiệt độ thường là
Kim loại tan hoàn toàn trong nước (dư) ở nhiệt độ thường là K
Đáp án C
Công thức hóa học của sắt(III) oxit là
Công thức hóa học của sắt(III) oxit là Fe2O3
Cho các kim loại Fe, Cu, Ag và Zn. Số kim loại tan được trong dung dịch Fe(NO3)3 dư là
Cho các kim loại Fe, Cu, Ag và Zn. Số kim loại tan được trong dung dịch Fe(NO3)3 dư là 3
Đáp án B
Hòa tan hoàn toàn a mol hỗn hợp gồm Na, Al vào nước, thu được dung dịch chỉ chứa một chất tan và V lít khí H2 (đktc). Giá trị của V là
Đáp án C
Cacbohiđrat X dạng sợi màu trắng, không tan trong nước. Tên gọi của X là
Cacbohiđrat X dạng sợi màu trắng, không tan trong nước. Tên gọi của X là xenlulozơ
Este nào sau đây có công thức phân tử C4H8O2?
Etyl axetat sau đây có công thức phân tử C4H8O2
Ở trạng thái cơ bản, số electron hóa trị của Al (Z = 13) là
Ở trạng thái cơ bản, số electron hóa trị của Al (Z = 13) là 3
Trong các chất sau, chất có nhiệt độ nóng chảy cao nhất là
Trong các chất sau, chất có nhiệt độ nóng chảy cao nhất là H2NCH2COOH
Cho 0,1 mol Ala-Gly tác dụng hết với 300 ml dung dịch KOH 1M. Cô cạn dung dịch sau phản ứng được m gam chất rắn. Giá trị của m là
Ala – Gly + 2KOH → Ala-K + Gly-K + H2O
Mol 0,1 → 0,2 → 0,1 → 0,1
→ nKOH dư = 0,3 – 0,2 = 0,1 mol
mrắn = mAla-K + mGly-K + mKOH dư = 127.0,1 + 113.0,1 + 56.0,1 = 29,6g
Đáp án cần chọn là: A
Thạch cao nung có công thức hóa học là
Thạch cao nung có công thức hóa học là CaSO4.H2O
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng, dư, thu được dung dịch X. Dung dịch X tác dụng với chất nào sau đây không xảy ra phản ứng oxi hóa khử?
Dung dịch X là NaOH
Bộ dụng cụ chiết được mô tả như hình vẽ sau đây:
.png)
Dụng cụ trên dùng để tách hai chất lỏng nào sau đây?
Dụng cụ trên dùng để tách Triolein và nước cất.
Cắt một miếng sắt tây (sắt tráng thiếc), để trong không khí ẩm thì
Cắt một miếng sắt tây (sắt tráng thiếc), để trong không khí ẩm thì Fe bị oxi hóa.
Cho các chất sau đây: CuO, O2, dung dịch Ca(OH)2, FeO. Số chất tác dụng được với khí CO ở nhiệt độ cao là
Chọn C.
Chất tác dụng được với khí CO ở nhiệt độ cao là CuO, O2, FeO.
Nhỏ rất từ từ dung dịch Ba(OH)2 1M vào dung dịch X gồm Al2(SO4)3, K2SO4 và lắc nhẹ để các phản ứng xảy ra hoàn toàn. Khối lượng kết tủa thu được (y gam) phụ thuộc vào thể tích dung dịch (x lít) Ba(OH)2 1M được biểu diễn bằng đồ thị như hình vẽ sau:
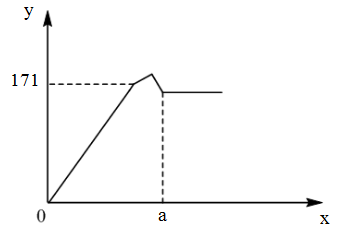
Giá trị của a là
Chọn C.
Đặt x, y lần lượt là số mol của Al2(SO4)3, K2SO4.
Tại y = 171 (g) → 2x.78 + 3x.233 = 171 → x = 0,2. Vậy a = 4.x = 0,8
Khi làm thí nghiệm với các chất X, Y, Z và T trong dung dịch nước, thu được bằng ghi lại hiện tượng sau:
Đáp án B
Cho các phát biểu sau:
(a) Dầu chuối (chất tạo hương liệu mùi chuối chín) có chứa isoamyl axetat.
(b) Thủy tinh hữu cơ được ứng dụng làm cửa kính phương tiện giao thông.
(c) Glucozơ có vị ngọt thấy đầu lưỡi mát lạnh do xảy ra phản ứng lên men rượu.
(d) Nhỏ dung dịch I2 vào lát cắt của củ khoai lang thì xuất hiện màu xanh tím.
(e) Nicotin là một amin độc, có trong thuốc lá.
(f) Sau khi lưu hóa cao su chịu nhiệt và đàn hồi tốt hơn.
Số phát biểu đúng là
Chọn B.
(c) Sai, Vì glucozơ tạo một dung dịch đường trên lưỡi, sự phân bố các phân tử đường trong quá trình hòa tan là quá trình thu nhiệt, do đó ta cảm thấy đầu lưỡi mát lạnh.
Đốt cháy hoàn toàn m gam một triglixerit X cần vừa đủ 1,54 mol O2, thu được CO2 và 1 mol H2O. Nếu thủy phân hoàn toàn m gam X trong dung dịch KOH đun nóng thu được dung dịch chứa 18,64 gam muối. Để chuyển hóa a mol X thành chất béo no cần vừa đủ 0,06 mol H2 (Ni, t°). Giá trị của a là
Chọn B.
Ta có: \(\left\{ \begin{array}{l}
6{n_X} + 1,54.2 = 2{n_{C{O_2}}} + 1\\
m + 49,28 = 44{n_{C{O_2}}} + 18\\
m + 3{n_X}.56 = 18,64 + 92{n_X}
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
{n_X} = 0,02\;mol\\
{n_{C{O_2}}} = 1,1\;mol\\
m = 17,12\;(g)
\end{array} \right. \Rightarrow k = 6\;\)
(có 3π gốc H.C)
Khi cho X tác dụng với H2 thì a = 0,02 mol
Hỗn hợp X gồm C2H4, C2H2, C3H8, C4H10. Lấy 6,32 gam X cho qua bình đựng dung dịch nước Br2 (dư) thấy có 0,12 mol Br2 tham gia phản ứng. Mặt khác, đốt cháy hết 2,24 lít X (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được 9,68 gam CO2. Biết các phản ứng hoàn toàn. Giá trị của V là
Chọn C.
Đặt CTTQ của X là CnH2n + 2 – 2k (a mol).
Khi cho X tác dụng Br2 thì: (14n + 2 – 2k).a = 6,32 (1) và (2)
Khi đốt cháy X thì: \(\frac{{{n_X}}}{{{n_{C{O_2}}}}} = \frac{a}{{an}} = \frac{{0,1}}{{0,22}} \Rightarrow n = 2,2\) . Thay vào n vào (1), (2) suy ra: a = 0,2 và k = 0,6
Trong 0,1 mol X có: \({n_{{O_2}}} = 3,5.0,1 = 0,35\;mol \Rightarrow {V_{{O_2}}} = 7,84\;(l)\)
Hấp thụ hết 4,48 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3, thu được 200 ml dung dịch X. Cho từ từ đến hết 100 ml dung dịch X vào 300 ml dung dịch HCl 0,5M, thu được 2,688 lít khí (đktc). Mặt khác, cho 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, thu được 39,4 gam kết tủa. Giá trị của x là
Chọn B.
Khi cho X vào HCl thì:
\(\left\{ \begin{array}{l}
{n_{HC{O_3}^ - }} + 2{n_{C{O_3}^{2 - }}} = {n_{{H^ + }}} = 0,3\\
{n_{HC{O_3}^ - }} + {n_{C{O_3}^{2 - }}} = 0,24
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
{n_{HC{O_3}^ - }} = 0,18\;mol\\
{n_{C{O_3}^{2 - }}} = 0,06\;mol
\end{array} \right. \Rightarrow \frac{{{n_{HC{O_3}^ - }}}}{{{n_{C{O_3}^{2 - }}}}} = 3\)
Khi cho X vào Ba(OH)2 dư thì:
\({n_{HC{O_3}^ - }} + {n_{C{O_3}^{2 - }}} = {n_{BaC{O_3}}} = 0,4 \Rightarrow \left\{ \begin{array}{l}
{n_{HC{O_3}^ - }} = 0,3\;mol\\
{n_{C{O_3}^{2 - }}} = 0,1\;mol
\end{array} \right.\)
Trong 250ml dung dịch Y chứa CO32– (0,1 mol), HCO3– (0,3 mol), K+ (x + 2y mol).
\( \to 0,2 + y = 0,4 \Rightarrow y = 0,2 \to x = 0,1\)
Cho các sơ đồ phản ứng sau:
\(X{\rm{ }}\left( {{C_8}{H_{14}}{O_4}} \right) + 2NaOH \to {X_1} + {X_2} + {H_2}O\)
\({X_1} + {H_2}S{O_4} \to {X_3} + N{a_2}S{O_4}\)
\(n{X_5} + n{X_3} \to \) poli(hexametylen ađipamit) + 2nH2O
\(2{X_2} + {X_3} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {X_6} + 2{H_2}O\)
Phân tử khối của X6 là
Chọn C.
HOOC-(CH2)4-COOH (X3) + H2N-(CH2)6-NH2 (X5) → poli(hexametylen ađipamit) + 2nH2O.
NaOOC-(CH2)4-COONa (X1) + H2SO4 → HOOC-(CH2)4-COOH (X3) + Na2SO4.
CH3OH (X1) + CO → CH3COOH (X5).
C2H5OOC-(CH2)4-COOH (X) + 2NaOH → NaOOC-(CH2)4-COONa + C2H5OH (X2) + H2O.
2C2H5OH + HOOC-(CH2)4-COOH ⇔ C2H5OOC-(CH2)4-COOC2H5 (X6) + 2H2O.
Cho các phát biểu sau:
(a) Magie cháy trong khí cacbonic ở nhiệt độ cao.
(b) Bột nhôm trộn với bột sắt(III) oxit dùng để hàn đường ray bằng phản ứng nhiệt nhôm.
(c) Dùng Na2CO3 để làm mất tính cứng tạm thời và tính cứng vĩnh cửu của nước.
(d) Nhôm được sử dụng để sản xuất “giấy bạc” gói, bọc thực phẩm.
(e) Phèn chua có công thức chung là R2SO4.Al2(SO4)3.24H2O (với R là kim loại kiềm).
(f) Khi bị bỏng vôi bột (CaO dính lên da) có thể xử lý bằng cách dùng nước rửa sạch.
Số phát biểu đúng là
Chọn D.
(e) Sai, Phèn chua có công thức chung là K2SO4.Al2(SO4)3.24H2O.
Cho m gam hỗn hợp Cu và Fe3O4 vào 200 ml dung dịch chứa NaNO3 1M và H2SO4 2M, thu được dung dịch Y và thấy 1,12 lít khí NO. Thêm dung dịch HCl (dư) vào dung dịch Y, lại thấy thoát ra 0,336 lít khí NO, biết NO là sản phẩm khử duy nhất của NO3- và thể tích khí đo ở điều kiện tiêu chuẩn. Giá trị của m là
Chọn D.
Trước khi thêm HCl thì H+ hết \( \to {n_{{H^ + }}} = 4{n_{NO}} + 2{n_O} \Rightarrow 0,8 = 0,2 + 8{n_{F{e_3}{O_4}}} \Rightarrow {n_{F{e_3}{O_4}}} = 0,075\;mol\)
\(2{n_{Cu}} + {n_{F{e_3}{O_4}}} = 3{n_{NO}} = 0,195 \Rightarrow {n_{Cu}} = 0,06\;mol \Rightarrow m = 21,24\;(g)\)
Hợp chất X (CnH14O5) có chứa vòng benzen và nhóm chức este trong phân tử. Trong X, phần trăm khối lượng của oxi lớn hơn 26%. Lấy 1 mol X tác dụng hết với dung dịch NaOH dư, sản phẩm hữu cơ thu được chỉ là 2 mol chất Y. Cho các phát biểu sau:
(a) Chất X có ba loại nhóm chức.
(b) Có ba cấu tạo thỏa mãn tính chất của chất Y.
(c) Số mol NaOH đã tham gia phản ứng là 2 mol.
(d) Khi cho 1 mol X tác dụng hết với NaHCO3 (trong dung dịch) hoặc Na đều thu được 1 mol khí.
(e) Cứ 1 mol chất Y tác dụng vừa đủ với dung dịch chứa 1 mol HCl trong dung dịch loãng.
(g) Khối lượng chất Y thu được ở thí nghiệm trên là 348 gam.
Số phát biểu đúng là
Chọn D.
Theo các dữ kiện đề bài suy ra X là HO-C6H4-COO-C6H4-COOH
→ Y là NaO-C6H4-COONa
Các phát biểu trên đều đúng (a), (b), (d), (g).
Cho X, Y là hai axit cacboxylic đơn chức mạch hở (MX < MY); T là este hai chức tạo bởi X, Y và một ancol no mạch hở. Đốt cháy hoàn toàn 12,38 gam hỗn hợp E gồm X, Y, T bằng một lượng vừa đủ O2, thu được 0,47 mol CO2 (đktc) và 0,33 mol H2O. Mặt khác 12,38 gam E tác dụng với dung dịch AgNO3 trong NH3 dư, thu được 17,28 gam Ag. Phần trăm khối lượng của X trong E gần nhất với giá trị nào sau đây?
Chọn D.
Hỗn hợp E gồm X: HCOOH (a mol); Y: RCOOH (b mol); T (c mol)
Ta có:
\(\left\{ \begin{array}{l}
2a + 2c = {n_{Ag}} = 0,16\\
2a + 2b + 4c = 0,38\\
(k - 1)b + kc = {n_{C{O_2}}} - {n_{{H_2}O}} = 0,14
\end{array} \right. \to \left\{ \begin{array}{l}
a = 0,05\\
b = 0,08\\
c = 0,03
\end{array} \right. \Rightarrow \% {m_X} = 18,58\% \)
Cho hình vẽ mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl:
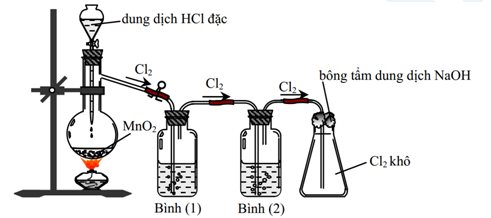
Cho các phát biểu sau:
(a) Bình (1) để hấp thụ khí HCl, bình (2) để hấp thụ hơi nước.
(b) Có thể đổi vị trí bình (1) và bình (2) cho nhau.
(c) Sử dụng bông tẩm kiềm để tránh khí Cl2 thoát ra môi trường.
(d) Chất lỏng sử dụng trong bình (1) lúc đầu là nước cất.
(e) Có thể thay thế HCl đặc bằng H2SO4 đặc, khi đó chất rắn trong bình cầu là NaCl và KMnO4.
(f) Bình (2) đựng trong dung dịch H2SO4 đặc, có thể thay thế bằng bình đựng CaO (viên).
Số phát biểu không đúng là
Chọn A.
Khí clo đi ra có lẫn khí hidroclorua và hơi nước nên lần lượt dẫn qua:
Bình (1) đựng dung dịch NaCl để hấp thụ khí HCl.
Bình 2 đựng dung dịch H2SO4 đặc để hấp thu hơi nước làm khô khí.
Bình (3) để đứng thu khí Cl2 khô vì khí clo nặng hơn không khí, khí này rất độc phá hủy niêm mạc đường hô hấp. Miệng bình có bông tẩm xút để xử lí Cl2 thừa không cho thoát ra môi trường vì clo phản ứng được với NaOH.
Có thể thay thế HCl đặc bằng H2SO4 đặc, khi đó chất rắn trong bình cầu là NaCl và KMnO4.
Không đổi bình (1), (2) vì khí Cl2 thu được sẽ có lẫn tạp chất (lưu ý bước làm khô luôn là cuối cùng).
Không thay thế H2SO4 đặc bằng CaO vì nó sẽ hấp thụ khí Cl2.
Vậy các ý sai là (b), (d), (f).
Đốt cháy hoàn toàn 0,33 mol hỗn hợp X gồm metyl propionat, metyl axetat và hiđrocacbon mạch hở cần vừa đủ 1,27 mol O2, tạo ra 14,4 gam H2O. Nếu cho 0,33 mol X vào dung dịch Br2 dư thì số mol Br2 phản ứng tối đa là
Chọn A.
Quy đổi:
\(\underbrace {\overbrace {{C_n}{H_{2n}}{O_2}}^{a\,mol},\,\overbrace {{C_x}{H_y}}^{b\,mol}}_{0,33\,mol\,X} + \underbrace {{O_2}}_{1,27\,mol} \to C{O_2} + \underbrace {{H_2}O}_{0,8\,mol}\)
Ta có: \(\left\{ \begin{array}{l}
2a + 2{n_{{O_2}}} = 2{n_{C{O_2}}} + {n_{{H_2}O}}\\
{n_{C{O_2}}} - {n_{{H_2}O}} = (k - 1)b
\end{array} \right. \to \left\{ \begin{array}{l}
a = {n_{C{O_2}}} - 0,87\\
{n_{C{O_2}}} = kb - b + 0,8
\end{array} \right. \Rightarrow a = kb - b - 0,07\;(1)\)
(với k là số liên kết p trong phân tử của 2 hiđrocacbon). Kết hợp (1) với a + b = 0,33 ta suy ra: kb = 0,4 mol
Khi cho 0,33 mol X tác dụng với Br2 thì : \({n_{B{r_2}}} = k{n_{{C_x}{H_y}}} = kb = 0,4\;mol\)
Hòa tan hoàn toàn a gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba và BaO (trong đó oxi chiếm 7,99% về khối lượng) vào nước dư. Sau phản ứng, thu được dung dịch Y gồm NaOH, KOH và Ba(OH)2 có tỉ lệ mol tương ứng là 3 : 2 : 7 và 0,784 lít khí H2 (đktc). Cho Y tác dụng với dung dich gồm 0,02 mol Al2(SO4)3; 0,01 mol H2SO4 và 0,04 mol KHSO4 thu được m gam kết tủa. Giá trị của m là
Chọn D.
Quy đổi hỗn hợp thành Na (3x mol), K (2x mol), Ba (7x mol), O (y mol).
Ta có: \(\% {m_O} = \frac{{16y}}{{1106x + 16y}}.100 = 7,99\) và \( \to 19x = 2y + 0,07\) → x = 0,01 và y = 0,06
Khi cho Y tác dụng với hỗn hợp các chất trên thì:
\(\left\{ \begin{array}{l}
BaS{O_4}:0,07\;mol\\
Al{(OH)_3}:0,03\;mol
\end{array} \right. \Rightarrow {m_ \downarrow } = 18,65\;(g)\)
Cho hỗn hợp E gồm 0,15 mol chất hữu cơ mạch hở X (C6H13O4N) và 0,2 mol este hai chức Y (C4H6O4) tác dụng hết với dung dịch NaOH vừa đủ, đun nóng. Kết thúc phản ứng, cô cạn dung dịch, thu được hỗn hợp Z gồm hai ancol đơn chức kế tiếp nhau trong dãy đồng đẳng và a gam hỗn hợp ba muối khan (đều có cùng số cacbon trong phân tử, trong đó có hai muối cacboxylic). Giá trị của a là
Chọn D.
\(E\left\{ \begin{array}{l}
C{H_3}{\rm{COON}}{{\rm{H}}_3}C{H_2}COO{C_2}{H_5}:0,15\;mol\\
{(C{\rm{OOC}}{{\rm{H}}_3})_2}:0,2\;mol
\end{array} \right. \to \left\{ \begin{array}{l}
C{H_3}{\rm{COO}}Na:0,15\;mol\\
{\rm{N}}{{\rm{H}}_2}C{H_2}COONa:0,15\;mol\\
{(C{\rm{OONa)}}_2}:0,2\;mol
\end{array} \right. \Rightarrow a = 53,65\;(g)\)
Điện phân (điện cực trơ, màng ngăn xốp) dung dịch gồm CuSO4 và NaCl (tỉ lệ mol tương ứng 1 : 3) với cường độ dòng diện 1,34A. Sau thời gian t giờ, thu được dung dịch Y (chứa hai chất tan) có khối lượng giảm 10,375 gam so với dung dịch ban đầu. Cho bột Al dư vào Y, thu được 1,68 lít khí H2 (đktc). Biết các phản ứng xảy ra hoàn toàn, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước. Giá trị của t là
Chọn B.
Dung dịch Y chứa NaOH và Na2SO4.
Đặt số mol của CuSO4 và NaCl lần lượt là x và 3x mol.
Khi cho Al tác dụng với dung dịch Y thì: \({n_{NaOH}} = \frac{2}{3}{n_{{H_2}}} = 0,05\;mol\)
\( \to {n_{N{a_2}S{O_4}}} = \frac{{3x - 0,05}}{2}\) mà \({n_{N{a_2}S{O_4}}} = {n_{CuS{O_4}}} = x \Rightarrow x = 0,05\;mol\)
Tại catot thu được Cu (0,05) và H2 (a) còn tại anot thu được khí Cl2 (0,075) và O2 (b).
Ta có: \(\left\{ \begin{array}{l}
2.0,05 + 2a = 0,075.2 + 4b\\
64.0,05 + 2a + 0,075.71 + 32b = 10,375
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
a = 0,125\\
b = 0,05
\end{array} \right. \Rightarrow {n_e} = 0,35\;mol \Rightarrow t = 7h\)

