Đề thi thử THPT QG môn Hóa học năm 2018 - Sở GD&ĐT Hà Nội
Đề thi thử THPT QG môn Hóa học năm 2018 - Sở GD&ĐT Hà Nội
-
Hocon247
-
40 câu hỏi
-
90 phút
-
23 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Kim loại nào sau đây có thể tan trong dung dịch HNO3 đặc nguội ?
Kim loại Al, Fe, Cr bị thụ động với HNO3 đặc nguội
Cho các chất sau: CH3COOH,C2H5OH, C2H6, C2H5Cl. Chất có nhiệt độ sôi thấp nhất là
Ghi nhớ:
+ Chất có cùng phân tử khối, chất nào có liên kết hiđro có nhiệt độ sôi cao hơn chất không có liên kết hiđro
+ Chất có phân tử khối càng lớn thì nhiệt độ sôi càng cao
Chất nào sau đây vừa tác dụng với dung dịch HCl, vừa tác dụng với dung dịch NaOH?
Al(OH)3 là hi đroxit lưỡng tính nên vừa tác dụng với dd axit vừa tác dụng với dd bazo
Phenol không có khả năng phản ứng với chất nào sau đây?
Phenol không có khả năng phản ứng với dung dịch NaCl
2C6H5OH + 2Na → 2C6H5ONa + H2
C6H5OH + 3Br2 → C6H2Br3OH + 3HBr
C6H5OH + NaOH → C6H5ONa + H2O
Tính chất nào sau đây không phải tính chất vật lí chung của kim loại?
Tính chất vật lí chung của kim loại gồm: tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim
=> không có tính cứng
“Nước đá khô” không nóng chảy mà dễ thăng hoa nên được dùng để tạo môi trường lạnh và khô, rất tiện cho việc bảo quản thực phẩm. “ Nước đá khô” là
“ Nước đá khô” là CO2 ở thể rắn
Phương trình hóa học nào sau đây không đúng?
SiO2 chỉ tác dụng với dd HF chứ không tác dụng với dd HCl
Cho các chất sau: but – 2- en; propen; etan; propin. Chất có đồng phân hình học là
But-2-en: CH3 – CH = CH – CH3
Propen: CH3 – CH = CH2
Etan: CH3 – CH3
Propin: CH3 – C ≡ CH
→ Chỉ có but-2-en thỏa mãn điều kiện
Nhỏ vài giọt dung dịch chứa chất X vào ống nghiệm đựng dung dịch hồ tinh bột thấy xuất hiện kết tủa màu xanh.Chất X là
Nhỏ vài giọt dung dịch I2 vào ống nghiệm đựng dung dịch hồ tinh bột thấy xuất hiện kết tủa màu xanh.
Chất nào sau đây không phải là hợp chất hữu cơ?
Hợp chất hữu cơ là hợp chất của C trừ muối caccbonat, muối cacbua kim loại, axit HCN
Cho m gam hỗn hợp X gồm Mg và Al vào dung dịch HCl dư thu được 8,96 lít khí. Mặt khác, cho m gam hỗn hợp X tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí. Thể tích khí đo ở đktc. Giá trị của m là
Phương pháp:
Cách 1: Viết PTHH, tính toán theo PTHH
Cách 2: Bảo toàn electron
Hướng dẫn giải:
Cách 1:
2Al + 6HCl → 2AlCl3 + 3H2↑ (1)
0,3 (mol)
Mg + 2HCl → MgCl2 + H2↑ (2)
0,1 ← (0,4- 0,3) (mol)
Chỉ có Al tác dụng với dd NaOH
Al + NaOH + H2O → NaAlO2 + 3/2. H2↑ (3)
0,2 ← 0,3 (mol)
nH2(1+2) = 8,96: 22,4 = 0,4 (mol) ; nH2 (3) = 6,72 : 22,4 = 0,3 (mol)
=> m = 0,2. 27 + 0,1.24 = 7,8 (g)
Cách 2: nAl = 2/3 nH2 sinh ra do t/d với NaOH = 2/3. 0,3 = 0,2 (mol)
nMg = nH2 sinh ra do t/d với HCl - nH2 sinh ra do t/d với NaOH = 0,4 – 0, 3= 0,1 (mol)
=> m = 0,2.27 + 0,1.24 = 7,8 (g)
Thêm từ từ V ml dung dịch Ba(OH)2 0,1M vào 120 ml dung dịch HNO3 1M, cô cạn dung dịch sau phản ứng, làm khô thu được 17,37 gam chất rắn khan. Giá trị của V là
Phương pháp: Bảo toàn nguyên tố N, Ba
Hướng dẫn giải:
nHNO3 = 0,12 (mol)
BTNT N => nBa(NO3)2 = 1/2nHNO3 = 0,06 (mol)
mrắn = mBa(NO3)2 + mBa(OH)2 dư
=> nBa(OH)2 dư = ( 17,37 – 0,06. 261)/ 171 = 0,01 (mol)
∑ nBa(OH)2 = nBa(NO3)2 + nBa(OH)2 dư = 0,07 (mol)
=> V = n : CM = 0,07: 0,1 = 0,7 (lít) = 700 (ml)
Phát biểu nào sau đây không đúng?
A, B, C đúng
D.Sai vì CaO phản ứng với HCl nên không thể làm khô HCl được
CaO + 2HCl → CaCl2 + H2O
CaO + H2O → Ca(OH)2
Cho m gam hỗn hợp X gồm CuO, Fe2O3, FeO tác dụng vừa đủ với 100ml dung dịch chứa H2SO4 1M và HCl 1M. Thể tích (ở đktc) hỗn hợp khí CO và H2 tối thiểu cần dùng để khử hoàn toàn m gam hỗn hợp X là
\(\underbrace {CuO,F{e_2}{O_3},FeO}_{} + \left\{ {\begin{array}{*{20}{l}}
{{H_2}S{O_4}:0,1{\mkern 1mu} mol}\\
{HCl:0,1mol}
\end{array}} \right. \to muoi + {H_2}O\)
\(\underbrace {CuO,F{e_2}{O_3},FeO}_{} + \left\{ \begin{array}{l}
{H_2}\\
CO
\end{array} \right.KL + \left\{ \begin{array}{l}
{H_2}O\\
C{O_2}
\end{array} \right.\)
∑ nH+ = 2nH2SO4 + nHCl = 0,1.2 + 0,1 = 0,3 (mol)
=> nO (Trong oxit) = 1/ 2 nH+ = 0,15 (mol)
∑ nCO + H2 = nO (Trong oxit) = 0,15 (mol) => V = 0,15.22,4 = 3,36 (lít)
Dung dịch nào sau đây có khả năng làm nhạt màu dung dịch KMnO4 trong môi trường H2SO4 ?
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnO2↓ + K2SO4 + 8H2O
Cho các phát biểu sau:
(1) Để một miếng gang ( hợp kim sắt – cacbon) ngoài không khí ẩm, sẽ xảy ra ăn mòn điện hóa.
(2) Kim loại cứng nhất là W (vonfam).
(3) Hòa tan Fe3O4 bằng dung dịch HCl vừa đủ, thu được dung dịch chứa hai muối.
(4) Khi điện phân NaCl nóng chảy (điện cực trơ), tại catot xảy ra sự oxi hóa ion Na+.
(5) Không thể dùng khí CO2 để dập tắt đám cháy magie hoặc nhôm.
Số phát biểu đúng là
Các phát biểu đúng là: 1, 2, 3, 5
Cho các phát biểu sau:
(1) Glucozơ không tham gia phản ứng công hiđro ( xúc tác Ni, đun nóng).
(2) Metyl amin làm quỳ tím ẩm đổi sang màu xanh.
(3) Đa số các polime không tan trong các dung môi thông thường.
(4) Muối natri hoặc kali của axit béo được dùng để sản xuất xà phòng.
Các phát biểu đúng là
Các phát biểu đúng 2,3,4
Trong công nghiệp, nhôm được sản xuất bằng phương pháp
2Al2O3 (đpnc) → 4Al + 3O2
Tơ nitrin dai, bền với nhiệt, giữ nhiệt tốt, thường được dùng để dệt vải và may quần áo ẩm. Trùng hợp chất nào sau đây tạo thành polime dùng để sản xuất tơ nitron?
Trùng hợp CH2=CH-CN tạo thành polime dùng để sản xuất tơ nitron
Tiến hành thí nghiệm với các chất hữu cơ X, Y, Z, T đều trong dung dịch. Kết quả được ghi ở bảng sau:
X có thể là phenol hoặc anilin
Y vừa phản ứng với dd Cu(OH)2 tạo ra dd màu xanh lam vừa tác dụng với dd AgNO3/NH3 tạo ra Ag => Y là glucozo
Z vừa phản ứng với dd Cu(OH)2 tạo ra dd màu xanh lam => Z là glixerol
T tác dụng với dd AgNO3/NH3 tạo ra Ag => etylfomat.
Vậy thứ tự X, Y,Z, T là anilin, glucozo, glixerol, etylfomat sẽ phù hợp với đáp án.
Phát biểu nào sau đây là đúng?
Trong phân tử peptit mạch hở chứa n gốc α – amino axit (chứa 1 nhóm NH2, 1 nhóm COOH) có (n-1) liên kết peptit.
→ Đáp án A
Cho các chất: NaHCO3, CO, Al(OH)3, Fe(OH)3, CO2, NH4Cl. Số chất tác dụng được với dung dịch NaOH ở nhiệt độ thường là
Các chất phản ứng với NaOH ở t0 thường là: NaHCO3; Al(OH)3; CO2; NH4Cl => có 4 chất
Khi cho kim loại sắt vào lượng dư dung dịch chứa chất X, sau khi kết thúc phản ứng thu được sản phẩm là muối sắt (II). Chất X có công thức hóa học là
\(F{\rm{e}} + 2F{\rm{e}}C{l_3} \to 3F{\rm{e}}C{l_2}\)
Isoamyl axetat là một este có mùi chuối chín, công thức cấu tạo thu gọn của este này là
Isoamyl axetat là một este có mùi chuối chín, công thức cấu tạo thu gọn của este này là CH3COOCH2CH2CH(CH3)2.
Dung dịch chất nào sau đây không làm đổi màu quỳ tím thành đỏ?
H2NCH2COOH không làm đổi màu quỳ tím thành đỏ.
Cho dãy các chất sau: etilen, hexan, hex-1-in, anilin, cumen, but-1-in, benzen, stiren, metyl metacrylat. Số chất trong dãy trên tác dụng được với nước brom ở điều kiện thường là
Gồm có: etilen, hex-1-en, anilin, but-1-in, stiren, metyl metacrylat.
Chất hữu cơ X có công thức phân tử C8H15O4N. Khi cho chất X tác dụng với dung dịch NaOH, đun nóng, thu được sản phẩm gồm chất Y, C2H6O và CH4O. Chất Y là muối natri của α – amino axit Z (chất Z có cấu tạo mạch hở và có mạch cacbon không phân nhánh). Số công thức cấu tạo của phù hợp của X là
X + NaOH → Y + C2H5OH + CH3OH và muối natri của α-amino axit Z không phân nhánh nên X có thể là
CH3OOC-CH(NH2)-CH2-CH2-COOC2H5
C2H5OOC-CH(NH2)-CH2-CH2-COOCH3
→ có 2 CTCT thỏa mãn
Cracking khí butan một thời gian thì thu được hỗn hợp khí X gồm CH4, C3H6, C2H6, C2H4 và C4H10 dư. Cho toàn bộ hỗn hợp X đi qua dung dịch nước Br2 dư thì khối lượng bình brom tăng lên 0,91 gam và có 4 gam Br2 phản ứng, đồng thời có hỗn hợp khí Y thoát ra khỏi bình Br2 (thể tích của Y bằng 54,545% thể tích của X). Để đốt cháy hoàn toàn hỗn hợp Y cần vừa đủ V lít O2 (ở đktc). Giá trị của V là
Khi dẫn qua dung dịch Br2, C3H6 (x mol) và C2H4 (y mol) bị giữ lại.
x + y = nBr2 = 4/160 = 0,025 mol
42x+28y = m bình tăng = 0,91
Giải hệ ta tìm được x = 0,015 mol; y = 0,01 mol
nY = 54,545%nX = 54,545% (0,025 + nY) → nY = 0,03 mol;
Y gồm: CH4: 0,015 mol; C2H6: 0,01 mol; C4H10 dư: 0,03 – 0,015 – 0,01 = 0,005 mol
+ BTNT C: nCO2: 0,015+0,01.2+0,005.4 = 0,055 mol
+ BTNT H: nH2O: 0,015.2+0,01.3+0,005.5 = 0,085 mol
BTNT O: nO2 = nCO2 + 0,5nH2O = 0,055 + 0,5.0,085 = 0,0975 mol
VO2 = 2,184 lít.
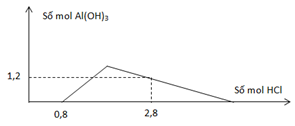
Cho từ từ dung dịch HCl vào dung dịch chứa a mol Ba(AlO2)2 và b mol Ba(OH)2. Số mol Al(OH)3 tạo thành phụ thuộc vào số mol HCl được biểu diễn bằng đồ thị hình bên. Tỉ lệ a:b tương ứng là
\(HCl + \left\{ \begin{array}{l}
Ba{\left( {Al{O_2}} \right)_2}:a\,mol\\
Ba{\left( {OH} \right)_2}:b\,mol
\end{array} \right.\)
nOH- = 0,8 → nBa(OH)2 = b = 0,4 mol
AlO2- + H+ + H2O → Al(OH)3
2a 2a
Al(OH)3 + 3H+ → Al3+ + 3H2O
2a-1,2
3(2a-1,2) + 2a = 2 → a = 0,7
→ a:b = 7:4
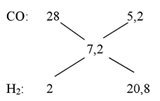
Cho hơi nước đi qua than nóng đỏ, sau phản ứng thu được V lít (ở đktc) hỗn hợp khí X gồm CO, CO2 và H2. Dẫn toàn bộ hỗn hợp X qua dung dịch Ca(OH)2 thu được 2 gam kết tủa và khối lượng dung dịch sau phản ứng giảm 0,68 gam so với khối lượng dung dịch Ca(OH)2 ban đầu; khí còn lại thoát ra gồm CO và H2 có tỉ khối hơi so với H2 là 3,6. Giá trị của V là
Ta có:
Ta có: \(\Rightarrow \frac{{{n_{CO}}}}{{{n_{{H_2}}}}} = \frac{{5,2}}{{20,8}} = \frac{1}{4}\)
\(\begin{array}{l}
C + 2{H_2}O \to C{O_2}\,\, + \,\,\,2{H_2}\\
& \,\,\,\,\,\,\,\,\,\,\,0,03\,\,\,\,\,\,\,\,0,06\\
C + {H_2}O \to CO\,\, + \,\,\,{H_2}\\
& \,\,\,\,\,\,\,\,\,\,x\,\,\,\,\,\,\,\,\,\,\,\,\,x
\end{array}\)
\(\frac{{{n_{CO}}}}{{{n_{{H_2}}}}} = \frac{x}{{x + 0,06}} = \frac{1}{4} \Rightarrow x = 0,02\,mol\)
\(\to \left\{ \begin{array}{l}
C{O_2}:0,03\\
CO:0,02\\
{H_2}:0,08
\end{array} \right. \to V = 2,912\,lit\)
Cho m gam bột Fe vào 200 ml dung dịch chứa HCl 0,4M và Cu(NO3)2 0,2M. Lắc đều cho các phản ứng xảy ra hoàn toàn, sau phản ứng thu được hỗn hợp chất rắn có khối lượng bằng 0,75m gam và V lít (ở đktc) khí NO (sản phẩm khử duy nhất của N+5). Giá trị của m và V lần lượt là:
H+: 0,08
NO3-: 0,08
Cu2+: 0,04
3Fe + 8H+ + 2NO3-→3Fe2+ + 2NO+4H2O
0,03 0,08 0,02
Fe + Cu2+ → Fe2+ + Cu
0,04 0,04 0,04
m chất rắn = m Fe dư + mCu → m - 0,07.56 + 64.0,04 = 0,75m
→ m = 5,44 gam
VNO = 0,02.22,4 = 0,448 lít
Đốt cháy hoàn toàn m gam photpho trong oxi dư. Cho toàn bộ sản phẩm tạo thành vào 500 ml dung dịch chứa hỗn hợp NaOH 0,1M và KOH 0,2M đến khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch sau phản ứng, làm khô các chất thu được 9,448 gam chất rắn khan. Giá trị của m là
NaOH: 0,05
KOH: 0,1
Gọi công thức chung 2 bazo là MOH (M=101/3) với nMOH=0,15
- Nếu chỉ tạo muối dạng MH2PO4: \({n_{M{H_2}P{O_4}}} = 0,15\,mol \Rightarrow {m_{M{H_2}P{O_4}}} = 0,15.\left( {\frac{{101}}{3} + 2 + 31 + 64} \right) = 19,6\,gam\)
- Nếu chỉ tạo muối dạng M2HPO4:
\({n_{{M_2}HP{O_4}}} = \frac{{{n_{MOH}}}}{2} = 0,075\,mol \Rightarrow {m_{{M_2}HP{O_4}}} = 0,075.\left( {\frac{{101}}{3}.2 + 1 + 31 + 64} \right) = 12,25\,gam\)
- Nếu chỉ tạo muối dạng M3PO4:
\({n_{{M_3}HP{O_4}}} = \frac{{{n_{MOH}}}}{3} = 0,05\,mol \Rightarrow {m_{{M_3}HP{O_4}}} = 0,05.\left( {\frac{{101}}{3}.3 + 31 + 64} \right) = 9,8\,gam\)
Ta thấy mmuối < 9,8 gam → MOH dư, H3PO4 hết
Giả sử chất rắn gồm: \(\left\{ \begin{array}{l}
{M_3}P{O_4}:x\\
MOH:y
\end{array} \right. \to \left\{ \begin{array}{l}
BTNT\,M:\,\,3x + y = 0,15\\
{m_{muoi}} = \left( {3.\frac{{101}}{3} + 31 + 64} \right)x + \left( {\frac{{101}}{3} + 17} \right)y = 9,448
\end{array} \right.\)
\(\to x = 0,042\,mol \to {n_P} = {n_{{M_3}P{O_4}}}\left( {BTNT:P} \right) = 0,042\,mol\)
\(\to m = 1,302\,gam\)
Hỗn hợp X gồm 1 mol amin no, mạch hở A và 2 mol amino axit no, mạch hở B tác dụng vừa đủ với 4 mol HCl hoặc 4 mol NaOH. Nếu đốt cháy một phần hỗn hợp X (nặng a gam) cần vừa đủ 38,976 lít O2 (đktc) thu được 5,376 lít khí N2 (đktc). Mặt khác, cho a gam hỗn hợp X tác dụng với dung dịch HCl dư, sau phản ứng thu được m gam muối. Giá trị của m là
1 mol amin no, 2 mol amino axit no tác dụng vừa đủ với 4 mol HCl hoặc 4 mol NaOH nên amin có 2 –NH2; amino axit có 2 –COOH và 1 –NH2
Giả sử trong a gam hỗn hợp X:
A: CnH2n+4N2 (a mol)
B: CmH2m-1O4N (b mol)
\(\left\{ \begin{array}{l}
BTNT\,N:2a + b = 2n{N_2} = 0,48\,mol\\
\frac{a}{b} = \frac{1}{2}
\end{array} \right. \to \left\{ \begin{array}{l}
a = 0,12\\
b = 0,48
\end{array} \right.\)
\({C_n}{H_{2n + 4}}{N_2} + \frac{{3n + 2}}{2}{O_2} \to nC{O_2} + \left( {n + 2} \right){H_2}O + {N_2}\)
\(\begin{array}{l}
{C_n}{H_{2n + 4}}{N_2} + \frac{{3n + 2}}{2}{O_2} \to nC{O_2} + \left( {n + 2} \right){H_2}O + {N_2}\\
0,12 & & 0,12.\frac{{3n + 2}}{2}
\end{array}\)
\(\begin{array}{l}
{C_m}{H_{2m - 1}}{O_4}N\,\, + \,\,\frac{{3m - 4,5}}{2}{O_2} \to mC{O_2}\, + \,\left( {m - 0,5} \right){H_2}O + 0,5{N_2}\\
0,24 & & 0,24.\frac{{3m - 4,5}}{2}
\end{array}\)
\(\Rightarrow 0,12.\frac{{3n + 2}}{2} + 0,24.\frac{{3m - 4,5}}{2} = 1,74\)
\( \Rightarrow n + 2m = 12\)
Ta có: \(a = 0,12\left( {14n + 32} \right) + 0,24\left( {14m + 77} \right)\)
\(= 1,68\left( {n + 2m} \right) + 22,32 = 1,68.12 + 22,32 = 42,48g\)
\({n_{HCl}} = 2{n_A} + {n_B} = 0,12.2 + 0,24 = 0,48\,mol\)
\({m_{muoi}} = a + {m_{HCl}} = 42,48 + 0,48.36,5 = 60g\)
Đun nóng 26,56 gam hỗn hợp X gồm 3 ancol đều no, mạch hở, đơn chức với H2SO4 đặc, ở 140oC, sau khi phản ứng xảy ra hoàn toàn thu được 22,24 gam hỗn hợp 6 ete có số mol bằng nhau. Biết trong các ete tạo thành có 3 ete có phân tử khối bằng nhau. Công thức cấu tạo thu gọn của các ancol là
BTKL: mH2O = 26,56 – 22,24 = 4,32g
nH2O = 0,24mol
nancol = 2nH2O = 0,48mol
Tách nước thu được ete có số mol bằng nhau → 3 ancol có số mol bằng nhau
→ nA = nB = nC = 0,16mol
Mặt khác trong các ete tạo thành có 3 ete có phân tử khối bằng nhau => có 2 ancol là đồng phân của nhau
→ 0,16MA + 0,32MB = 26,56
→ MA + 2MB = 166
2 ancol thỏa mãn C2H5OH và C3H7OH
E là trieste mạch hở, tạo bởi glixerol và ba axit cacboxylic đơn chức. Đốt cháy hoàn toàn x mol chất E thu được y mol CO2 và z mol H2O. Biết y = z + 5x và khi cho x mol chất E phản ứng vừa đủ với 72 gam Br2 trong nước, thu được 110,1 gam sản phẩm hữu cơ. Nếu cho x mol chất E phản ứng hết với dung dịch KOH, cô cạn dung dịch sau phản ứng, làm khô sản phẩm thu được m gam muối khan. Giá trị của m là
\({n_E} = \frac{{{n_{C{O_2}}} - {n_{{H_2}O}}}}{5}\)
k = 6
→ Gốc R có k = 3
\(\begin{array}{l}
{\left( {RCOO} \right)_3}{C_3}{H_5}{\mkern 1mu} {\mkern 1mu} {\mkern 1mu} + {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} 3B{r_2} \to {\left( {RB{r_2}COO} \right)_3}{C_3}{H_5}\\
0,15\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,45\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,15
\end{array}\)
\(\Rightarrow R = 27\)
\(\Rightarrow {m_{RCOOK}} = 49,5\)
Hợp chất X có chứa vòng benzen và có công thức phân tử là C7H6Cl2. Thủy phân chất X trong NaOH đặc, ở nhiệt độ cao, áp suất cao thu được chất Y có công thức C7H7O2Na. Số công thức cấu tạo phù hợp của X là
X: C7H6Cl2 → C7H7O2Na
→ Có 1 Cl đính vào vòng thơm
CTCT: ClC6H4CH2Cl (đồng phân o, p, m)
Cho 23 gam hỗn hợp X gồm Cu, Fe, Cu2S, CuS, FeS2 và FeS tác dụng hết với dung dịch HNO3 (đặc nóng, dư) thu được V lít (ở đktc) khí NO2 duy nhất và dung dịch Y. Nếu cho toàn bộ Y vào một lượng dư dung dịch BaCl2, thu được 58,25 gam kết tủa. Mặt khác, khi cho toàn bộ Y tác dụng với dung dịch NaOH dư thu được 25,625 gam chất kết tủa. Giá trị của V là
\(z = \frac{{58,25}}{{233}} = 0,25\,mol\)
→ mCu + mFe = 23 – 0,25 . 32 = 15g
\(\Rightarrow \left\{ \begin{array}{l}
64x + 56y = 15\\
98x + 107y = 25,625
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
x = 0,125\\
y = 0,125
\end{array} \right.\)
Bảo toàn electron → nNO2 = 2nCu + 3nFe + 6nS = 2,125mol
→ V = 47,6 lít
Cho 74,88 gam hỗn hợp rắn X gồm Fe, Fe3O4 và Fe(NO3)2 vào dung dịch chứa 0,3 mol HCl và 0,024 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa NH4+) và 0,032 mol hỗn hợp khí Z gồm NO và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, sau phản ứng thấy thoát ra 0,009 mol NO (sản phẩm khử duy nhất của N+5), đồng thời thu được 44,022 gam kết tủa. Phần trăm khối lượng Fe trong hỗn hợp X có giá trị gần nhất với giá trị nào sau đây?
Phần kết tủa có nAgCl= 0,3 → nAg = 0,009
Bảo toàn electron: nFe2+ = nAg + 3nNO = 0,036
nNO = 0,009 → nH+ dư = 4nNO = 0,036
Đặt a, b, c là số mol Fe, Fe3O4, Fe(NO3)2 trong X
→ mX = 56a + 232b + 180c = 7,488 (1 )
Dung dịch Y còn H+ dư và Fe2+ nên NO3- đã hết.
Vậy Y chứa Fe2+ (0,036), H+ (0,036), Cl- (0,3)
Bảo toàn điện tích → nFe3+ = 0,064
Bảo toàn Fe → a + 3b + c = 0,064 + 0,036 (2)
Bảo toàn H → nH2O = 0,144
Bảo toàn O: 4nFe3O4 + 6nFe(NO3)2 + 3nHNO3 = nZ + nH2O
→ 4b + 6c + 0,024 . 3 = 0,032 + 0,144 (3)
Giải hệ (1)(2)(3):
a = 0,05
b = 0,014
c = 0,008
→ %Fe = 37,4%
Xà phòng hóa hoàn toàn 0,1 mol một este E đơn chức, mạch hở bằng 26 gam dung dịch MOH 28% (M là kim loại kiềm) rồi tiến hành chưng cất sản phẩm thu được 26,12 gam chất lỏng và 12,88 gam chất rắn khan Y. Nung chất rắn Y trong bình kín với lượng oxi vừa đủ, sau khi các phản ứng xảy ra hoàn toàn thu được khí CO2, hơi nước và 8,97 gam một muối duy nhất.
Cho các phát biểu liên quan tới bài toán:
(1) Thể tích CO2 (ở đktc) thu được 5,264 lít.
(2) Tổng số nguyên tử C, H, O có trong một phân tử E là 21.
(3) Este E tạo bởi ancol có phân tử khối là 74.
(4) Este E có khả năng tham gia phản ứng tráng bạc.
Trong các phát biểu trên, số phát biểu đúng là:
\(0,1mol\,E + 26g\,MOH26\% \to \left\{ \begin{array}{l}
26,12\,chat\,long\\
12,88g\,Y\left\{ \begin{array}{l}
C{O_2} + {H_2}O\\
8,97g\,{M_2}C{O_3}
\end{array} \right.
\end{array} \right.\)
- Chất lỏng thu được sau pư gồm H2O của dung dịch ROH và ancol.
mROH = 7,28 gam; mH2O = 18,72 gam
→ m ancol = 7,4 gam
Sau pư còn MOH dư nên este pư hết.
n ancol = n este = 0,1 mol
→ M ancol = 74 gam: C4H9OH (vì este đơn chức)
- \({n_{ROH\,b{\rm{d}}}} = \frac{{7,28}}{{M + 17}}\)
\({n_{muoi}} = \frac{{8,97}}{{2M + 60}}\)
R bảo toàn nên ta có:
n ROH = 2 nmuối
→ M = 39: Kali
n KOH ban đầu = 0,13 mol; n KOH dư = 0,13 - 0,1 = 0,03 mol
→ m muối của este = 12,88 - 0,03 . 56 = 11,2 gam
→ M muối = 112
Muối có công thức là R-COO-K
→ R = 29: C2H5
Vậy este là C2H5COOC4H9 => (2) và (4) sai
\(\left\{ \begin{array}{l}
0,1\,mol\,{C_2}{H_5}COO{C_4}{H_9}:\,0,1\,mol\\
KOH:0,13\,mol
\end{array} \right. \to \left\{ \begin{array}{l}
26,12g\left\{ \begin{array}{l}
{H_2}O:\\
{C_4}{H_9}OH
\end{array} \right.\\
12,88g\,Y\left\{ \begin{array}{l}
KOH\,du\\
{C_2}{H_5}COOK:0,1
\end{array} \right.\left\{ \begin{array}{l}
C{O_2} + {H_2}O\\
{K_2}C{O_3}:0,065\,mol
\end{array} \right.
\end{array} \right.\)
BTNT C: → nCO2 = 0,125mol → V = 3,024 lít → (1) sai
Este X tạo bởi một α – aminoaxit có công thức phân tử C5H11O2N, hai chất Y và Z là hai peptit mạch hở, tổng số liên kết peptit của hai phân tử Y và Z là 7. Đun nóng 63,5 gam hỗn hợp E chứa X, Y, Z với dung dịch NaOH vừa đủ, thu được dung dịch chứa 2 muối (của glyxin và alanin) và 13,8 gam ancol. Đốt cháy toàn bộ hỗn hợp muối ở trên cần dùng vừa đủ 2,22 mol O2, sau phản ứng thu được Na2CO3, CO2, H2O và 7,84 lít khí N2 (đktc). Thành phần phần trăm theo khối lượng của peptit có phân tử khối lớn hơn trong hỗn hợp E là
Đặt a, b là số mol muối GlyNa và AlaNa
→ nN = a + b = 0,35.2
nO2 = 2,25a + 3,75b = 2,22
→ a = 0,27 và b = 0,43
→ m muối = 73,92 và nNaOH = 0,7
Bảo toàn khối lượng → nH2O = 0,21
→ nY + nZ = 0,21 (1)
X là este cùa Glỵ hoặc Ala và ancol T.
Nếu X là NH2-CH(CH3)-COOC2H5
→ nX = nC2H5OH = 0,3
→ Y, Z tạo ra từ 0,27 mol Gly và 0,43 - 0,3 = 0,13 mol Ala
→ Số N trung bình của Y, Z = (0,27 + 0,13)/0,21 = 1,9: Vô lý, loại.
Vậy X là NH2-CH2-COOC3H7
→ nX = nC3H7OH = 0,23
→ Y, Z tạo ra từ 0,27 - 0,23 = 0,04 mol Gly và 0,43 mol Ala
→ Số N trung bình của Y, Z = (0,04 + 0,43)/0,21 = 2,24
→ Y là dipeptit và z là heptapeptit
nN = 2nY + 7nZ = 0,04 + 0,43 (2)
(1)(2) → nY = 0,2 và nZ = 0,01
Y là (Gly)u(Ala)2-u
Z là (Gly)v(Ala)7-v
→ nGly = 0,2u + 0,01v = 0,04
→ 20 u + V = 4
→ u = 0 và v = 4 là nghiệm duy nhất.
Vậy:
Y là (Ala)2 (0,2 mol)
Z là (Gly)4(Ala)3 (0,01 mol)
→ %Z = 7,23%