Đề thi thử THPT QG môn Hóa học năm 2018 - Trường THPT Chuyên Quốc Học Huế - TT Huế
Đề thi thử THPT QG môn Hóa học năm 2018 - Trường THPT Chuyên Quốc Học Huế - TT Huế
-
Hocon247
-
40 câu hỏi
-
90 phút
-
18 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Công thức nào sau đây là công thức của chất béo?
Chất béo là trieste của glixerol và axit béo ⇒ Chọn D.
Một số axit béo thường gặp đó là:
C17H35COOH : Axit Stearic
C17H33COOH : Axit Olein
C17H31COOH : Axit Linoleic
C15H31COOH : Axit Panmitic
Trộn bột kim loại X với bột sắt oxit (gọi là hỗn hợp tecmit) để thực hiện phản ứng nhiệt nhôm dùng để hàn đường ray tàu hỏa. Kim loại X là:
Đáp án: D
Lời giải: Dùng bột nhôm với bột oxit sắt phản ứng nhiệt nhôm sinh ra lượng nhiệt lớn để hàn đường ra
Ô nhiễm không khí có thể tạo ra mưa axit, gây ra tác hại rất lớn với môi trường. Hai khí nào sau đây là nguyên nhân gây ra mưa axit?
Trong thành phần các chất đốt tự nhiên như than đá và dầu mỏ có chứa một lượng lớn lưu huỳnh, còn trong không khí lại chứa nhiều nito. Quá trình đốt sản sinh ra các khí độc hại như: lưu huỳnh đioxit (SO2) và nito đioxit (NO2). Các khí này hòa tan với hơi nước trong không khí tạo thành các axit sunfuric (H2SO4) và axit nitric (HNO3). Khi trời mưa, các hạt axit này tan lẫn vào nước mưa, làm độ pH của nước mưa giảm. Nếu nước mưa có độ pH dưới 5,6 được gọi là mưa axit
Kim loại mà khi tác dụng với HCl hoặc Cl2 không cho ra cùng một muối là:
Không cho ra cùng 1 muối là Fe.
Vì : Fe + 2HCl → FeCl2 + H2 ↑
2Fe + 3Cl2 → 2FeCl3
Chất không có khả năng làm xanh quỳ tím là:
Anilin không có khả năng làm xanh quỳ tím.
Amoniac, dd bazơ và dd aminoaxit có số nhóm NH2 lớn hơn số nhóm COOH đều có khả năng làm xanh quỳ tím.
Cho Fe tác dụng với HNO3 đặc nóng thu được khí X có màu nâu đỏ. Khí X là:
Fe + 6HNO3 → 3H2O + 3NO2 + Fe(NO3)3
Kim loại có nhiệt độ nóng chảy cao nhất có ký hiệu hóa học là:
Kim loại có nhiệt độ nóng chảy cao nhất là vonfram kí hiệu là W
Chất không bị nhiệt phân hủy là
Muối cacbonat của các kim loại kiềm không bị nhiệt phân hủy
Hợp chất H2NCH2COOH có tên gọi là
Hợp chất H2NCH2COOH có tên gọi là glyxin.
→ Đáp án B
Trong công nghiệp, kim loại nào sau đây chỉ được điều chế bằng phương pháp điện phân nóng chảy?
Phương pháp điện phân nóng chảy dùng để điều chế các kim loại từ nhôm trở về trước.
VD: K, Na, Mg…
Cho các hợp kim sau: Cu–Fe (1); Zn–Fe (II); Fe–C (III); Sn–Fe (IV). Khi tiếp xúc với dung dịch chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn trước là
Fe bị ăn mòn trước khi Fe là anot, điện cực còn lại là chất có tính khử yếu hơn
Cho các chất: anlyl axetat, phenyl axetat, etyl fomat, tripanmitin. Số chất trong các chất khí trên khi thủy phân trong dung dịch NaOH dư, đun nóng sinh ra ancol là
Số chất tác dụng với NaOH dư sinh ra ancol gồm:
+ Anlyl axetat, etyl fomat, tripanmitin
Một số hợp chất hữu cơ mạch hở, thành phần chứa C, H, O và có khối lượng phân tử 60 đvC. Trong các chất trên, số chất tác dụng được với Na là:
Gọi CTPT của HCHC có dạng: CxHyOz.
● Giả sử có 1 nguyên tử oxi z = 1 ⇒ 12x + y = 44.
+ Giải PT nghiệm nguyên ⇒ x = 3 và y = 8 ⇒ CTPT là C3H8O.
⇒ có 3 CTCT thỏa mãn: CH2–CH2–CH2–OH (1) || CH3–CH(CH3)–OH (2) || CH3–O–C2H5 (3).
● Giả sử có 2 nguyên tử oxi z = 2 ⇒ 12x + y = 28.
+ Giải PT nghiệm nguyên ⇒ x = 2 và y = 4 ⇒ CTPT là C2H4O2.
⇒ có 3 CTCT thỏa mãn: HCOOCH3 (4) || CH3COOH (5) || HO–CH2–CHO (6).
+ Số chất tác dụng với Na gồm (1) (2) (5) và (6)
Cho từ từ 200 ml dung dịch hỗn hợp HCl 1M và H2SO4 0,5M vào 300 ml dung dịch Na2CO3 1M thu được V lít khí (ở đktc). Giá trị của V là:
Ta có ∑nH+ = 0,4 mol và nCO32– = 0,3 mol.
+ Đầu tiên: H+ + CO32– → HCO3– [H+ dư 0,1 mol]
+ Sau đó: H+ + HCO3– → CO2↑ + H2O.
⇒ nCO2 = 0,1 mol ⇒ VCO2 = 2,24 lít
Cho hỗn hợp X gồm Fe2O3, ZnO, Cu tác dụng với dung dịch HCl (dư) thu được dung dịch Y và phần không tan Z. Cho Y tác dụng với dung dịch NaOH (loãng dư) thu được kết tủa gồm:
Do thu được cả kết tủa nên Cu còn dư sau phản ứng với Fe3+
Như vậy, trong dung dịch Y có FeCl2, ZnCl2 và CuCl2
Cho phản ứng với NaOH thì kết tủa thu được là Fe(OH)2 và Cu(OH)2
Hòa tan hoàn toàn 3,2 gam một oxit kim loại cần vừa đủ 40 ml dung dịch HCl 2M. Công thức của oxit đó là:
2.nO = nH+ = 0,08
→ nO = 0,04mol
→ MOxit = 3,2/0,04 = 80 (CuO)
Dãy các chất đều có khả năng tham gia phản ứng thủy phân trong dung dịch H2SO4 loãng, nóng là:
A đúng
B loại polistiren
C loại polietilen
C loại PVC
Dẫn luồng khí CO dư qua hỗn hợp CuO, Al2O3, CaO, MgO có số mol bằng nhau (nung nóng ở nhiệt độ cao) thu được chất rắn A. Hòa tan A vào nước dư còn lại chất rắn X. X gồm:
CO + Cu ⟶ Cu + H2O
CaO + H2O → Ca(OH)2
Ca(OH)2 + Al2O3 → Ca(AlO2)2 + H2O
Vì các chất ban đầu có cùng số mol nên Al2O3 phản ứng hết với dd Ca(OH)2.
Do vậy chất rắn sau phản ứng chỉ có Cu và MgO
Cho 23,00 gam C2H5OH tác dụng với 24,00 gam CH3COOH (to, xúc tác H2SO4 đặc) với hiệu suất phản ứng 60%. Khối lượng este thu được là
Ta có phản ứng: CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O
+ Ta có nCH3COOH = 0,4 mol và nC2H5OH = 0,5 mol
+ Từ số mol 2 chất ta xác định được hiệu suất tính theo số mol axit.
⇒ mEste = 0,4×0,6×88 = 21,12 gam
Este C4H8O2 tác dụng với dung dịch NaOH tạo ra ancol etylic. Công thức cấu tạo của este đó là:
Este C4H8O2 là este của ancol etylic → este có dạng RCOOC2H5
→ R: CH3 -
Đáp án cần chọn là: D
Có các phát biểu sau:
(1) Kim loại Cu khử được ion Fe2+ trong dung dịch.
(2) Thạch cao nung được dùng để đúc tượng, bó bột khi gãy xương, làm phấn viết bảng,...
(3) SO3 khi tác dụng với nước tạo thành 2 axit.
(4) Al(OH)3 vừa tác dụng được với dung dịch NaOH vừa tác dụng được với dung dịch HCl.
(5) CuSO4 khan được dùng để phát hiện dấu vết nước trong chất lỏng.
Số phát biểu đúng là
(1) Kim loại Cu khử được ion Fe2+ trong dung dịch → Sai
(2) Thạch cao nung được dùng để đúc tượng, bó bột khi gãy xương, làm phấn viết bảng, ... → Đúng
(3) SO3 khi tác dụng với nước tạo thành hai axit → Sai, chỉ tạo axit H2SO4
(4) Al(OH)3 vừa tác dụng với dung dịch NaOH vừa tác dụng với dung dịch HCl → Đúng
(5) CuSO4 khan được dùng để phát hiện dấu vết nước trong chất lỏng → Đúng, CuSO4 khan có màu trắng, CuSO4 dạng ngậm nước có màu xanh
Đáp án C
Cho dãy các chất: metan, etin, eten, etanol, etanoic, propenoic, benzen, alanin, phenol, triolein. Số chất trong dãy làm mất màu dung dịch brom là:
Số chất thỏa mãn yêu cầu đề bài bao gồm:
Etin, eten, propenoic (axit acrylic), phenol và triolein.
Tiến hành các thí nghiệm:
(1) Cho AgNO3 vào dung dịch Fe(NO3)2.
(2) Dẫn NH3 qua ống đựng CuO nung nóng.
(3) Cho Al vào dung dịch Fe2(SO4)3 dư.
(4) Cho K vào dung dịch Cu(NO3)2.
Sau khi kết thúc phản ứng, số thí nghiệm có tạo thành kim loại là
Số thí nghiệm tạo kim loại gồm:
(1) Fe2+ + Ag+ → Fe3+ + Ag || (2) NH3 + CuO → Cu + N2 + H2O
Cho các phát biểu:
(a) Chất béo là trieste của glixerol với axit béo.
(b) Glucozơ thuộc loại monosaccarit.
(c) Tất cả các peptit đều có phản ứng với Cu(OH)2 tạo hợp chất màu tím.
(d) Dung dịch saccarozơ không tham gia phản ứng tráng bạc.
Số phát biểu đúng là
Các phát biểu đúng là (a), (b) và (d)
(c) sai vì vì đipeptit không có phản ứng với Cu(OH)2
Khi cho các chất Al, FeS, dung dịch HCl, dung dịch NaOH và dung dịch (NH4)2CO3 phản ứng với nhau từng đôi một thì số chất khí có thể thu được là:
Al+HCl -> H2
Al+NaOH -> H2
Al+(NH4)2CO3 -> không phản ứng
FeS+HCl → H2S
FeS+NaOH → không phản ứng
FeS+(NH4)2CO3 → không phản ứng
HCl+NaOH → không có khí
HCl+(NH4)2CO3 → CO2
NaOH+(NH4)2CO3 → NH3
Vậy có thể thu được 4 chất khí: H2, H2S, CO2, NH3
Cho các chất : Al,AlCl3, Zn(OH)2, NH4HCO3, KHSO4, NaHS, Fe(NO3)2. Số chất vừa phản ứng với dung dịch NaOH vừa phản ứng với dung dịch HCl là:
Số chất thỏa mãn yêu cầu đề bài gồm:
Al, Zn(OH)2, NH4HCO3, NaHS và Fe(NO3)2.
Cho các chất: AgNO3, Cu(NO3)2, MgCO3, CaCO3, Ba(HCO3)2, NH4HCO3, NH4NO3 và Fe(NO3)2. Nếu nung các chất trên đến khối lượng không đổi trong các bình kín không có không khí, rồi cho nước vào các bình, số bình có thể tạo lại chất ban đầu sau thí nghiệm là:
Số chất thỏa mãn là AgNO3, Cu(NO3)2, CaCO3, Ba(HCO3)2 và NH4HCO3.
Với AgNO3 ta có:
AgNO3 → Ag + NO2 + O2.
Thêm H2O ⇒ H2O + NO2 + O2 → HNO3.
Sau đó: HNO3 + Ag → AgNO3 + NO + H2O.
- Với Cu(NO3)2 cũng thương tự như AgNO3.
- Với CaCO3 ta có:
CaCO3 → CaO + CO2.
Thêm H2O ⇒ CaO + H2O → Ca(OH)2.
Sau đó: Ca(OH)2 + CO2 → CaCO3 + H2O.
- Với Ba(HCO3)2 ta có:
Ba(HCO3)2 → BaCO3 + CO2 + H2O
Sau đó: BaCO3 → BaO + CO2.
Thêm H2O ⇒ BaO + H2O → Ba(OH)2.
Sau đó: Ba(OH)2 + CO2 → BaCO3 + H2O.
Vì CO2 dư ⇒ BaCO3 + CO2 + H2O → Ba(HCO3)2
- Với NH4HCO3 ta có:
NH4HCO3 → NH3 + H2O + CO2.
Thêm H2O ⇒ NH3 + H2O + CO2 → NH4HCO3.
Hợp chất mạch hở X, có công thức phân tử C4H8O3. Khi cho X tác dụng với dung dịch NaOH đun nóng, thu được muối Y và ancol Z. Ancol Z hòa tan được Cu(OH)2. Số đồng phân cấu tạo thỏa mãn điều kiện trên của X là:
Có 3 chất thỏa mãn đó là:
HCOO–CH2–CH(OH)–CH3 || CH3COO–CH2–CH2–OH || HCOO–CH–(CH2OH)–CH3
Cho các dung dịch: CH3COOH, C2H4(OH)2, C3H5(OH)3, glucozơ, saccarozơ, C2H5OH, anbumin (có trong lòng trắng trứng). Số dung dịch phản ứng được với Cu(OH)2 là:
Số dung dịch tác dụng với Cu(OH)2 gồm:
CH3COOH, C2H4(OH)2, C3H5(OH)3, glucozo, saccarozo và anbumin.
Một dung dịch X chứa 0,01 mol Ba2+, 0,01 mol NO3–, a mol OH–, b mol Na+. Để trung hòa lượng dung dịch X này cần dùng 400 ml dung dịch HCl có pH = 1. Khối lượng chất rắn thu được sau khi cô cạn dung dịch X nói trên là
Số mol nHCl = 0,04 mol ⇒ nOH– = 0,04 mo.
⇒ Bảo toàn điện tích ta có: nNa+ = 0,03 mol.
⇒ Chất rắn thu được khi cô cạn dd X = 0,01×137 + 0,01×62 + 0,04×17 + 0,03×23 = 3,36 gam.
Đốt cháy hoàn toàn hỗn hợp X gồm các chất có công thức phân tử CH2O, CH2O2, C2H2O2 đều có cấu tạo mạch hở và có số mol bằng nhau thu được CO2, H2O. Hấp thụ hết sản phẩm cháy bằng nước vôi trong dư, sau phản ứng thấy khối lượng dung dịch giảm 17,0 gam so với khối lượng nước vôi trong ban đầu. Cho lượng hỗn hợp X như trên tác dụng với lượng dư dung dịch AgNO3 trong NH3 thì thu được tối đa m gam Ag. Giá trị của m là:
Vì 3 chất có số mol bằng nhau nên xem hh chỉ chứa 1 chất là \({C_{\frac{4}{3}}}{H_2}{O_{\frac{5}{3}}}:a\left( {mol} \right)\)
Ta có: mDung dịch giảm = mCaCO3 – mCO2 – mH2O.
17 = \(\frac{{4a}}{3}\)×100 – \(\frac{{4a}}{3}\)×44 – 18a => a = 0,3.
⇒ nHCHO = nHCOOH = n(CHO)2 = 0,3÷3 = 0,1 mol.
⇒ ∑nAg = 0,1×(4 + 2 + 4) = 1 mol ⇒ mAg = 108 gam
Hỗn hợp M gồm một este no đơn chức mạch hở và hai amin no, đơn chức mạch hở X và Y là đồng đẳng kế tiếp nhau (MX < MY). Đốt cháy hoàn toàn một lượng M cần dùng vừa đủ 0,225 mol O2, thu được H2O, N2 và 0,12 mol CO2. Công thức phân tử của Y là:
Bảo toàn O: 2nEste + 2nO2 = 2nCO2 + nH2O
→ nH2O > nO2 - 2nCO2 = 0,21
→ nAmin = (nH2O - nCO2)/1,5 > 0,06
→ nM = nAmin + nEste > 0,06
→ Số C = nCO2/nM < 2
Do este ít nhất 2C nên X là CH5N và Y là C2H7N
Cho Zn tới dư vào dung dịch gồm HCl ; 0,05 mol NaNO3 và 0,10 mol KNO3. Sau khi kết thúc các phản ứng thu được dung dịch X chứa m gam muối; 0,125 mol hỗn hợp khí Y gồm hai khí không màu, trong đó có một khí hóa nâu trong không khí. Tỉ khối của Y so với H2 là 12,2. Giá trị gần nhất của m là:
Khí không màu hóa nâu trong kk là NO. Vì tỷ khối của 2 khí là 24,4 nên có 1 khí là H2
\({n_{{H_2}}} = a,\,\,{n_{NO}} = b \to a + b = 0,125,\,\,\,2a + 30b = 3,05 \to a = 0,025,\,\,b = 0,1\)
Vì tạo khí H2 nên NO3– phản ứng hết
\({n_{NO_3^ - }} = 0,15 \to N{H_4}Cl:0,05 \to {n_{Zn}} = \frac{{0,025.2 + 0,1.3 + 0,05.8}}{2} = 0,375\)
⇒ mMuối = mZnCl2 + mNH4Cl + mNaCl + mKCl = 64,05 gam
Hỗn hợp M gồm một peptit X và một peptit Y (mỗi peptit được cấu tạo từ một loại amino axit, tổng số nhóm -CO-NH- trong hai phân tử X và Y là 5) với tỉ lệ số mol nX : nY = 1:3. Khi thủy phân hoàn toàn m gam M thu được 81 gam glyxin và 42,72 gam alanin. m có giá trị là;
biến đổi M về 1 peptit mạch dài: 1X + 3Y → 1Z + 3H2O.
Lại có: thủy phân Z cho 1,08 mol Gly + 0,48 mol Ala. Tỉ lệ ngly ÷ nala = 9 ÷ 4.
∑liên kết peptit = 5 nên tối đa α-amino axit cần để tạo Z là 1 × (1 + 1) + 3 × (4 + 1) = 17.
||→ tạo 1 mol Z là từ 9 mol Gly + 4Ala – 12H2O (nếu 18 + 6 thì > 17 rồi).
Kết hợp lại: 1X + 3Y → 9Gly + 4Ala – 9H2O ||→ nH2O = 1,08 mol
||→ BTKL có mM = mX + mY = 81 + 42,72 – 1,08 × 18 = 104,28 gam.
Hòa tan hoàn toàn 42,90 gam Zn trong lượng vừa đủ V mol dung dịch HNO3 10% (d = 1,26 g/ml), sau phản ứng thu được dung dịch A chứa 129,54 gam hai muối tan và 4,032 lít (ở đktc) hỗn hợp 2 khí NO và N2O. Giá trị của V là:
nZn = nZn(NO3)2 = 0,66 mol ⇒ mZn(NO3)2 = 124,74 gam.
⇒ mNH4NO3 = 4,8 gam ⇒ nNH4NO3 = 0,06 mol.
+ Đặt số mol NO = a và nN2O = b ta có:
+ PT theo số mol hỗn hợp khí: a + b = 0,18 (1).
+ PT theo bảo toàn e: 3a + 8b + 0,06×8 = 0,66×2 (2).
+ Giải hệ (1) và (2) ta có nNO = 0,12 và nN2O = 0,08 mol.
⇒ ∑nHNO3 pứ = 0,12×4 + 0,06×10 + 0,06×10 = 1,68 mol.
⇒ mHNO3 = 105,84 gam ⇒ mDung dịch HNO3 = 1058,4 gam.
⇒ V = 1058,4 ÷ 1,26 = 840 ml
Hỗn hợp X gồm hai chất hữu cơ no, mạch hở (đều chứa C, H, O), trong phân tử mỗi chất có hai nhóm chức trong số các nhóm –OH, –CHO, –COOH. Cho m gam X phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 4,05 gam Ag và 1,86 gam muối amoni hữu cơ. Cho toàn bộ lượng muối amoni hữu cơ vào dung dịch NaOH (dư, đun nóng), thu được 0,02 mol NH3. Giá trị của m là
Có nAg = 0,0375 mol → nCHO = 0,01875 mol
Có nRCOONH4 = nNH3 = 0,02 mol → MRCOONH4 = 1,86 : 0,02 = 91 ⇒ MR = 31 ( HO-CH2)
Vì mỗi chất trong X đều chứa hai nhóm chức trong số các nhóm –OH, –CHO, –COOH
⇒ X gồm HO-CH2-CHO : 0,01875 mol và HO-CH2-COOH:
( 0,02 - 0,01875) = 1,25. 10-3 mol
⇒ m = 0,01875. 60 + 1,25. 10-3 . 76 = 1,22 gam.
Cho hai bình điện phân, bình (I) đựng 20 ml dung dịch NaOH 1,73 M; bình (2) đựng dung dịch gồm 0,225 mol Cu(NO3)2 và 0,2 mol HCl. Mắc nối tiếp bình (1) và bình (2). Điện phân các dung dịch bằng dòng điện một chiều với cường độ dòng điện không đổi một thời gian. Khi dừng điện phân, tháo ngay catot ở các bình. Sau phản ứng thấy nồng độ NaOH ở bình (1) là 2M. Cho tiếp 14 gam bột Fe vào bình (2) đến khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn không tan. Biết NO là sản phẩm khử duy nhất của N+5 .Giá trị m là:
Ở đây có dùng một kiến thức vật lí: mắc nối tiếp nên hai bình điện phân cùng I.
• bình (1): giải điện phân NaOH → có thể coi là quá trình điện phân H2O
từ CM (NaOH) → nH2O bị điện phân = 0,15 mol ⇄ ne trao đổi = 0,3 mol.
• dùng giả thiết ne trao đổi trên: có điện phân bình (2) ra: 0,1 mol CuCl2 + 0,05 mol CuO.
||→ bảo toàn gốc NO3 đọc ra dd sau điện phân gồm 0,075 mol Cu(NO3)2 và 0,3 mol HNO3.
Quy về giải 0,25 mol Fe + 0,075 mol Cu(NO3)2 + 0,3 mol HNO3 → ? gam chất rắn không tan.!
Giải: m gam chất rắn gồm 0,075 mol Cu và 0,0625 mol Fe ⇄ m = 8,3 gam.
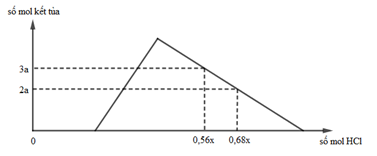
Hỗn hợp X gồm Al, Ca, Al4C3 và CaC2. Cho 40,3 gam X vào nước dư, chỉ thu được dung dịch Y và hỗn hợp khí Z (C2H2, CH4, H2). Đốt cháy hết Z thu được 20,16 lít khí CO2 (đktc) và 20,7 gam H2O. Nhỏ từ từ V lít dung dịch HCl xM vào Y, được biểu diễn theo hình vẽ:
Giá trị của x gần nhất với
Quy X về Al, Ca và C. Dễ thấy C kiểu gì cũng đi hết vô khí và khi đốt khí thì đi vào CO₂
⇒ nC = nCO₂ = 0,9 mol
Đặt nAl = m; nCa = n ⇒ mX = 27m + 40n + 0,9 × 12 = 40,3(g)
BTNT(O) ⇒ nO₂ = 1,475 mol. BT electron: 3m + 2n + 0,9 × 4 = 1,475 × 4
⇒ giải hệ cho: m = 0,5 mol; n = 0,4 mol
Dễ thấy Y gồm Ca²⁺, AlO₂⁻, OH⁻ ⇒ nCa²⁺ = 0,4 mol; nAlO₂⁻ = 0,5 mol. BTĐT:
nOH⁻ = 0,3 mol
Nhìn đồ thị ⇒ cả 2TH trên thì HCl đều dư và hòa tan 1 phần ↓
⇒ ta có CT: nH⁺ = 4nAlO₂⁻ – 3n↓ (với H⁺ chỉ tính phần pứ với AlO₂⁻ và Al(OH)₃)
Áp dụng: (0,56x – 0,3) = 4 × 0,5 – 3 × 3a và (0,68x – 0,3) = 4 × 0,5 – 3 × 2a
⇒ giải hệ có: x = 2,5; a = 1 ||⇒ chọn C
Cho 11,2 lít hỗn hợp X gồm axetilen và anđehit axetic (ở đktc) qua dung dịch AgNO3/NH3 dư. Sau khi phản ứng hoàn toàn thu được 112,8 gam kết tủa. Dẫn lượng hỗn hợp X như trên qua dung dịch nước brom dư, khối lượng brom tham gia phản ứng là (giả sử lượng axetilen phản ứng với nước là không đáng kể).
\(\Rightarrow \left\{ \begin{array}{l}
x + y = \frac{{11,2}}{{22,4}} = 0,5\,\,mol\\
{m_ \downarrow } = {m_{A{g_2}{C_2}}} + {m_{Ag}} = 240x + 108.2y = 112,8\,gam
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
x = 0,2\\
y = 0,3
\end{array} \right.\)
\(\Rightarrow {n_{B{r_2}}} = 2x + y = 0,7\,mol \Rightarrow {m_{B{r_2}}} = 160.0,7 = 112\,gam\)
Cho m kg một loại quặng apatit (chứa 93% khối lượng Ca3(PO4)2, còn lại là tạp chất trơ không chứa photpho) tác dụng vừa đủ với H2SO4 đặc để sản xuất supephotphat đơn. Độ dinh dưỡng của supephotphat thu được sau khi làm khô hỗn hợp sau phản ứng là:
Giả sử có 100 gam quặng → mCa3(PO4)2 = 93 gam.
Ca3(PO4)2 + 2H2PO4 → Ca(HPO4)2 + 2 CaSO4 <=> P2O5
310-----------2 x 98------------------------------------142
93--------------x----------------------------------------y
\(\Rightarrow x = \frac{{93 \times 2 \times 98}}{{310}} = 58,8\,gam;\,\,y = \frac{{93 \times 142}}{{310}} = 42,6\,gam\)
\(\Rightarrow \% {P_2}{O_5} = \frac{{42,6}}{{100 + 58,8}} \approx 26,83\% \)