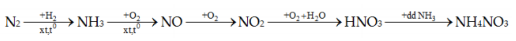Đề thi thử THPT QG môn Hóa học năm 2019 - Trường THPT Chuyên Nguyễn Quang Diêu- Đồng Tháp lần 1
Đề thi thử THPT QG môn Hóa học năm 2019 - Trường THPT Chuyên Nguyễn Quang Diêu- Đồng Tháp lần 1
-
Hocon247
-
40 câu hỏi
-
90 phút
-
19 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Cho 3,36 lít khí CO (đktc) phản ứng vừa đủ với 20 gam hỗn hợp X gồm CuO và MgO. Phần trăm khối lượng của MgO trong X là
nCO = nCuO = 0,15 mol
mMgO = 20 - mCuO = 8 gam
%MgO = 40%
Cho các nhận định sau:
(a) Ở điều kiện thường, trimetylamin là chất lỏng, tan tốt trong nước.
(b) Ở trạng thái kết tinh, các amino axit tồn tại ở dạng ion lưỡng cực.
(c) Polipeptit gồm các peptit có từ 2 đến 10 gốc α-amino axit và là cơ sở tạo nên protein.
(d) Dung dịch anilin trong nước làm xanh quỳ tím.
Số nhận định đúng là:
(a) Sai, trimetylamin là chất khí trong điều kiện thường.
(b) Đúng
(c) Sai, 2 đến 10 gốc là oligopeptit.
(d) Sai, anilin có tính bazo nhưng rất yếu.
Cho các phát biểu sau:
(a) Điện phân dung dịch NaCl (điện cực trơ, có màng ngăn) thu được khí H2 ở anot.
(b) Cho a mol bột Fe vào lượng dư dung dịch AgNO3 (phản ứng hoàn toàn) thu được 2a mol Ag.
(c) Nhúng thanh Zn vào dung dịch chứa CuSO4 và H2SO4 thì Zn bị ăn mòn điện hóa.
(d) Cho dung dịch FeCl3 tác dụng với dung dịch AgNO3 dư, chất rắn thu được gồm AgCl và Ag.
Số phát biểu đúng là:
(a) Sai, thu được H2 ở catot.
(b) Sai, thu được 3a mol Ag.
(c) Đúng, cặp điện cực Zn - Cu.
(d) Sai, chỉ thu được AgCl
Cho các phản ứng sau:
(a) NaOH + HClO → NaClO + H2O
(b) Mg(OH)2 + 2HCl → MgCl2 + 2H2O
(c) 3KOH + H3PO4 → K3PO4 + 3H2O
(d) Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
Số phản ứng có cùng phương trình ion rút gọn H+ + OH- → H2O là:
(a) OH- + HClO → ClO- + H2O
(b) Mg(OH)2 + 2H+ → Mg2+ + 2H2O
(c) 3OH- + H3PO4 → PO43- + 3H2O
(d) H+ + OH- → H2O
Cho 21,9 gam lysin tác dụng hoàn toàn với dung dịch NaOH dư thu được m gam muối. Giá trị của m là:
nLysNa = nLys = 21,9/146 = 0,15 mol
→ mLysNa = 25,2 gam
Cho m gam hỗn hợp X gồm ba este (chỉ chứa chức este, không có nhóm chức khác) tác dụng tối đa với 525 ml dung dịch NaOH 1M, thu được hỗn hợp Y gồm hai ancol đơn chức cùng dãy đồng đẳng và 42,9 gam hỗn hợp muối Z. Đốt cháy hoàn toàn Y thu được 6,72 lít CO2 (đktc) và 9,45 gam H2O. Già trị của m là:
Đốt ancol → nCO2 = 0,3 mol, nH2O = 0,525
→ nAncol = nH2O - nCO2 = 0,225
Số C = nCO2/nAncol = 1,333
→ Ancol chứa CH3OH
→ Các ancol đều no, đơn chức, mạch hở.
→ nNaOH phản ứng với chức este của ancol = nO (Ancol) =0,225
mAncol = mC + mH + mO = 8,25 gam
nNaOH phản ứng với chức este của phenol = 0,525 - 0,225 = 0,3
→ nH2O = 0,15 mol
BTKL: mX + mNaOH = m muối + m ancol + mH2O
→ mX = 32,85 gam
Để hòa tan hết 5,46 gam Fe cần ít nhất V ml dung dịch hỗn hợp H2SO4 0,3M và Fe(NO3)3 0,04M. Biết sản phẩm khử của N+5 là NO duy nhất. Giá trị của V là:
nFe = 0,0975 mol
nH2SO4 = 0,3V và nFe(NO3)3 = 0,04V
→ nH+ = 0,6V và nNO3- = 0,12V
Dễ thấy nH+ > 4nNO3- nên tại thời điểm NO3- hết thì H+ vẫn còn, vậy có thêm cả H2.
nNO = 0,12V, nH+ dư = 0,6V - 4nNO = 0,12V
Bảo toàn electron: 2nFe = 3nNO + nH+ + nFe3+
→ 0,0975.2 = 3.0,12V + 0,12V + 0,04V
→ V = 0,375 lít = 375 ml
Thực hiện các thí nghiệm sau, phản ứng xảy ra hoàn toàn:
(a) Dẫn a mol khí CO2 vào 0,8a mol Ca(OH)2 trong dung dịch.
(b) Cho a mol Fe vào 3a mol HNO3 trong dung dịch (sản phẩm khử duy nhất tạo ra là NO).
(c) Cho dung dịch NaHCO3 đến dư vào dung dịch Ba(OH)2.
(d) Cho bột Cu vào dung dịch FeCl3 dư.
Số thí nghiệm thu được dung dịch chứa 2 muối là:
(b), (c)
Cho 26,03 gam Ba vào 100 ml dung dịch chứa Al2(SO4)3 0,5M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Phát biểu nào sau đây đúng?
nBa = 0,19 mol, nAl2(SO4)3 = 0,05 mol
nBa2+ = 0,19 mol và nSO42- = 0,15 mol → nBaSO4 = 0,15 mol
nOH- = 0,38 và nAl3+ = 0,1 → nAl(OH)3 = 0,02 mol
→ m kết tủa = 36,51 gam
nH2 = nBa = 0,16 mol
Độ biến thiên khối lượng = mBa - m kết tủa - mH2 = -10,86 gam
Vậy khối lượng dung dịch giảm 10,86 gam
Đốt cháy hoàn toàn 0,08 mol hỗn hợp X gồm (C2H2, C2H4, CH4 và C3H6) thu được 0,14 mol CO2 và 0,17 mol H2O. Mặt khác, cho 2,525 gam X phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
Số C = nCO2/nX = 1,75
Số H = 2nH2O/nX = 4.25
→ Độ không no k = (2C + 2 - H)/2 = 0,625
mX = mC + mH = 2,02 và nBr2 = knX = 0,05
Tỉ lệ: 2,02 gam X làm mất màu hết 0,05 mol Br2
→ 2,525 gam X làm mất màu hết a mol Br2
→ a = 0,0625
Hỗn hợp X gồm glyxin, valin, lysin và axit glutamic (trong X tỉ lệ khối lượng của nitơ và oxi l{ 7 : 15). Cho 7,42 gam X tác dụng vừa đủ với dung dịch HCl, thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ với dung dịch chứa 0,08 mol NaOH và 0,075 mol KOH, cô cạn dung dịch sau phản ứng thu được m gam muối khan. Giá trị m là
mN : mO = 7 : 15 → nN : nO = 8 : 15
Đặt nN = 8x → nO = 15x
nHCl = nN = 8x và nCOOH = nO/2 = 7,5x
nOH- = nHCl + nCOOH
→ 0,08 + 0,075 = 8x + 7,5x → x = 0,01
nH2O = nOH- = 0,155
BTKL: mX + mHCl + mNaOH + mKOH = m muối + mH2O
→ m muối = 14,95 gam
Điện phân (với điện cực trơ, màng ngăn) dung dịch chứa hỗn hợp CuSO4 và NaCl (trong đó số mol NaCl gấp 4 lần số mol CuSO4) bằng dòng điện một chiều có cường độ ổn định. Sau t giờ thu được dung dịch X và sau 2t giờ thu được dung dịch Y. Dung dịch X tác dụng với bột Al dư thu được 1,5a mol khí H2. Dung dịch Y t|c dụng với bột Al dư thu được 12a mol khí H2. Hiệu suất điện phân 100%, các phản ứng xảy ra hoàn toàn và các khí không tan trong nước. Phát biểu nào dưới đây đúng?
nCuSO4 = x, nNACl = 4x, tự chọn a = 1 mol
Do nNa+ > 2nSO42- nên các dung dịch X, Y đều có OH- hoàn tan Al tạo ra H2
Thời điểm t giây:
Al + X → nH2 = 1,5 → nOh- = 1 v nH2 ở catot = 0,5
Catot: nCu = x và nH2 = 0,5
BTDT → nCl2 = x + 0,5
Thời điểm 2t giây:
Al + Y → nH2 = 12 → nOH- = 8
Catot: nCu = x và nH2 = x + 1
Lúc này nếu anot chưa có O2 thì nCL2 = 2x + 1 : Vô lý, vì nCl- = 4x. Vậy anot đã có O2
Y chứa SO42- (x), Na+ (4x) và OH-(8). Bảo toàn điện tích → x = 4
A. Sai:
ne trong t giây = 2x + 1 = 9 → ne trong 0,85 giây = 0,85.9 = 7,65
nCu2+ = 4 nên Cu2+ chưa bị điện phân hết, không có H2 thoát ra.
B. Sai:
tại 2t giờ:
Catot: nCu = x = 4 và nH2 = x + 1 = 5
Anot: nCl2 = 2x = 8 → nO2 = 0,5
→ n khí tổng =13,5
C. Đúng
ne trong 1,8t giờ = 1,8.9 = 16,2
nCl2 = 8 → nO2 = 0,05 mol
D. Sai
Tại t giờ tại anot nCl2 = x + 0,5 = 4,5
Hỗn hợp E gồm ba este X, Y, Z (đều mạch hở, chỉ chứa một loại nhóm chức, trong phân tử mỗi este có số liên kết pi không quá 3, MX < MY < MZ, X chiếm 50% số mol hỗn hợp). Đun nóng 11,14 gam E với dung dịch NaOH vừa đủ, thu được hỗn hợp T gồm các muối và hỗn hợp G chứa ba ancol đều no. Tỉ khối hơi của G so với H2 bằng 28,75. Đốt cháy toàn bộ T cần dùng 0,115 mol O2, thu được 9,805 gam Na2CO3 và 0,215 mol hỗn hợp gồm CO2 và H2O. Phần trăm khối lượng của Y trong E là
nNa2CO3 = 0,185 → nNaOH = 0,37
Đặt a, b là số mol CO2 và H2O → a + b = 0,43
Bảo toàn O → 2a + b + 0,185.3 = 0,37.2 + 0,23.2
→ a = b = 0,215
→ Các muối trong Y đều no, đơn chức
BTKL → mY = 25,58
→ mZ = 11,5 → nZ = 0,2
Các ancol và muối đều no nên X gồm các este no, mạch hở, không quá 3 chức.
Quy đổi X thành:
HCOOCH3 : x mol
(HCOO)2C2H4 : y mol
(HCOO)3C3H5 : z mol
CH2 : t mol
nX = x + y + z = 0,2
nY = x + 2y + 3z = 0,37
theo đề: x = y + z → x = 0,1; y = 0,03 và z = 0,07
mX = 22,28 → t = 0,03
Dễ thấy t = y, vậy chỉ có thêm 1 nhóm CH2 trong chất này. Các este gồm: HCOOCH3 : 0,1 mol;
HCOOC2H4OOCCH3 : 0,03 mol → 17,77%
(HCOO)3C3H5: 0,07 mol
Hỗn hợp E gồm X (C7H16O6N2) và Y (C5H14O4N2, là muối của axit cacboxylic hai chức) tác dụng hoàn toàn với dung dịch KOH, thu được ancol etylic, hai amin no, đơn chức, kế tiếp nhau trong dãy đồng đẳng, có tỉ khối so với H2 bằng 16,9 và dung dịch Z. Cô cạn dung dịch Z thu được hỗn hợp T gồm hai muối khan có cùng số nguyên tử cacbon trong phân tử, trong đó có 1 muối của axit cacboxylic và 1 muối của α-amino axit. Phần trăm khối lượng của muối có phân tử khối nhỏ hơn trong T là
M amin = 33,8 → CH3NH2 (4 mol) và C2H5NH2 (1 mol)
→ Y là CH3NH3OOC-COONH3C2H5 ( 1mol)
→ X là CH3NH3OOC-COONH3 - CH2-COO-C2H5 (3mol)
Mươi khan gồm (COOK)2 ( 4mol) và GlyK (3mol)
→ %GlyK = 33,80%
Cho các phát biểu sau:
(a) Thép là hợp kim của sắt và cacbon, trong đó có từ 0,01 - 2% khối lượng C.
(b) Bột nhôm trộn với bột Fe2O3 dùng để hàn đường ray bằng phản ứng nhiệt nhôm.
(c) Phèn chua và thạch cao sống có công thức lần lượt là KAl(SO4)2.12H2O và CaSO4.2H2O.
(d) Thạch cao nung dùng để nặn tượng, bó bột khi gãy xương.
(e) Dung dịch Na2CO3, Na3PO4 làm mềm được nước cứng.
(g) Miếng gang để trong không khí ẩm xảy ra ăn mòn điện hóa.
Số phát biểu đúng là:
Tất cả các phát biểu điều đúng
Cho 11,2 gam hỗn hợp X gồm Fe, FeO, Fe2O3, CuO vào dung dịch HCl, thu được chất rắn Y (chỉ chứa một kim loại), dung dịch Z chỉ chứa muối và 448 ml H2 (đktc). Cho lượng Y này phản ứng với dung dịch HNO3 dư, đậm đặc, đun nóng thu được 896 ml khí NO2 (đktc, sản phẩm khử duy nhất của N+5). Cho dung dịch Z trên vào dung dịch AgNO3 dư, thu được 53,14 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Khối lượng CuO trong X là
Y là Cu
nNO2 = 0,04 → nCu = 0,02
Dung dịch Z chứa FeCl2 (u) và CuCl2 (v)
→ nHCl = 2u + 2v
Bảo toàn H: nHCl = 2nH2 + 2nH2O
→ nO = nH2O = u + v - 0,02
mX = 56u + 64(v +0,02) + 16 (u + v - 0,02) = 11,2
m kết tủa = 143,5 (2u + 2v) + 108u = 53,14
→ u = 0,12 và v = 0,02
Bảo toàn Cu → nCuO = 0,04
→ mCuO = 3,2 gam