Đề thi thử THPT QG môn Hóa học năm 2019 - Trường THPT Nguyễn Khuyến
Đề thi thử THPT QG môn Hóa học năm 2019 - Trường THPT Nguyễn Khuyến
-
Hocon247
-
40 câu hỏi
-
90 phút
-
42 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Giải pháp thực tế và ứng dụng nào sau đây không hợp lý?
Dùng nước muối ăn (NaCl) rửa vết thương do kiến cắn → Sai
Đáp án B
Cho 50,0 gam hỗn hợp X gồm Fe3O4, Cu và Mg vào dung dịch HCl loãng dư, sau phản ứng được 2,24 lít H2 (đktc) và còn lại 18,0 gam chất rắn không tan. Phần trăm khối lượng Fe3O4 trong X là:
nMg = nH2 = 0,1 mol
Đặt a, b là số mol Fe3O4, Cu đã phản ứng:
mX = 232a + 64b + 24.0,1 + 18 = 50 gam
Bảo toàn electron → 2a = 2b
→ a = b = 0,1
→ % Fe3O4 = 46,4%
Dung dịch có môi trường kiềm là:
Dung dịch có môi trường kiềm là NaHCO3.
Đáp án B
Ở nhiệt độ cao, lưu huỳnh (dư) oxi hóa được các kim loại nào sau đây về số oxi hóa +3?
Lưu huỳnh (dư) oxi hóa được Al, Cr về số oxi hóa +3
Đáp án C
Cho các chất đơn chức có công thức phân tử C3H6O2 lần lượt phản ứng với Na, NaOH, NaHCO3. Số phản ứng có thể xảy ra là:
C2H5COOH: Phản ứng với cả 3 chất Na, NaOH, NaHCO3,
CH3COOCH3: Phản ứng với NaOH.
HCOOC2H5: Phản ứng với NaOH.
Tổng có 5 phản ứng.
Chia m gam hỗn hợp X gồm Zn, Al, Mg thành 2 phần bằng nhau:
- Phần 1 cho vào dung dịch HCl dư thu được 1,344 lít H2 (đktc).
- Phần 2 nung trong không khí đến khối lượng không đổi thu được 3,04 gam chất rắn.
Giá trị của m là:
Phần 1: nH2 = 0,06 mol
Phần 2: Bảo toan electron → nO = 0,06 mol
→ m/2 = 3.04 - 0.06.16 → m = 4,16 gam
Chất nào sau đây không có tính lưỡng tính?
Chất lưỡng tính phản ứng được với cả axit lẫn bazo
Phát biểu nào sau đây là sai?
Cr2O3 là oxit lưỡng lính, tác dụng được với dung dịch NaOH loãng và dung dịch HCl loãng → Sai
Đáp án C
Căng da mặt bằng chỉ vàng 24K (Gold thread lift) là một phương pháp thẩm mỹ sử dụng những sợi chỉ vàng gần như tinh khiết 100% có độ dày siêu mảnh 0,1mm để cấy vào da mặt ở tầng sâu của biểu bì, tạo thành một mạng lưới khung đỡ vững chắc, có tác dụng nâng cơ mặt tức thì, giảm nhăn, ngăn ngừa da chảy xệ, giúp trông trẻ trung hơn. Ngoài ra, sự xuất hiện của các sợi lạ dưới da, tạo các “tổn thương giả tạo” giúp tăng sinh collagen và elastine làm cho vùng da trở nên săn chắc hơn. Tính chất vật lí nào sau đây của kim loại giúp vàng có thể kéo thành những sợi chỉ có độ dày siêu mảnh để sử dụng trong phương pháp thẩm mỹ trên?
Vàng có thể kéo thành những sợi chỉ có độ dày siêu mảnh để sử dụng trong phương pháp thẩm mỹ trên là nhờ tính dẻo.
Thực hiện các thí nghiệm sau:
(a) Cho Na vào H2O.
(b) Cho Ag vào dung dịch H2SO4 loãng.
(c) Cho Zn vào dung dịch HCl.
(d) Cho Cu vào dung dịch AgNO3.
(e) Cho Al vào dung dịch HNO3 đặc, nguội.
Trong các thí nghiệm trên, số thí nghiệm xảy ra phản ứng là:
Các thí nghiệm xảy ra phản ứng là: (a), (c), (d).
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau:
Đáp án C
X + NaHCO3 → Khí ⇒ X là axit ⇒ Loại A.
X có phản ứng tráng gương ⇒ Loại D.
T có pứ màu biure ⇒ T không thể là đipeptit ⇒ Loại B.
Phát biểu nào sau đây không đúng?
Phenol có tính axit nên làm quỳ tím hóa đỏ → Sai
Đáp án A
Norađrenalin có vai trò quan trọng trong truyền dẫn xung thần kinh. Ađrenalin là hormon tuyến thượng thận có tác dụng làm tăng huyết áp.
.png)
Bậc của amin trong Norađrenalin và Ađrenalin lần lượt là:
Bậc của amin trong Norađrenalin và Ađrenalin lần lượt là 1 và 2
Đáp án D
Phản ứng điều chế kim loại nào sau đây thuộc phản ứng thủy luyện?
Fe + CuSO4 → FeSO4 + Cu
Đáp án D
Cho các phát biểu sau:
(a) Các hợp chất hữu cơ nhất thiết phải chứa nguyên tố cacbon và hiđro.
(b) Khi đun chất béo với dung dịch NaOH thị tạo ra sản phẩm hòa tan được Cu(OH)2.
(c) Mỡ bị ôi là do liên kết C=C của gốc axit béo bị oxi hóa chậm bởi oxi không khí.
(d) Xenlulozơ chỉ có cấu tạo mạch không phân nhánh.
(e) Chất béo nhẹ hơn nước nước, không tan trong nước nhưng tan nhiều trong dung môi hữu cơ
không cực.
(f) Cho glyxylalanin vào Cu(OH)2 thấy tạo phức màu tím đặc trưng.
Số phát biểu đúng là:
Các phát biểu đúng là: (b), (c), (d), (e).
Xét sơ đồ chuyển hóa: Glyxin + HCl → X; X + NaOH → Y. Y là chất nào sau đây?
Ta có Glyxin là H2NCH2COOH → X là ClH3NCH2COOH → Y là H2NCH2COONa.
Cho x mol bột Fe vào dung dịch chứa y mol FeCl3 và z mol HCl, sau khi kết thúc phản ứng thu được dung dịch X và còn lại t mol kim loại không tan. Biểu thức liên hệ x, y, z, t là:
nFe phản ứng = x - t
nH2 = z/2
Bảo toàn electron: 2(x-t) = y +2z/2 → 2x = y + z + 2t
Cho a gam dung dịch chứa chất X tác dụng vừa đủ với a gam dung dịch chứa chất Y, thu được 2a gam dung dịch chứa một muối Z duy nhất. Cho dung dịch HNO3 loãng dư vào Z, thấy khí không màu thoát ra. Chất X và Y là:
mddX + mddY = mddZ → Phản ứng không tạo chất khí và kết tủa.
Z chứa một chất duy nhất và có phản ứng với HNO3 tạo khí không màu → X,Y là NaOH và NaHCO3 và Z là Na2CO3
Công thức của polime nào sau đây là phù hợp nhất được sử dụng để sản xuất cái cốc ở hình bên?
.png)
(C6H10O5)n.
Đáp án B
R là kim loại tác dụng được với dung dịch muối Fe(NO3)3, M là kim loại phản ứng được với dung dịch H2SO4 loãng. Hai kim loại R và M theo thứ tự lần lượt là:
Hai kim loại R và M theo thứ tự lần lượt là Cu, Fe.
Đáp án C
Cho quỳ tím lần lượt vào các dung dịch sau: Valin, axit glutamic, glyxin, alanin, lysin. Số dung dịch làm đổi màu quỳ tím là:
Chỉ có axit glutamic và lysin.
Đáp án B
Phát biểu nào sau đây là đúng?
Trong ăn mòn điện hóa học, xảy ra sự oxi hóa ở cực âm và sự khử ở cực dương.
Đáp án A
Mưa axit tàn phá thảm thực vật, phá hủy các công trình được xây dựng bằng đá, thép. Một trong những khí chủ yếu gây mưa axit là:
Mưa axit tàn phá thảm thực vật, phá hủy các công trình được xây dựng bằng đá, thép. Một trong những khí chủ yếu gây mưa axit là SO2
Đáp án A
Chất nào sau đây là chất điện li yếu?
- Chất điện li yếu:
+ Axit yếu (H2S, CH3COOH, HF,...)
+ Bazơ yếu (Mg(OH)2,....)
+ Muối HgCl2, Hg(CN)2,...
Cho các phát biểu sau:
(a) Amilopectin trong tinh bột chỉ có các liên kết α-1,4-glicozit.
(b) Ở điều kiện thường, glucozơ và saccarozơ đều là những chất rắn, dễ tan trong nước.
(c) Thủy phân tinh bột thu được fructozơ và glucozơ.
(d) Đa số polime đều tan trong các dung môi thông thường.
(e) Trong công nghiệp dược phẩm, saccarozơ được dùng để pha chế thuốc.
Trong các phát biểu trên, số phát biểu đúng là:
Chọn đáp án B
Amilopectin trong tinh bột gồm liên kết α-1,4-glicozit và α-1,6-glicozit → (a) sai
Ở điều kiện thường, glucozơ và saccarozơ đều là những chất rắn, dễ tan trong nước. → (b) đúng
Thủy phân tinh bột thu được glucozơ → (c) sai
Đa số polime đều không tan trong các dung môi thông thường → (d) sai
Trong công nghiệp dược phẩm, saccarozơ được dùng để pha chế thuốc → (e) đúng
Đốt cháy kim loại X trong oxi thu được oxit Y. Hòa tan Y trong dung dịch HCl loãng dư, thu được dung dịch Z chứa hai muối. Kim loại X là
X là Fe, Y là Fe3O4, Z chứa FeCl2, FeCl3
Fe + O2 → Fe3O4
Fe3O4 + HCl → FeCl2 + FeCl3 + H2O
Khẳng định nào sau đây không đúng?
Trong cùng chu kỳ, kim loại có bán kính nguyên tử nhỏ hơn phi kim.
Đáp án D
Ure, (NH2)2CO là một loại phân bón hóa học quan trọng và phổ biến trong nông nghiệp. Ure thuộc loại phân bón hóa học nào sau đây?
Ure thuộc loại phân đạm
Đáp án C
Cho 0,1 mol axit α-amino propionic tác dụng vừa đủ với dung dịch HCl, thu được dung dịch X. Cho X tác dụng với 200 ml dung dịch NaOH 1M, thu được dung dịch chứa m gam muối. Giá trị của m là:
nHCl = 0,1 mol
Muối thu được gồm NaCl (0,1 mol), AlaNa (0,1 mol)
→ m muối = 16,95 gam
Cho 2,24 lit axetilen (đktc) tác dụng với AgNO3 dư trong dung dịch NH3, sau phản ứng hoàn toàn thu được m gam chất rắn. Giá trị của m là:
nC2H2 = nC2Ag2 = 0,1 mol
⇒ mC2Ag2 = 24 gam
Phát biểu không đúng là:
Triglyxerit là hợp chất cacbohiđrat → Sai → Đáp án C
Kim loại M phản ứng được với: dung dịch HCl, dung dịch Cu(NO3)2, dung dịch HNO3 (đặc, nguội). Kim loại M là:
Ag không tác dụng với HCl → loại C
Fe, Al không tác dụng với HNO3 đặc nguội → loại A, B
Hợp chất hữu cơ X mạch hở có công thức phân tử C7H8O4. Thủy phân hoàn toàn X trong dung dịch NaOH đun nóng, thu được muối Y và hai chất hữu cơ Z và T (thuộc cùng dãy đồng đẳng). Axit hóa Y, thu được hợp chất hữu cơ E (chứa C, H, O). Phát biểu nào sau đây không đúng?
Các phát biểu:
X có k = 3, từ các dữ kiện ta được X là C2H5OOC-C2H2-COOCH3
- A. Đúng, X có hai đồng phân cấu tạo là R-CH=CH-R’ và CH2=C(RR’)
- B. Sai, E là C2H2(COOH)2, tác dụng với Br2/CCl4 theo tỉ lệ mol 1 : 1.
- C. Đúng.
- D. Đúng, E có CTPT: C4H4O4
Thực hiện phản ứng este hóa m gam hỗn hợp X gồm etanol và axit axetic (xúc tác: H2SO4 đặc) với hiệu suất phản ứng đạt 80%, thu được 7,04 gam etyl axetat. Mặt khác, cho m gam X tác dụng với NaHCO3 dư, thu được 3,36 lít khí CO2 (ở đktc). Giá trị của m là:
nCH3COOH ban đầu = nCO2 = 0,15 mol
nCH3COOC2H5 = 0,08 mol
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
Dễ thấy 0,08/0,15 # 80% nên hiệu suất đã được tính theo C2H5OH
nC2H5OH ban đầu = 0,08/80% = 0,1
m = 13,6 gam
Đốt cháy hoàn toàn 0,1 mol hỗn hợp X chứa trimetylamin và hexametylenđiamin cần dùng 0,715 mol O2, sản phẩm cháy gồm CO2, H2O và N2. Mặt khác cho 24,54 gam X trên tác dụng với dung dịch HCl loãng dư, thu được m gam muối. Giá trị của m là:
X gồm C3H9N (a mol) và C6H16N2 (b mol)
C3H9N + 5,25O2 → 3CO2 + 4,5H2O + 0,5N2
C6H16N2 + 10O2 → 6CO2+ 8H2O + N2
→ nX = a + b = 0,1 mol
và nO2 = 5,25a + 10b = 0,715
→ a = 0,06 và b = 0,04
nHCl = nN = a + 2b = 0,14
mX = 8,18
m muối = mX + mHCl = 13,29
Tỉ lệ:
8,18 gam X + HCl → 13,29 gam muối
24,54 gam X + HCl → m muối = 39,87 gam
Hỗn hợp X chứa chất A (C5H16O3N2) và chất B (C4H12O4N2) tác dụng với dung dịch NaOH vừa đủ, đun nóng cho đến khi phản ứng xảy ra hoàn toàn, rồi cô cạn thu được m gam hỗn hợp Y gồm 2 muối D và E (MD < ME) và 4,48 lít (đktc) hỗn hợp Z gồm 2 amin no, đơn chức, đồng đẳng kế tiếp có tỉ khối so với H2 bằng 18,3. Khối lượng của muối E trong hỗn hợp Y là:
(C2H5NH3)2CO3 + NaOH → 2Na2CO3 + 2C2H5NH2 + 2H2O
(COONH3-CH3)2 + NaOH → (COONa)2 + 2CH3NH2 + 2H2O
Khí Z gồm C2H5NH2 (0,08 mol) và CH3NH2 (0,12 mol)
E là muối (COONa)2 (0,06 mol)
→ mE = 8,04 gam
Để hòa tan hết 38,36 gam hỗn hợp R gồm Mg, Fe3O4, Fe(NO3)2 cần 0,87 mol dung dịch H2SO4 loãng, sau khi các phản ứng xảy ra hoàn toàn thu được 111,46 gam sunfat trung hòa và 5,6 lít (đktc) hỗn hợp khí X gồm hai khí không màu, tỉ khối hơi của X so với H2 là 3,8 (biết có một khí không màu hóa nâu ngoài không khí). Phần trăm khối lượng Mg trong R gần với giá trị nào sau đây?
X gồm NO (0,05) và H2(0,2)
BTKL: nH2O = 0,57
BTNT(H) : nNH4+ = 0,05 mol
BTNT(N): nFe(NO3)2 = 0,05
nH+ = 4nNO + 2nH2 + 10nNH4+ +2nO → nO = 0,32
→ nFe3O4 = 0,08 mol
→ mMg = mR - mFe3O4 - mFe(NO3)2 = 10,8 gam
→ % Mg = 28,15 %
Tiến hành điện phân dung dịch chứa m gam hỗn hợp CuSO4 và KCl. Kết quả quá trình điện phân được biểu diễn trong đồ thị sau:
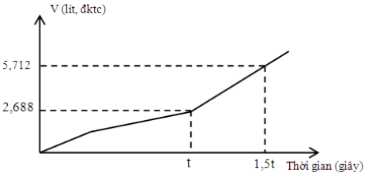
Biết các khí đều đo ở đktc. Giá trị m là:
Tại t(s): khí bắt đầu tăng mạnh hơn ⇒ Cu2+ vừa hết.
⇒ Khí gồm 0,12 mol hỗn hợp Cl2 (x mol) và O2 (y mol).
⇒ ne = (2x + 4y) mol
– Xét tại 1,5t(s): ne = (3x + 6y) mol.
⇒ nO2 = (3x + 6y – 2x) ÷ 4 = (0,25x + 1,5y) mol và nH2 = (0,5x + y) mol
⇒ ∑nkhí = 1,75x + 2,5y = 0,255 mol.
⇒ giải hệ cho: x = y = 0,06 mol ⇒ dung dịch gồm: 0,18 mol CuSO4 và 0,12 mol KCl
⇒ m = 37,74 gam.
Cho m gam hỗn hợp A gồm Al và Fe3O4. Nung A trong khí trơ, nhiêt độ cao để phản ứng xảy ra hoàn toàn thu được hỗn hợp B. Nghiền nhỏ B, trộn đều, chia 2 phần không bằng nhau:
Phần 1 (phần ít): Tác dụng với dung dịch NaOH dư thu được 1,176 lít khí H2. Tách riêng chất không tan đem hòa tan trong dung dịch HCl dư thu được 1,008 lít.
Phần 2 (phần nhiều): Cho tác dụng với dung dịch HCl dư thu được 6,552 lít khí.
Giá trị của m và thành phần % khối lượng của một chất có trong hỗn hợp A gần giá trị nào nhất sau
đây? (các thể tích khí đo ở đktc).
Phần 1: nH2 = 0,0525 → nAl dư = 0,035
Chất rắn không tan là Fe → nFe = nH2 = 0,045
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
vậy phần 1 gồm Al dư (0,035), Al2O3 (0,02), Fe(0,045)
phần 2 gấp k lần phần 1: Al dư (0,035k), Al2O3 (0,02k) và Fe (0,045k)
→ 0,035k.3 + 0,045k.2 = 0,2925.2 → k= 3
mA = m phần 1 + m phần 2 = 4m phần 1 = 22,02
% Fe3O4 = 62,22% và %Al = 76,78%
Nhỏ từ từ V (lít) dung dịch chứa Ba(OH)2 0,5 M vào dung dịch chứa x mol NaHCO3 và y mol BaCl2. Đồ thị sau đ}y biểu diễn sự phụ thuộc giữa lượng kết tủa và thể tích dung dịch Ba(OH)2 như sau:
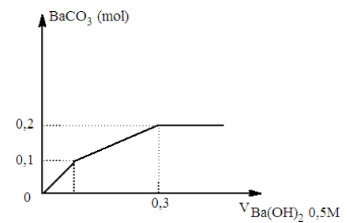
Giá trị của x và y tương ứng là:
Phương trình xảy ra
HCO3- + OH- → CO32- + H2O
CO32- + Ba2+ → BaCO3↓
Tại thời điểm V= 0,3 lít ( Ba(OH)2: 0,15 mol) lượng kết tủa không thay đổi
→ n↓ = nCO32- = 0,2 mol → nNaHCO3 = x = 0,2 mol
Tại thời điểm V = 0,1 lít ( Ba(OH)2: 0,05 mol )
→ n↓ = nBa2+ = 0,1 mol
∑nBa2+ = nBaCl2 + nBa(OH)2
→ nBaCl2 =y = 0,1 - 0,05 = 0,05 mol

