Đề thi thử THPT QG môn Hóa học năm 2019 - Trường THPT Phú Bình - Thái Nguyên
Đề thi thử THPT QG môn Hóa học năm 2019 - Trường THPT Phú Bình - Thái Nguyên
-
Hocon247
-
40 câu hỏi
-
90 phút
-
51 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Trong các chất sau đây chất nào là của chất béo?
Chất béo là hỗn hợp nhiều este của glixerol và các axit béo có công thức là (RCOO)3C3H5.
Trong tự nhiên kim loại nào sau đây cứng nhất?
Trong tự nhiên Crom làm kim loại cứng nhất
Đáp án D
PVC là chất rắn vô định hình, cách điện tốt, bền với axit, được dùng làm vật liệu cách điện, ống dẫn nước, vải che mưa,... PVC được tổng hợp trực tiếp từ monome nào sau đây?
PVC hay Poli (vinyl clorua) là [-CH2-CH(Cl)-]n được điều chế từ monome là vinyl clorua CH2=CH-Cl
⇒ chọn D
Khi phun vào đám cháy chất khí X có tác dụng làm loãng nồng độ hỗn hợp hơi khí cháy, đồng thời làm lạnh vùng cháy dẫn tới triệt tiêu đám cháy. Chất X là
Khi phun vào đám cháy chất khí X có tác dụng làm loãng nồng độ hỗn hợp hơi khí cháy, đồng thời làm lạnh vùng cháy dẫn tới triệt tiêu đám cháy. Chất X là Cacbonic
Đáp án D
X là một kim loại nhẹ, màu trắng bạc, được ứng dụng rộng rãi trong đời sống. X là
X là một kim loại nhẹ, màu trắng bạc, được ứng dụng rộng rãi trong đời sống. X là Al
Đáp án C
Đường saccarozơ (đường kính) có công thức hóa học là
Đường saccarozơ (đường kính) có công thức hóa học là C12H22O11.
Đáp án A
Trong phòng thí nghiệm để bảo quản Na có thể ngâm Na trong:
Trong phòng thí nghiệm để bảo quản Na có thể ngâm Na trong dầu hỏa.
Đáp án B
Benzyl axetat là este có mùi thơm của hoa nhài. Công thức của benzyl axetat là
Benzyl axetat là este có mùi thơm của hoa nhài. Công thức của benzyl axetat là CH3COOCH2C6H5.
Đáp án C
Nhỏ từ từ đến dư dung dịch NaOH vào dung dịch chứa chất tan X. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch trong suốt. Chất tan X có thể là:
Chỉ có AlCl3 thỏa mãn, các chất còn lại thu được kết tủa sau phản ứng:
Al2(SO4)3 + 6NaOH → 2Al(OH)3↓ + 3Na2SO4.
Sau đó: Al(OH)3 + NaOH → NaAlO2 + 2H2O.
Fe(NO3)3 + 3NaOH → Fe(OH)3↓ + 3NaNO3.
Ca(HCO3)2 + 2NaOH → Na2CO3 + CaCO3↓ + 2H2O.
MgSO4 + 2NaOH → Mg(OH)2↓ + Na2SO4.
Hợp chất nào của canxi được dùng để đúc tượng, bó bột khi gãy xương?
Thạch cao nung CaSO4.H2O thường được đúc tượng, đúc các mẫu chi tiết tinh vi dùng trang trí nội thật, làm phấn viết bảng, bó bột khi gãy xương,..
Chọn B
Kim loại nào sau đây không thể điều chế được bằng phản ứng nhiệt nhôm?
Phản ứng nhiệt nhôm là phản ứng dùng Al để khử oxit của những kim loại đứng sau Al trong dãy điện hóa.
Kim loại có thể điều chế được bằng phản ứng nhiệt nhôm là những kim loại đứng sau Al trong dãy điện hóa
Chất nào sau đây là amin bậc 2?
Chỉ có CH3NHC2H5 là amin bậc 2.
→ Chọn đáp án A
Trong số các loại tơ sau: tơ tằm, tơ visco, tơ nilon-6,6, tơ axetat, tơ capron, tơ enang, những loại tơ nào thuộc loại tơ nhân tạo?
Chọn đáp án B
Tơ tằm là tơ tự nhiên.
Tơ nilon-6,6, tơ capron, tơ enang là tơ tổng hợp.
Tơ visco và tơ axetat là tơ bán tổng hợp hay còn gọi là tơ nhân tạo.
Thuỷ phân 324 gam tinh bột với hiệu suất phản ứng là 75%, khối lượng glucozơ thu được là:
(C6H10O5)n + nH2O → nC6H12O6
mC6H12O6 = 2.180.75% = 270 gam
Các este đồng phân ứng với công thức phân từ C8H8O2 (đều là dẫn xuất của benzen) tác dụng với NaOH tạo ra muối và ancol là:
HCOO-CH2-C6H5
C6H5COOCH3
Cho 10 gam amin đơn chức X phản ứng hoàn toàn với HCl (dư), thu được 15 gam muối. Công thức phân tử của X là
nX = nHCl = (15-10)/36,5 = 5/36,5
→ MX = mX/nX = 73: C4H11N
Hình bên minh họa cho thí nghiệm xác định sự có mặt của C và H trong hợp chất hữu cơ.
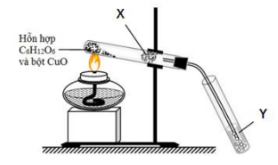
Chất X và dung dịch Y (theo thứ tự) là:
Chất X là CuSO4 khan vì để nhận biết ra có mặt nước,từ đó nhận ra được sự có mặt của H
CuSO4 khan (màu trắng) khi có hơi nước qua sẽ chuyển thành CuSO4.5H2O (màu xanh)
Chất Y là dd Ca(OH)2 để nhận biết được ra sự có mặt của CO2, từ đó nhận ra được sự có mặt của C
Ca(OH)2 khi có CO2 lội qua sẽ bị vẩn đục do xảy ra phản ứng
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Những ion nào sau đây không cùng tồn tại được trong một dung dịch:
Các ion muốn tồn tại trong cùng 1 dung dịch thì không có ion nào trong đó phản ứng với nhau.
Cả A, B, C đều thỏa điều kiện này.
Đáp án cần chọn là D
Đốt nóng một hỗn hợp gồm Al và 16 gam Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng vừa đủ với V ml dung dịch NaOH 1M sinh ra 3,36 lít H2 (ở đktc). Giá trị của V là:
2Al + Fe2O3 → Al2O3 + 2Fe
0,2 0,1
nH2 = 0,15 → nAl dư = 0,1 mol
→ nAl ban đầu = 0,3 mol
→ nNaOH = 0,3 mol
→ V = 300 ml
Trong các dung dịch: CH3CH2NH2, H2NCH2COOH, H2NCH2CH(NH2)COOH, HOOCCH2CH2CH(NH2)COOH. Số dung dịch làm xanh quỳ tím là:
H2N-CH2-COOH không làm đổi mày quỳ
CH3-CH2-NH2,H2N-CH2-CH(NH2)-COOH làm quỳ chuyển sang màu xanh
HOOC-CH2-CH2-CH(NH2)-COOH làm quỳ chuyển đỏ
Đáp án B.
Tiến hành các thí nghiệm sau:
(a) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng
(b) Đốt dây Fe trong bình đựng khí O2
(c) Cho lá Cu vào dung dịch gồm Fe(NO3)3 và HNO3
(d) Cho lá Zn vào dung dịch HCl
Số thí nghiệm có xảy ra ăn mòn điện hóa là:
Chỉ có thí nghiệm (a) xảy ra ăn mòn điện hóa
⇒ Chọn C
Thuốc thử được dùng để phân biệt Gly-Ala-Gly với Gly-Ala là
Tri peptit trở lên có phản ứng màu biure với thuốc thử là Cu(OH)2/OH–
⇒ Chọn D
Cho sơ đồ chuyển hóa sau (mỗi mũi tên là một phương trình phản ứng):
Tinh bột → X → Y → Z → metyl axetat.
Các chất Y, Z trong sơ đồ trên lần lượt là:
X là glucozo
C6H12O6 → 2C2H5OH + 2CO2 (lên men rượu)
C2H5OH + O2 → CH3COOH + H2O (lên men giấm)
CH3OH + CH3COOH → CH3COOCH3 + H2O
Vậy đáp án A
Cho 6,4 gam Cu và 5,6 gam Fe tác dụng với lượng dư dung dịch HCl. Sau khi phản ứng xảy ra hoàn toàn, thu được V lít khí H2 (đktc). Giá trị của V là
nH2 = nFe = 0,1 mol ⇒ V = 2,24 lít.
Hỗn hợp X gồm C2H2 và H2 có cùng số mol. Lấy một lượng hỗn hợp X cho qua chất xúc tác nung nóng, thu được hỗn hợp Y gồm C2H4, C2H6, C2H2 và H2. Sục Y vào dung dịch brom (dư) thì khối lượng bình brom tăng 10,8 gam và thoát ra 4,48 lít hỗn hợp khí (đktc) có tỉ khối so với H2 là 8. Thể tích O2 (đktc) cần để đốt cháy hoàn toàn hỗn hợp Y là
nC2H2 = nH2 = a mol
BTKL: mX = mY = m bình brom tăng + m khí thoát ra
→ 26a + 2a = 10,8 + 0,2.8.2
→ a = 0,5 mol
Đốt Y cũng tiêu tốn O2 giống như đốt X nên:
C2H2 + 2,5O2 → 2CO2 + H2O
H2 + 0,5O2 → H2O
→ nO2 = 2,5a + 0,5a = 1,5
→ V = 33,6 lít
Cho từ từ 200 ml dung dịch HCl 1M vào dung dịch X chứa Na2CO3, NaHCO3 và K2CO3 thu được dung dịch Y và 2,24 lít khí CO2 (đktc). Cho dung dịch nước vôi trong dư vào dung dịch Y thu được 10 gam kết tủa. Hãy cho biết khi cho nước vôi trong dư vào dung dịch X thì thu được bao nhiêu gam kết tủa.
nCO2 = 0,1 và nCaCO3 = 0,1
Bảo toàn C → nCaCO3 = 0,2 mol
→ m = 20 gam
Đốt cháy 34,32 gam chất béo X bằng lượng oxi vừa đủ, thu được 96,8 gam CO2 và 36,72 gam nước. Mặt khác 0,12 mol X làm mất màu tối đa V ml dung dịch Br2 1M. Giá trị của V là:
nCO2 = 2,2 ; nH2O = 2,04
BTKL: nO2 = 3,1
BTNT(O): 6nX + 2nO2 = 2nCO2 + nH2O → nX = 0,04 mol
X có độ không no k → nx.(K-1) = nCO2 - nH2O → k = 5
Phân tử X có 3COO nên còn lại 2 liên kết pi có thể cộng Br2
→ nBr2 = 2nX = 0,24 mol
→ V = 240 ml
Chất hữu cơ X mạch hở có công thức phân tử C4H6O2 và thỏa sơ đồ các phản ứng sau
X + NaOH (dung dịch) → Y + Z;
Y + NaOH (rắn) → T + P (CaO, t°C);
T → Q + H2 (1500°C);
Q + H2O → Z.
Khẳng định nào sau đây đúng?
Chọn C.
CH3COOCH=CH2 (X) + NaOH → CH3COONa (Y) + CH3CHO (Z)
CH3COONa (Y) + NaOH → CH4 (T) + Na2CO3 (P)
CH4 (T) → C2H2 (Q) + H2
C2H2 (Q) + H2O → CH3CHO (Z)
A. Sai, Z không thể điều chế A từ 1 phản ứng.
B. Sai, Đốt cháy cùng số mol Y, Z, T thu đưọc cùng số mol H2O của Y khác với Z và T.
D. Sai, CH4 là thành phần chính của khí thiên nhiên
Cho các phát biểu sau:
(1) Điều chế kim loại Al bằng cách điện phân nóng chảy Al2O3.
(2) Tất cả kim loại kiềm thổ đều tan trong nước ở nhiệt độ thường.
(3) Quặng boxit có thành phần chính là Na3AlF6.
(4) Bột nhôm tự bốc cháy khi tiếp xúc với khí Clo.
(5) Thạch cao sống có công thức là CaSO4.H2O.
(6) Đun nóng có thể làm mềm nước có tính cứng vĩnh cửu.
Số phát biểu đúng là?
(2) Sai vì Be không tan trong nước.
(3) Sai vì quặng boxit có thành phần chính là Al2O3.
(5) Sai vì thạch cao sống có công thức là CaSO4.2H2O.
(6) Sai vì chỉ có thể làm mềm nước cứng tạm thời bằng cách đun nóng.
⇒ Chọn A
Cho các phát biểu sau:
(a) Tinh bột, tripanmitin và lòng trắng trứng đều bị thuỷ phân trong môi trường kiềm, đun nóng
(b) Xenlulozo là chất rắn dạng sợi, màu trắng, không tan trong nước
(c) Saccarozo thuộc loạimonosaccarit
(d) Ở điều kiện thường, etyl axetat là chất lỏng, tan nhiều trong nước
(e) Metylamin có lực bazơ lớn hơn lực bazơ của etylamin
(g) Gly‒Ala và Gly‒Ala‒Gly đều có phản ứng với Cu(OH)2 tạo ra hợp chất màu tím.
Số phát biểu đúng là
Chí có phát biểu (b) đúng ⇒ Chọn A.
(a) Sai vì tinh bột không bị thủy phân trong môi trường kiềm.
(c) Sai vì saccarozo thuộc loại đisaccarit.
(d) Sai vì este hầu như không tan trong nước.
(e) Sai vì etylamin có lực bazơ lớn hơn lực bazơ của metylamin.
(g) Sai vì Gly–Ala là đipeptit ⇒ không có phản ứng màu biure.
Tiến hành các thí nghiệm sau:
(1) Cho dung dịch NaOH vào dung dịch Ba(HCO3)2
(2) Cho dung dịch NH3 đến dư vào dung dịch AlCl3
(3) Sục khí CO2 tới dư vào dung dịch NaAlO2 (hoặc Na[Al(OH)4]
(4) Cho dung dịch AgNO3 vào dung dịch MgCl2
(5) Cho dung dịch Na2SO4 vào dung dịch Ba(OH)2.
(6) Cho Mg vào dung dịch FeCl3 dư
Sau khi các phản ứng kết thức, có bao nhiêu thí nghiệm có kết tủa?
Các phương trình phản ứng xảy ra khi tiến hành các thí nghiệm:
(a) 2NaOH + Ba(HCO3)2 → Na2CO3 + BaCO3↓ + 2H2O.
(b) 3NH3 + AlCl3 + 3H2O → Al(OH)3↓ + 3NH4Cl.
(c) CO2 + 2H2O + NaAlO2 → Al(OH)3↓ + NaHCO3.
(d) 2AgNO3 + MgCl2 → 2AgCl↓ + Mg(NO3)2.
(e) Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
(g) Mg + 2FeCl3 → MgCl2 + 2FeCl2 (vì FeCl3 dùng dư).
Theo đó, có tất cả 5 thí nghiệm thu được kết tủa khi kết thúc các phản ứng.
Sục CO2 vào dung dịch hỗn hợp gồm Ca(OH)2 và KOH ta quan sát hiện tượng theo đồ thị hình sau (số liệu tính theo đơn vị mol).
.png)
Giá trị của x là
Quan sát đồ thị ta thấy nCO2 = 0,15 thì kết tủa đạt max.
→ nCa(OH)2 = nCaCO3 max = 0,15 mol
Khi nCO2 = 0,45 thì bắt đầu hòa tan kết tủa.
Khi nCO2 = 0,5 thì lượng kết tủa bị hòa tan là:
nCaCO3 bị hòa tan = 0,5 - 0,45 = 0,05 mol
→ nCaCO3 còn lại = x = 0,15 - 0,05 = 0,1 mol
Cho 86,3 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong đó oxi chiếm 19,47% về khối lượng) tan hết vào nước, thu được dung dịch Y và 13,44 lít khí H2 (đktc). Cho 3,2 lít dung dịch HCl 0,75M vào dung dịch Y. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là:
%mO/X = 86,3×0,1947 = 16,8 gam.
⇒ nO = 1,05 ⇒ nAl2O3 = 0,35 mol.
Ta có ∑nOH– = 2nH2 = 1,2 mol.
⇒ Dung dịch Y chứa nAlO2– = nAl/Al2O3 = 0,7 mol
nOH dư = 0,5 mol.
+ Sau phản ứng trung hòa nH+ = 3,2×0,75 – 0,5 = 1,9 mol
⇒ nAl(OH)3 = 0,7 – \(\dfrac{1,9-0,7}{3}\) = 0,3 mol.
⇒ mAl(OH)3 = 0,3.78 = 23,4 gam
Hòa tan hoàn toàn 0,5 mol hỗn hợp X chứa Fe, Mg, Fe3O4 và Fe(NO3)2 trong dung dịch chứa 0,08 mol HNO3 và 0,71 mol H2SO4 thu được dung dịch Y chỉ chứa hỗn hợp muối trung hòa có khối lượng lớn hơn khối lượng X là 62,60 gam và 3,136 lít hỗn hợp khí Z (đktc) gồm hai đơn chất khí với tổng khối lượng là 1,58 gam. Cho Ba(OH)2 dư vào Y thu được 211,77 gam kết tủa. Phần trăm khối lượng của Fe có trong X là?
Z gồm N2(0,05) và H2(0,09)
BTKL: mX + mHNO3 + mH2SO4 = mmuối + mZ + mH2O
Với mmuối - mX = 62,6 → nH2O = 0,58
BTNT(H): nNH4+ = 0,04
BTNT(N): nFe(NO3)2 = 0,03
nH+ = 0,08 + 0,71.2 = 12nN2 + 10nNH4+ + 2nN2 + 2nO
→ nO = 0,16 → nFe3O4 = 0,04
đặt u, v là số mol Fe, Mg trong X.
nX = u + v + 0,04 + 0,03 = 0,5
nBa(OH)2 = nH2SO4 = 0,71
→ nOH- trong kết tủa = 0,71.2 - nNH4+ = 1,38
mkết tủa = 56(u+ 0,03 + 0,04.3) + 24v + 1,38.17 + 233.0,71 = 211,77
→ u = 0,13 và v = 0,3
→ % Fe = 24,97%
Tiến hành thí nghiệm chứng minh tính chất hóa học của glucozơ theo các bước sau đây
Bước 1: Cho vào ống nghiệm lần lượt vài giọt dung dịch CuSO4 0,5%, 1ml dung dịch NaOH 10%.
Bước 2: Gạn bỏ phần dung dịch dư, giữ lại kết tủa Cu(OH)2.Cho thêm vào đó 2ml dung dịch glucozơ
1%.
Bước 3: Lắc nhẹ ống nghiệm.
Cho các phát biểu sau
(a) ống nghiệm chuyển sang màu xanh lam khi nhỏ dung dịch glucozơ vào.
(b) Trong thí nghiệm trên glucozơ bị khử.
(c) Trong thí nghiệm trên có thể thay dung dịch CuSO4 bằng dung dịch FeSO4.
(d) ống nghiệm chuyển sang màu đỏ gạch khi nhỏ dung dịch glucozơ vào.
(e) Sau bước 3, trong ống nghiệm có chứa phức đồng glucozơ Cu(C6H11O6)2.
Số phát biểu đúng là:
(b) Sai, Đây không phải là phản ứng oxi hóa khử.
(c) Sai, Không thể thay thế vì glucozơ không tạo phức tan được với dung dịch FeSO4 trong NaOH.
(d) Sai, Màu của dung dịch trong ống nghiệm có màu xanh lam.
X, Y (MX< MY) là hai peptit mạch hở, hơn kém nhau một liên kết peptit. Đun nóng 36,58 gam hỗn hợp E chứa X, Y và este Z (C5H11O2N) với dung dịch NaOH vừa đủ, chưng cất dung dịch sau phản ứng, thu được 0,05 mol ancol etylic và hỗn hợp chứa 2 muối của 2 α-aminoaxit thuộc cùng dãy đồng đẳng. Đốt cháy toàn bộ muối cần dùng 1,59 mol O2, thu được CO2, H2O, N2 và 26,5 gam Na2CO3. Phần trăm khối lượng của X trong hỗn hợp E là
Vì ancol là C2H5OH ⇒ Z là este của alanin.
+ Quy đổi E thành CnH2n–1NO, H2O và C2H5OH ta có:
mHỗn hợp = 36,58 + 0,05×18 = 37,48 gam
Sơ đồ ta có
\(37,48g(E)\left\{ \begin{array}{l}{C_n}{H_{2n - 1}}NO:0,5\\{H_2}O:a + 0,05\\{C_2}{H_5}OH:0,05\end{array} \right. + NaOH \to \left\{ \begin{array}{l}{C_n}{H_{2n}}N{O_2}Na:0,5\\{C_2}{H_5}OH:0,05\end{array} \right. + \underbrace {{H_2}O}_{a + 0,05}\)
+ PT theo số mol O2 đốt cháy muối là: 0,5×\(\dfrac{6n-3}{4}\) = 1,59 \(\Leftrightarrow\) n = 2,62.
⇒ Bảo toàn khối lượng hỗn hợp E
⇒ mH2O = 2,34 gam ⇒ nH2O = 0,13 mol.
⇒ n(X + Y) = 0,13 – 0,05 = 0,08 mol.
+ Với ∑nα–amino axit trong X và Y = 0,5 – 0,05 = 0,45 mol.
Nhận thấy 0,45÷0,08 = 5,625 ⇒ Pentapeptit và Hexapeptit.
Đặt nPentapeptit = a và nHexapeptit = b ta có hệ:
\(\left\{ \begin{array}{l}a + b = 0,08\\5a + 6b = 0,45\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}{n_{Pentapeptit}} = 0,03\\{n_{H{\rm{ex}}apeptit}} = 0,05\end{array} \right.\)
Gọi số C trong pentapeptit và hexapeptit lần lượt là a và b:
⇒ PT bảo toàn C trong peptit là: 0,03a + 0,05b = 0,5×2,62 –0,05×5 = 1,06 (ĐK 10≤a≤15 và 12≤b≤18)
→ 3a + 5b = 106
Giải PT nghiệm nguyên ⇒ a = 12 và b = 14.
⇒ X có dạng (Gly)3(Ala)2 và Y có dạng (Gly)4(Ala)2.
⇒ %mX = \(\dfrac{0,03 \times 331}{36,58}\) × 100 ≈ 27,1%
⇒ Chọn D
Cho các chất hữu cơ: X, Y là hai ancol có cùng số nguyên tử cacbon trong phân tử, Z là axit no, mạch hở (MZ > 90) và este T (phân tử chỉ chứa chức este) tạo bởi X, Y với một phân tử Z. Đốt cháy hoàn toàn 0,325 mol hỗn hợp E gồm X, Y, Z và T thu được 20,16 lít CO2 (đktc) và 17,55 gam H2O. Phần trăm số mol của T trong E gần nhất với giá trị nào sau đây?
nCO2 = 0,9; nH2O = 0,975 mol
Số C = nCO2/nE = 2,77
Do Z đa chức và có MZ > 90 nên Z ít nhất 3C. Vậy haio ancol phải ít hơn 2,77C.
Chúng lại cùng C → C2H5OH và C2H4(OH)2
→ Z là axit 3 chức và T là este 3 chức, 1 vòng.
Số H = 2nH2O/nE = 6
Do este nhiều hơn 6H nên axit phải ít hơn 6H. Vậy E gồm:
C2H6Oz: amol
CH(COOH)3 : b mol
CH(COO)2C2H4-COOC2H5: c mol
nE = a + b + c = 0,325
nCO2 = 2a + 4b + 8c = 0,9
nH2O = 3a + 2b + 5c = 0,975
→ a = 0,25; b = 0,05; c = 0,025
→ %nT = 7,69%
Hỗn hợp E gồm chất X (C3H10N2O4) và chất Y (C3H12N2O3). X là muối của axit hữu cơ đa chức, Y là muối của một axit vô cơ. Cho 3,86 gam E tác dụng với dung dịch NaOH dư, đun nóng, thu được 0,06 mol hai chất khí (có tỉ lệ mol 1 : 5) và dung dịch chứa m gam muối. Giá trị của m là:
Chất X (x mol) là NH4-OOC-CH2-COO-NH4 hoặc NH4-OOC-COO-NH3-CH3.
Chất Y (y mol) là (CH3NH3)2CO3 hoặc NH4-CO3-NH3-C2H5.
mE = 138x + 124y = 3,86
nkhí = 2x + 2y = 0,06
→ x = 0,01 và y = 0,02
Do 2 khí có tỉ lệ mol 1 : 5 nên chọn cặp X là NH4 - OOC - COO-NH3 - CH3 (0,01mol) và Y là (CH3NH3)2CO3 (0,02 mol) là nghiệm thỏa mãn.
Khi đó khí gồm NH3 (0,01) và CH3NH2 (0,05)
Muối gồm (COONa)2 (0,01) và Na2CO3 (0,02)
→ mmuối = 3,46 gam
Tiến hành 4 thí nghiệm:
+ Thí nghiệm 1: Cho Na và bột Al2O3 (tỉ lệ mol 1 : 1) vào nước dư.
+ Thí nghiệm 2: Cho bột Fe vào dung dịch HNO3 loãng (tỉ lệ mol Fe : HNO3 = 3 : 8) tạo sản phẩm khử NO duy nhất.
+ Thí nghiệm 3: Cho hỗn hợp chứa Fe3O4 và Cu (tỉ lệ mol 1 : 1) vào dung dịch HCl dư.
+ Thí nghiệm 4: Cho bột Zn vào dung dịch FeCl3 (tỉ lệ mol Zn : FeCl3 = 1 : 2).
Sau khi phản ứng xảy ra hoàn toàn, số thí nghiệm thu được chất rắn là
TN1: Na + H2O → NaOH + 0,5H2
2NaOH + Al2O3 → 2NaAlO2 + H2O → vẫn còn dư Al2O3
TN2: 3Fe +8HNO3 → Fe(NO3)2 + 3NO + 4H2O → hoà tan hết
TN3: Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Cu + 2FeCl3 → CuCl2 + 2FeCl2 → hoà tan hết
TN4: Zn + 2FeCl3 → ZnCl2 + 2FeCl2 → hoà tan hết
Đáp án C
Điện phân dung dịch chứa đồng thời NaCl và CuSO4 (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hoà tan của các khí trong nước và sự bay hơi của nước) với cường độ dòng điện không đổi. Kết quả của thí nghiệm được ghi ở bảng sau:
Trong 1930 giây: nCu = nCl2 = a mol
→ mgiảm = 64a + 71a = 2,7 → a = 0,02
→ m = 64a = 1,28
ne trong 1930s = 2nCu = 0,04 (1)
Trong 7720 giây: nCu = 4a = 0,08; nCl2 = u và nO2 = v
mgiảm = 0,08.64 + 71u + 32v = 9,15
BT electron: 0,08.2 = 2u + 4v
→ u = 0,05 và v = 0,015
Trong t giây: nCu = 5a = 0,1; nH2 = x; nCl2 = 0,05 và nO2 = y
mgiảm = 0,1.64 + 2x + 0,05.71 + 32y = 11,11
BT electron: 0,1.2 + 2x = 0,05.2 + 4y → x = 0,02, y = 0,035
→ ne trong t giây = 0,1.2 + 2x = 0,24 (2)
Từ (1) và (2) → 1930.0,24 = 0,04t → t = 11580 giây

