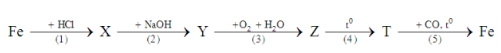Đề thi thử THPT QG môn Hóa học năm 2019 - Trường THPT Tào Mạnh Đức
Đề thi thử THPT QG môn Hóa học năm 2019 - Trường THPT Tào Mạnh Đức
-
Hocon247
-
40 câu hỏi
-
90 phút
-
57 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Đốt cháy 6,16 gam bột Fe trong oxi, sau một thời gian thu được hỗn hợp X gồm FeO, Fe2O3, Fe3O4. Hòa tan hoàn toàn X cần dùng V ml dung dịch HCl 0,5M thu được dung dịch Y chứa 6,35 gam muối FeCl2. Giá trị của V là
nFe = 0,11 và nFeCl2 = 0,05
BTNT(Fe) : nFeCl3 = 0,11 - 0,05 = 0,06
BTNT (Cl): nHCl = 2nFeCl2 + 3nFeCl3 = 0,28
V = 0,56 lít = 560 ml
Đốt cháy hoàn toàn 0,1 mol amino axit X (H2NCnH2nCOOH) cần dùng 0,675 mol O2, thu được CO2, H2O và N2. Công thức của X là
CxH2x+1NO2 + (3x - 1,5)/2O2 → xCO2 + (x + 0,5) H2O + 0,5N2
→ nO2 = 0,1.(3x - 1,5)/2 = 0,675 → x = 5 → X là H2N[CH2]4COOH
Cho 100 gan dung dịch metylamin nồng độ 3,72% tác dụng với dung dịch HCl dư, thu được m gam muối. Giá trị của m là
nCH3NH3Cl = nCH3NH2 = 100.3,72%/31 = 0,12 mol
→ mCH3NH3Cl = 8,1 gam
Xà phòng hóa hóa hoàn toàn m gam hỗn hợp X gồm ba triglixerit với dung dịch NaOH vừa đủ, thu được glixerol có khối lượng 5,52 gam và hỗn hợp Y gồm muối Y1 (C18H33O2Na) và muối Y2 (C18H35O2Na) có tỉ lệ mol 1 : 1. Giá trị của m là
nC3H5(OH)3 = 0,06 → nNaOH = 0,18
BTNT(Na) → nY1 = nY2 = 0,09
→ m muối = 54,9
BTKL: mX + mNaOH = m muối + mC3H5(OH)3
→ mX = 53,22 gam
Cho luồng khí CO dư đi qua ống sứ đựng 5,36 gam hỗn hợp CuO và Fe2O3 (nung nóng), thu được m gam chất rắn và hỗn hợp khí X. Cho X vào dung dịch Ca(OH)2 dư, thu được 9,0 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
Ca(OH)2 dư → nCO2 = nCaCO3 = 0,09
→ nO = 0,09 → m = 5,36 - mO = 3,29 gam
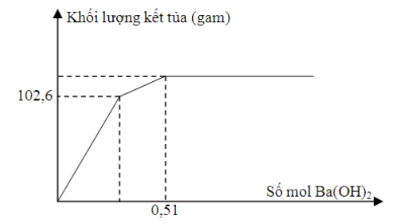
Cho 11,44 gam hỗn hợp gồm Na và Na2O vào 200 ml dung dịch chứa HCl 0,6M và AlCl3 0,4M. Sau khi kết thúc phản ứng, thu được 1,344 lít khí H2 (đktc) và m gam kết tủa. Giá trị của m là
nNa = 2nH2 = 0,12 mol → nNa2O = 0,14 mol
BTNT (Na): nNa+ = 0,4
nHCl = 0,12 và nAlCl3 = 0,08
Dung dịch thu được chứa Na+ (0,4), Cl- (0,36).
BTDT: nAlO2- = 0,04 mol
BTNT(Al): nAl(OH)3 = 0,04 mol
mAl(OH)3 = 3,12 gam
Cho các nhận định sau:
(a) Tơ nitron và tơ visco đều thuộc tơ tổng hợp.
(b) Xà phòng hóa hoàn toàn etyl acrylat thu được muối và ancol.
(c) Ở điều kiện thường, dung dịch saccarozơ hòa tan được Cu(OH)2.
(d) Các oligopeptit đều cho được phản ứng thủy phân.
Số nhận định đúng là
Các nhận định đúng là: (b), (c), (d).
Cho 0,02 mol amino axit X (C4H10O2N2) tác dụng với 200 ml dung dịch chứa H2SO4 0,1M và HCl 0,3M thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ với 400 ml dung dịch NaOH 0,1M và KOH 0,2M, cô cạn dung dịch sau phản ứng thu được m gam muối khan. Giá trị của m là
Muối khan gồm C4H9O2N2- (0,02), SO42- (0,02), Cl- (0,06), Na+ (0,04), K+ (0,08)
Vậy mmuối = 10,43 gam
Thực hiện sơ đồ phản ứng sau (đúng với tỉ lệ mol các chất):
(1) X + 2NaOH → Y + Z + T.
(2) Y + H2SO4 → P + Na2SO4
(3) nP + nQ → tơ lapsan + 2nH2O
(4) 2Z → C2H6O + H2O
Biết Z và T hơn kém nhau một nguyên tử cacbon. Phân tử khối của X là
(2)(3) → P là C6H4(COOH)2, Y là C6H4(COONa)2
(4) → Z là CH3OH
→ T là C2H5OH
X là CH3 - OOC -C6H4-COO-C2H5
→ MX = 208
Hỗn hợp X gồm etilen, axetilen, axetanđehit và hiđro. Đun nóng 0,2 mol X có mặt Ni làm xúc tác đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp Y chỉ chứa các hợp chất hữu cơ. Đốt cháy hoàn toàn Y, thu được 12,32 gam CO2 và 5,4 gam H2O. Để làm no hoàn toàn Y cần dùng a mol H2 (xúc tác Ni, t0). Giá trị của a là
nCO2 = 0,28 và nH2O = 0,3
Các chất hữu cơ trong X đều có 2C nên:
nY = n chất hữu cơ trong X = nCO2/2 = 0,14
Số C = nCO2/nY = 2
Số H = 2nH2O/nY = 30/7
→ k = (2C + 2 -H)/2 = 6/7
→ nH2 làm no Y = knY = 0,12
Đun nóng 20,36 gam hỗn hợp E gồm muối X (CH6O3N2) và muối Y (C3H9O3N) với 400 ml dung dịch NaOH 1M, thu được dung dịch Z chỉ chứa các hợp chất vô cơ và hỗn hợp T gồm hai khí đều có khả năng làm quỳ tím ẩm hóa xanh. Tỉ khối của T so với metan bằng 2,4625. Cô cạn dung dịch Z, sau đó nung đến khối lượng không đổi, thu được m gam chất rắn khan. Giá trị của m là
X là CH3NH3NO3 ( xmol)
Y là C2H5NH3HCO3 ( y mol)
mE = 94x + 107y = 20,36
mT = 31x + 45y = 39,4.(x + y)
→ x = 0,08 và y =0,12
Dung dịch Z chứa NaNO3 (0,08), Na2CO3 (0,12) và NaOH dư (0,08)
Cô cạn rồi nung Z thu được NaNO2 (0,08), Na2CO3 (0,12) và NaOH dư (0,08)
→ m rắn = 21,44 gam
Tiến hành các thí nghiệm sau:
(a) Trong điều kiện không có oxi, hấp thụ khí NO2 vào dung dịch NaOH dư.
(b) Hấp thụ hết 2 mol CO2 vào dung dịch chứa 3 mol NaOH.
(c) Cho Fe3O4 vào dung dịch HCl loãng, dư.
(d) Cho hỗn hợp gồm Cu và Fe2(SO4)3 (tỉ lệ mol 1 : 1) vào nước dư.
(e) Cho CuO vào dung dịch HNO3 dư.
(g) Cho dung dịch NaHCO3 tác dụng vừa đủ dung dịch KOH.
Số thí nghiệm thu được dung dịch chứa hai muối là
các thí nghiệm tạo 2 muối là: (a), (b), (c), (d), (g)
Cho 5,12 gam hỗn hợp gồm Al và Fe vào dung dịch chứa FeCl3 1M và CuCl2 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và rắn Y gồm hai kim loại. Cho toàn bộ Y vào dung dịch HCl dư, thấy thoát ra 1,792 lít khí H2 (đktc) và còn lại 3,84 gam kim loại không tan. Cho dung dịch AgNO3 dư vào X, thu được m gam kết tủa. Giá trị của m là
Y chứa nFe = nH2 = 0,08 và nCu = 0,06
Dung dịch ban đầu chứa CuCl2 (0,06) và FeCl3 (0,12)
Dung dịch X chứa Al3+ (a), Fe2+ (b) và Cl- (0,48)
BTDT: 3a + 2b = 0,48
BTKL kim loại: 5,12 + 0,06.64 + 0,12.56 = 27a + 56b + 0,08.56 + 3,84
→ a = 8/75 và b = 0,08
→ nAgCl = 0,48 và nAg = 0,08
→ m = 77,52
Điện phân dung dịch chứa NaCl và CuSO4 bằng dòng điện một chiều có cường độ không đổi I = 5A (điện cực trơ, có màng ngăn). Sau thời gian 3860 giây, thu được 3,136 lít (đktc) hỗn hợp X gồm hai đơn chất khí. Nếu thời gian điện phân là 7720 giây, thu được V lít (đktc) hỗn hợp Y gồm ba đơn chất khí và dung dịch Z. Nhúng thanh Al vào Z, kết thúc phản ứng thấy khối lượng thanh Al giảm 3,24 gam. Giả sử hiệu suất điện phân là 100%, các khí sinh ra không tan trong dung dịch. Giá trị của V là
Trong 3860s, ne = It/F = 0,2
Anot: 2nCl2 = ne → nCl2 = 0,1
n khí tổng = 0,14 → nH2 = 0,04
Catot: 2nCu + 2nH2 = ne → nCu = 0,06
Trong 7720s, ne = 0,4:
Anot: nCl2 = a và nO2= b → 2a + 4b = 0,4 (1)
Catot: nCu = 0,06 và nH2 = 0,14
Dung dịch sau điện phân chứa Na+ (2a), SO42- (0,06)
BTDT: nOH- = 2a - 0,12
nAl phản ứng = 0,12
→ 2a - 0,12 = 0,12 (2)
Từ (1)(2) → a = 0,12 và b = 0,04
→ n khí = a + b + 0,14 = 0,3
→ V = 6,72 lít
Hòa tan hoàn toàn 28,32 gam hỗn hợp X gồm Fe, Fe(NO3)2, Fe(NO3)3 trong dung dịch chứa NaNO3 và HCl loãng, sau khi các phản ứng xảy ra hoàn toàn, thu được 0,12 mol khí NO duy nhất và dung dịch Y chỉ chứa các muối của kim loại. Cho dung dịch AgNO3 dư vào Y, thu được 81,84 gam kết tủa. Nếu cho 28,32 gam X vào nước dư, khuấy đều, kết thúc phản ứng còn lại m gam rắn không tan. Giá trị của m là
nHCl = nH+ = 4nNO = 0,48
→ nAgCl = 0,48 và nAg = 0,12
Quy đổi X thành Fe(a) và Fe(NO3)2 (b)
mX = 56a + 180b = 28,32
BT electron: 3a + b = 3nNO + nAg
→ a = 0,12 và b = 0,12
Hòa tan X vào H2O → mFe = 6,72 gam
Đề thi liên quan
-
Đề thi thử THPT QG môn Hóa học năm 2019 - Trường THPT Tào Mạnh Đức
-
40 câu hỏi
-
90 phút
-