Đề thi thử THPT QG môn Hóa học năm 2020 - Trường THPT Bình Độ lần 1
Đề thi thử THPT QG môn Hóa học năm 2020 - Trường THPT Bình Độ lần 1
-
Hocon247
-
40 câu hỏi
-
90 phút
-
33 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Khi cho Fe tác dụng với dung dịch chứa H2SO4 loãng và NaNO3, vai trò của NaNO3 trong phản ứng là
Chọn đáp án B
Fe là chất khử, N+5 (NaNO3) là chất oxi hóa, H+ (H2SO4) là môi trường.
Cho hỗn hợp Fe, Mg vào dung dịch AgNO3 và Cu(NO3)2 thì thu được dung dịch A và một kim loại. Kim loại thu được sau phản ứng là
Mg2+/Mg > Fe2+/Fe > Cu2+/Cu > Fe3+/Fe2+ > Ag+/Ag ⇒ chắc chắn phải có Ag ⇒ chọn B.
Nhúng thanh Ni lần lượt vào các dung dịch: FeCl3, CuCl2, AgNO3, HCl và FeCl2. Số trường hợp xảy ra ăn mòn điện hóa là
Ăn mòn điện hóa học xảy ra khi thỏa đủ 3 điều kiện sau:
- Các điện cực phải khác nhau về bản chất.
- Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
- Các điện cực cùng tiếp xúc với dung dịch chất điện li.
FeCl3: chỉ xảy ra ăn mòn hóa học: Ni + 2FeCl3 → NiCl2 + 2FeCl2
CuCl2: ban đầu Ni bị ăn mòn hóa học: Ni + CuCl2 → NiCl2 + Cu
Cu sinh ra bám trực tiếp lên Ni ⇒ xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
AgNO3: ban đầu Ni bị ăn mòn hóa học: Ni + 2AgNO3 → Ni(NO3)2 + 2Ag
Ag sinh ra bám trực tiếp lên Ni ⇒ xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
HCl và FeCl2: chỉ xảy ra ăn mòn hóa học: Ni + 2HCl → NiCl2 + H2
⇒ có 2 trường hợp xảy ra ăn mòn điện hóa ⇒ chọn C.
Tiến hành điện phân dung dịch NaCl bằng điện cực trơ, thu được một khí X duy nhất. Điều khẳng định nào sau đây là đúng ?
Khi điện phân dung dịch NaCl bằng điện cực trơ: 2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
Nếu không có màng ngăn thì xảy ra thêm phản ứng: 2NaOH + Cl2 → NaCl + NaClO + H2O
⇒ để thu được khí X duy nhất thì không dùng màng ngăn xốp và khí duy nhất là H2 ⇒ chọn C.
Khi cho Na dư vào 3 cốc đựng mỗi dung dịch: Fe2(SO4)3, FeCl2 và AlCl3 thì đều có hiện tượng xảy ra ở cả 3 cốc là
Hiện tương đầu tiên xảy ra ở cả 3 cốc là sủi bọt khí không màu (H2) do phản ứng: 2Na + 2H2O → 2NaOH + H2↑
Cho 1,68 gam hỗn hợp A gồm Fe, Cu, Mg tác dụng hết với H2SO4 đặc, nóng. Sau phản ứng thấy tạo hỗn hợp muối B và khí SO2 có thể tích 1,008 lít (đktc). Tính khối lượng muối thu được
2H2SO4 + 2e → SO2 + SO42– + 2H2O ⇒ nSO42– = nSO2 = 0,045 mol.
⇒ mmuối = mKL + mSO42– = 1,68 + 0,045 × 96 = 6(g) ⇒ chọn A.
Cho 3-etyl-2-metylpentan tác dụng với Cl2 theo tỉ lệ số mol 1 : 1, số dẫn xuất monoclo tối đa thu được là
(C2H5)2CH-CH(CH3)2 + Cl2 thu được 5 dẫn xuất monoclo gồm:
CH2Cl-CH2-CH(C2H5)-CH(CH3)2
CH3-CHCl-CH(C2H5)-CH(CH3)2
(C2H5)2CCl-CH(CH3)2
(C2H5)2CH-CCl(CH3)2
(C2H5)2CH-CH(CH3)-CH2Cl
Cho thí nghiệm như hình vẽ:
.jpg)
Thí nghiệm trên dùng để định tính nguyên tố nào có trong glucozo?
Thí nghiệm trên có thể chứng minh glucozơ chứa nguyên tố hidro và cacbon nhờ chuyển chúng thành các hợp chất vô cơ tương ứng là hơi H2O và khí CO2.
Hơi nước sẽ làm CuSO4 khan từ màu trắng chuyển thành màu xanh:
CuSO4 + 5H2O → CuSO4. 5H2O
Khí CO2 làm vẩn đục nước vôi trong: CO2 + Ca(OH)2 → CaCO3↓ + H2O.
Quá trình phân tích nguyên tố được minh họa theo sơ đồ Mindmap dưới đây.

Amino axit X có công thức H2N-R(COOH)2. Cho 0,1 mol X vào V lít dung dịch H2SO4 0,5M, thu được dung dịch Y. Cho Y phản ứng vừa đủ với 100 ml dung dịch gồm: NaOH 1M và KOH 3M, thu được dung dịch chứa 36,7 gam muối. Phần trăm khối lượng của nitơ trong X là
Ta có nH2O = nNaOH + nKOH = 2nH2SO4 + 2nX= 0,2 + 0,2 = 0,4 mol
→ nNaOH = 0,1 mol và nKOH = 0,3 mol
Bảo toàn khối lượng mX = 36,7 + 0.4. 18- 0,1. 98 - 0,3. 56- 0,1. 40 = 13,3 gam
→ MX = 133 → %N= \(\frac{{14}}{{133}}\) ×100% = 10,526%. Đáp án A.
Ngâm một đinh sắt trong dung dịch HCl, phản ứng xảy ra chậm. Để phản ứng xảy ra nhanh hơn, người ta thêm tiếp vào dung dịch axit một vài giọt dung dịch nào sau đây?
Phản ứng xảy ra nhanh hơn khi xảy ra ăn mòn điện hóa ⇒ thêm dung dịch Cu(NO3)2.
Tổng hợp 120 kg poli (metylmetacrylat) từ axit và ancol thích hợp, hiệu suất của phản ứng este hóa là 30% và phản ứng trùng hợp là 80%. Khối lượng của axit tương ứng cần dùng là
CH2=C(CH3)-COOH + CH3OH ⇄ CH2=C(CH3)-COOCH3 + H2O
nCH2=C(CH3)-COOCH3 ⇄ [-CH2-C(CH3)(COOCH3)-]n
npolime = 1,2 mol ⇒ naxit = 1,2 ÷ 0,8 ÷ 0,3 = 5 mol⇒ maxit = 5 × 86 = 430(kg) ⇒ chọn B.
Xà phòng hóa chất béo X, thu được glixerol và hỗn hợp hai muối là natriolat, natri panmitat có tỉ lệ mol 1:2. Hãy cho biết chất X có bao nhiêu công thức cấu tạo ?
Gọi A là gốc C17H33COO- và B là gốc C15H31COO-
X có hai CTCT thỏa mãn sau : A – B – B và B – A – B
Đáp án D
Cho 19,02 gam hỗn hợp Mg, Ca, MgO, CaO, MgCO3, CaCO3 tác dụng vừa đủ với m gam dung dịch HCl 10% thu được 4,704 lít hỗn hợp khí X (đktc). Biết khối lượng hỗn hợp khí X là 5,25 gam và dung dịch sau phản ứng chứa 19,98 gam CaCl2. Giá trị của m gần giá trị nào nhất sau đây?
X gồm H2 và CO2. Đặt nCO2 = x; nH2 = y ⇒ nX = x + y = 0,21 mol; mX = 5,25g = 44x + 2y.
Giải hệ có: x = 0,115 mol; y = 0,095 mol.
Quy đổi hỗn hợp ban đầu về Mg, Ca, O và CO2
⇒ nCa = nCaCl2 = 0,18 mol. Đặt nMg = x; nO = y ⇒ 24x + 0,18 × 40 + 16y + 0,115 × 44 = 19,02g
Bảo toàn electron: 2x + 0,18 × 2 = 0,095 × 2 + 2y. Giải hệ có: x = 0,135 mol; y = 0,22 mol.
⇒ nHCl = 2nMg + 2nCa = 2 × 0,135 + 2 × 0,18 = 0,63 mol ⇒ m = 0,63 × 36,5 ÷ 0,1 = 229,95(g).
Hãy cho biết dùng quỳ tím có thể phân biệt được dãy các dung dịch nào sau đây ?
Amino axit có dạng: (H2N)x-R-(COOH)y xảy ra các trường hợp:
- x > y: dung dịch có pH > 7 và làm quỳ tím hóa xanh.
- x = y: dung dịch có pH = 7 và không làm đổi màu quỳ tím.
- x < y: dung dịch có pH < 7 và làm quỳ tím hóa đỏ.
⇒ chỉ có D là quỳ tím đổi màu khác nhau nên nhận biết được.
Hoà tan hoàn toàn một lượng Ba vào dung dịch chứa a mol HCl thu được dung dịch X và a mol H2. Trong các chất sau: Na2SO4, Na2CO3, Al, Al2O3, AlCl3, Mg, NaOH vàNaHCO3. Số chất tác dụng được với dung dịch X là
Do nHCl < 2nH2 ⇒ HCl hết, Ba tác dụng với H2O ⇒ X chứa BaCl2 và Ba(OH)2.
Các chất tác dụng được với dung dịch X là Na2SO4, Na2CO3, Al, Al2O3, AlCl3, NaHCO3 ⇒ chọn B.
Hỗn hợp X gồm metyl fomat, anđehit acrylic và metyl metacrylat. Đốt cháy hoàn toàn m gam X rồi hấp thụ hết sản phẩm cháy vào dung dịch Ca(OH)2 dư, thu được 10 gam kết tủa và khối lượng dung dịch giảm 3,98 gam. Giá trị của m là
nCO2 = nCaCO3 = 0,1 mol || mdung dịch giảm = mCaCO3 – ∑(mCO2 + mH2O)
⇒ mH2O = 10 – 3,98 – 0,1 × 44 = 1,62 gam ⇒ nH2O = 0,09 mol.
X gồm C2H4O2, C3H4O, C4H6O2 ⇒ nO = nH – nC = 0,09 × 2 – 0,1 = 0,08 mol.
⇒ mX = mC + mH + mO = 0,1 × 12 + 0,09 × 2 + 0,08 × 16 = 2,66 gam.
Cho các polime sau: sợi bông (1), tơ tằm (2), sợi đay (3), tơ enang (4), tơ visco (5), tơ axetat (6), nilon-6,6 (7). Loại tơ có nguồn gốc xenlulozơ là?
Tơ có nguồn gốc từ xenlulozo là sợi bông, sợi đay, tơ visco, tơ axetat ⇒ Chọn D
Cho các chất: Ba; K2O; Ba(OH)2; NaHCO3; BaCO3; Ba(HCO3)2; BaCl2. Số chất tác dụng được với dung dịch NaHSO4 vừa tạo ra chất khí và chất kết tủa là
Ba được vì:
Ba + 2H2O → Ba(OH)2 + H2↑
Ba(OH)2 + 2NaHSO4 → BaSO4↓ + Na2SO4 + 2H2O
BaCO3 được vì:
BaCO3 + 2NaHSO4 → BaSO4↓ + Na2SO4 + CO2↑ + H2O
Ba(HCO3)2 được vì:
Ba(HCO3)2 + 2NaHSO4 → BaSO4↓ + Na2SO4 + CO2↑ + 2H2O
⇒ Chọn A
Cho lần lượt các chất sau: Na2S, NaI, FeS, Fe3O4, Fe2O3, FeO, Fe(OH)2, Fe(OH)3, FeSO4, Fe2(SO4)3 tác dụng với dung dịch HNO3 đặc, nóng. Số phản ứng oxi hoá - khử là
Có 7 chất bao gồm.
Na2S, NaI, FeS, Fe3O4, FeO, Fe(OH)2, FeSO4 ⇒ Chọn A
Đốt cháy hoàn toàn 9,65 gam hỗn hợp X gồm các amin no, hở thu được 17,6 gam CO2 và 12,15 gam H2O. Nếu cho 19,3 gam X tác dụng với HCl dư được m gam muối. Xác định m?
Ta có nC = nCO2 = 0,4 mol || nH = 2nH2O = 1,35 mol.
⇒ nN/ hh amin = (9,65 – mC – mH) ÷ 14 = 0,25 mol.
⇒ nHCl = 0,25 mol ⇒ mMuối = 9,65 + 0,25×36,5 = 18,775 gam. (Cẩn thận chọn sai).
⇒ Với 19,3 gam X thì mMuối = 18,775×2 = 37,55 gam ⇒ Chọn A
Cho các chất sau: axetilen, metanal, axit fomic, metyl fomat, glixerol, saccarozơ, metyl acrylat, vinyl axetat, triolein, fructozo, glucozo. Số chất trong dãy làm mất mầu dung dịch nước Brom là.
Để phản ứng với dung dịch Br2 thì trong CTCT cần có liên kết bội (π) hoặc nhóm chức –CHO.
⇒ Số chất thỏa mãn bao gồm:
+ Axetilen ⇒ Có liên kết ≡ ⇒ Có liên kết π kém bền.
+ Metanal ⇒ Có nhóm –CHO.
+ Axit fomic ⇒ Có nhóm –CHO.
+ Metyl fomat ⇒ Có nhóm –CHO.
+ Metyl acrylat ⇒ Có liên kết = ⇒ Có liên kết π kém bền.
+ Vinyl axetat ⇒ Có liên kết = ⇒ Có liên kết π kém bền.
+ Triolein ⇒ Có liên kết = ⇒ Có liên kết π kém bền.
+ Glucozơ ⇒ Có nhóm –CHO.
⇒ Chọn D
X là dung dịch HCl nồng độ X mol/l. Y là dung dịch gồm Na2CO3 nồng độ y mol/l và NaHCO3 nồng độ 2y mol/l. Nhỏ từ từ đến hết 100 ml X vào 100 ml Y, thu được V lít khí CO2 (đktc). Nhỏ từ từ đến hết 100 ml Y vào 100 ml X, thu được 2V lít khí CO2 (đktc). Tỉ lệ X : y bằng
Do VCO2 ở 2 thí nghiệm khác nhau ⇒ HCl không dư || nHCl = 0,1x; nCO32– = 0,1y mol; nHCO3– = 0,2y mol.
Thí nghiệm 1: nCO2 = nH+ - nCO32– = 0,1x - 0,1y
Thí nghiệm 2: do ban đầu nHCO3– = 2.nCO32– ⇒ nHCO3– phản ứng = 2.nCO32–phản ứng
⇒ nCO32–phản ứng = 0,1x ÷ (2 + 2 × 1) = 0,025x ⇒ nHCO3– phản ứng = 0,05x ⇒ nCO2 = 0,025x + 0,05x = 0,075x
⇒ 0,075x = 2 × (0,1x - 0,1y) ⇒ 0,125x = 0,2y ⇒ x : y = 8 : 5 ⇒ chọn A.
Trong số các chất: phenylamoni clorua, natri phenolat, ancol etylic, phenyl benzoat, tơ nilon-6, ancol benzylic, alanin, Gly-Gly-Val, m-crezol, phenol, anilin, triolein, cumen, đivinyl oxalat. Số chất phản ứng được với dung dịch NaOH loãng, đun nóng là
Các chất phản ứng được với dung dịch NaOH loãng, nóng là phenylamoni clorua, phenyl benzoat , tơ nilon-6, alanin, Gly-Gly-Val, m-crezol, phenol, triolein, đivinyl oxalat ⇒ có 9 chất ⇒ chọn D.
Trong các thí nghiệm sau:
(1) Cho SiO2 tác dụng với axit HF.
(2) Cho khí SO2 tác dụng với khí H2S.
(3) Cho khí NH3 tác dụng với CuO đun nóng.
(4) Cho CaOCl2 tác dụng với dung dịch HCl đặc.
(5) Cho Si đơn chất tác dụng với dung dịch NaOH.
(6) Cho khí O3 tác dụng với Ag.
(7) Cho dung dịch NH4Cl tác dụng với dung dịch NaNO2 đun nóng
(8) Điện phân dung dịch Cu(NO3)2
(9) Cho Na vào dung dịch FeCl3
(10) Cho Mg vào lượng dư dung dịch Fe2(SO4)3.
Số thí nghiệm tạo ra đơn chất là
(1) SiO2 + 4HF → SiF4 + 2H2O
(2) SO2 + 2H2S → 3S + 2H2O
(3) 2NH3 + 3CuO → 3Cu + N2 + 3H2O
(4) CaOCl2 + 2HClđặc → CaCl2 + Cl2 + H2O
(5) Si + 2NaOH + H2O → Na2SiO3 + 2H2
(6) 2Ag + O3 → Ag2O + O2
(7) NH4Cl + NaNO2 → NaCl + N2 + 2H2O
(8) 2Cu(NO3)2 + 2H2O → 2Cu + 4HNO3 + O2
(9) 2Na + 2H2O → 2NaOH + H2 || 3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
(10) Mg + Fe2(SO4)3dư → MgSO4 + 2FeSO4
⇒ (2), (3), (4), (5), (6), (7), (8), (9) thỏa ⇒ chọn A.
Có 500 ml dung dịch X chứa Na+, NH4+, CO32– và SO42–. Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch HCl thu được 2,24 lít khí. Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch BaCl2 thu được 43 gam kết tủa. Lấy 200 ml dung dịch X tác dụng với lượng dư dung dịch NaOH thu được 8,96 lít khí NH3. Các phản ứng hoàn toàn, các thể tích khí đều đo ở đktc. Tính tổng khối lượng muối có trong 300 ml dung dịch X ?
Xét trong 100 ml dung dịch X: 2H⁺ + CO32– → CO2 + H2O ⇒ nCO32– = nkhí = 0,1 mol.
Ba2+ + CO32– → BaCO3
Ba2+ + SO42– → BaSO4
⇒ nSO42– = (43 - 0,1 × 197) ÷ 233 = 0,1 mol.
NH4+ + OH– → NH3 + H2O ⇒ nNH4+ = nNH3 = 0,4 ÷ 2 = 0,2 mol.
Bảo toàn điện tích: nNa+ = 0,2 mol.
⇒ mmuối trong 300ml X = 3 × (0,2 × 23 + 0,2 × 18 + 0,1 × 60 + 0,1 × 96) = 71,4(g) ⇒ chọn C.
Đốt cháy hoàn toàn m gam một triglixerit X cần vừa đủ X mol O2, sau phản ứng thu được CO2 và y mol H2O. Biết m = 78x - 103y. Nếu cho 0,15 mol X tác dụng với dung dịch nước Br2 dư thì lượng Br2 phản ứng tối đa là bao nhiêu mol ?
Bảo toàn khối lượng: mCO2 = m + 32x - 18y = 110x - 121y ⇒ nCO2 = 2,5x - 2,75y
Bảo toàn nguyên tố Oxi: nX = [2 × (2,5x - 2,75y) + y - 2x] ÷ 6 = 0,5x - 0,75y
Ta có: nCO2 - nH2O = (k - 1).nHCHC (với k là độ bất bão hòa của HCHC).
Áp dụng: (2,5x - 2,75y) - y = (k - 1).(0,5x - 0,75y) ⇒ k = 6 ⇒ πC=C + πC=O = 6
Mà πC=O = 3 ⇒ πC=C = 3 ⇒ nBr2 = 0,15 × 3 = 0,45 mol ⇒ chọn A.
Hỗn hợp E gồm chất X (C3H10N2O4) và chất Y (C3H12N2O3), biết X là hợp chất hữu cơ đa chức. Cho 3,86 gam E tác dụng với dung dịch NaOH dư, đun nóng, thu được 0,06 mol hai chất khí (có tỉ lệ mol 1 : 5, X và Y đều tạo khí làm xanh quỳ tím ẩm) và dung dịch chứa m gam muối. Giá trị của m là
- Gọi a và b lần lượt là số mol của X và Y. Khi cho E tác dụng với NaOH thì:
\(\mathop {N{H_4}OOC - COON{H_3}C{H_3}}\limits_{a{\rm{ mol}}} + NaOH \to \mathop {{{\left( {COONa} \right)}_2}}\limits_{a{\rm{ mol}}} + \mathop {N{H_3}}\limits_{{\rm{a mol}}} + \mathop {C{H_3}N{H_2}}\limits_{a{\rm{ mol}}} + {H_2}O\)
\(\mathop {{{\left( {C{H_3}N{H_3}} \right)}_2}C{O_3}}\limits_{b{\rm{ mol}}} + NaOH \to \mathop {2C{H_3}N{H_2}}\limits_{2b{\rm{ mol}}} + \mathop {N{a_2}C{O_3}}\limits_{b{\rm{ mol}}} + {H_2}O\)
Ta có \(\left\{ \begin{array}{l}
a + 2b = 0,05\\
a = 0,01
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
a = 0,01{\rm{ mol}}\\
b = 0,02{\rm{ mol}}
\end{array} \right. \Rightarrow {m_{{\rm{muoi}}}} = 134{n_{{{\left( {COONa} \right)}_2}}} + 106{n_{N{a_2}C{O_3}}} = 3,46g\)
Chất hữu cơ mạch hở X có công thức phân tử trùng với công thức đơn giản nhất. Đốt cháy hoàn toàn m gam X cần vừa đủ 6,72 lít O2 (đo ở đktc), thu được 0,55 mol hồn hợp gồm CO2 và H2O. Hấp thụ hết sản phẩm cháy vào 200 ml dung dịch Ba(OH)2 1M, sau phản ứng khối lượng phần dung dịch giảm bớt 2 gam. Cho m gam X tác dụng vừa đủ với 0,1 mol NaOH, thu được 0,9 gam H2O và một chất hữu cơ Y. Phát biểu nào sau đây sai?
- Xét hỗn hợp CO2 và H2O ta có:
\(\left\{ \begin{array}{l}
{n_{C{O_2}}} + {n_{{H_2}O}} = 0,55\\
197{n_{CaC{O_3}}} - \left( {44{n_{C{O_2}}} + 18{n_{{H_2}O}}} \right) = {m_{dd{\rm{ }}}} = 2
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
{n_{C{O_2}}} = 0,3{\rm{ mol}}\\
{{\rm{n}}_{{H_2}O}} = 0,25{\rm{ mol}}
\end{array} \right.\)
\( \to {n_{O\left( {{\rm{trong X}}} \right)}} = 2{n_{C{O_2}}} + {n_{{H_2}O}} - 2{n_{{O_2}\left( {p{\rm{}}} \right)}} = 0,25{\rm{ mol}}\)
- Có \({n_C}:{n_H}:{n_O} = 6:10:5\) và CTCT trùng với CT đơn giản nhất nên CTPT của X là C6H10O5
- Mặt khác ta nhận thấy rằng \(\frac{{{n_A}}}{{{n_{NaOH}}}} = \frac{1}{2}\)
- Từ các 2 dữ kiện trên ta được CTCT của X là \(HOC{H_2}C{H_2}COOC{H_2}C{H_2}COOH\) và X còn 2 đồng phân còn lại: \(HOC{H_2}C{H_2}COOCH\left( {C{H_3}} \right)COOH\); \(HOCH\left( {C{H_3}} \right)COOCO\left( {C{H_3}} \right)COOH\)
- PT phản ứng: \(HOC{H_2}C{H_2}COOC{H_2}C{H_2}COOH\left( X \right) + 2NaOH2HOC{H_2}C{H_2}COONa\left( Y \right) + {H_2}O\)
A. Đúng, \(2HOC{H_2}C{H_2}COONa\left( Y \right) + 6{O_2} \to 5C{O_2} + 5{H_2}O + N{a_2}C{O_3}\)
B. Đúng, \(HOC{H_2}C{H_2}COOC{H_2}C{H_2}COOH\left( X \right) + N{H_3} \to HOC{H_2}C{H_2}COOC{H_2}C{H_2}COON{H_4}\)
C. Sai, X có tất cả 3 công thức cấu tạo (viết ở trên).
D. Đúng, \(HOC{H_2}C{H_2}COOH\left( Y \right) \to C{H_2} = CH - COOH\).
Hòa tan hoàn toàn hỗn hợp X gồm Cu, CuO, Cu(NO3)2 (trong đó số mol Cu bằng số mol CuO) vào 350 ml dung dịch H2SO4 2M (loãng), thu được dung dịch X chỉ chứa một chất tan duy nhất, và có khí NO thoát ra. Phần trăm khối lượng Cu trong X có giá trị gần nhất với giá trị nào sau đây?
Phân tích: Đặt \({n_{Cu}} = {n_{CuO}} = a;{n_{Cu\left( {N{O_2}} \right)}} = b\).
Khi cho X tan hoàn toàn trong dung dịch H2SO4 thì ta chỉ thu được dung dịch chỉ chứa một chất tan duy nhất nên sau phản ứng thì NO3- hết và muối thu được là CuSO4.
Ta có: \(CuO + 2{H^ + } \to C{u^{2 + }} + {H_2}O\)
\(\mathop {3C{u^{2 + }}}\limits_a + \mathop {8{H^ + } + 2N{O^ - }}\limits_{\frac{8}{3}a \leftrightarrow 2b} \to 3C{u^{2 + }} + 2NO + 4{H_2}O\)
\( \to 2a + \frac{8}{3}a = {n_{{H^ + }}} = 2{n_{{H_2}S{O_4}}} = 1,4 \to a = 3\)
Mà \(2b = \frac{2}{3}a \to b = 0,1\)
Vậy khối lượng Cu trong X là: \(\frac{{0,3.64}}{{0,3.\left( {64 + 80} \right) + 0,1.188}} \approx 30,97\% \)
Để hòa tan hoàn toàn hỗn hợp X gồm 11,2 gam Fe và 11,6 gam Fe3O4 cần dùng tối thiểu V ml dung dịch HCl 2M, thu được dung dịch Y. Cho dung dịch AgNO3 vào dư vào Y thu được m gam kết tủa. Giá trị của V và m lần lượt là:
Do dùng "tối thiểu" HCl nên xảy ra các phản ứng theo thứ tự:
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Fe + 2FeCl3 → 3FeCl2
Fe + 2HCl → FeCl2 + H2O
nFe = 0,2 mol; nFe3O4 = 0,05 mol.
Cuối cùng chỉ chứa FeCl2 ⇒ nFeCl2 = 0,2 + 0,05 × 3 = 0,35 mol.
Bảo toàn nguyên tố Clo: nHCl = 0,35 × 2 = 0,7 mol ⇒ V = 0,7 ÷ 2 = 0,35(l) = 350 ml.
FeCl2 + 3AgNO3 → Fe(NO3)3 + Ag↓ + 2AgCl↓
⇒ nAg = 0,35 mol; nAgCl = 0,7 mol ⇒ m = 0,35 × 108 + 0,7 × 143,5 = 138,25(g).
⇒ chọn B.
Sục 13,44 lít CO2 (đktc) vào 200 ml dung dịch X gồm Ba(OH)2 1,5M và NaOH 1M. Sau phản ứng thu được dung dịch Y. Cho dung dịch Y tác dụng với 200 ml dung dịch hỗn hợp BaCl2 1M và NaOH 1,5M thu được m gam kết tủa. Giá trị của m là:
∑nOH– = 0,2 × (1,5 × 2 + 1) = 0,8 mol; nCO2 = 0,6 mol.
⇒ nOH–/nCO2 = 0,8 ÷ 0,6 = 1,33 ⇒ sinh ra HCO3– và CO32–
nHCO3–/Y = 2nCO2 - nOH– = 0,4 mol; nCO32– = 0,6 - 0,4 = 0,2 mol
⇒ nBa2+/Y = 0,2 × 1,5 - 0,2 = 0,1 mol
nOH– = 0,2 × 1,5 = 0,3 mol < nHCO3–/Y ⇒ nCO32– = 0,3 mol
nBa2+ = 0,2 + 0,1 = 0,3 mol < nCO32– ⇒ nBaCO3 = 0,3 mol
⇒ m = 0,3 × 197 = 59,1(g) ⇒ chọn D.
Cho các nhận định sau:
(1) Ở điều kiện thường, trimetylamin là chất khí, tan tốt trong nước.
(2) Ở trạng thái tinh thể, các amino axit tồn tại dưới dạng ion lưỡng cực.
(3) Lực bazơ của các amin đều mạnh hơn amoniac.
(4) Oligopeptit gồm các peptit có từ 2 đến 10 gốc α-amino axit và là cơ sở tạo nên protein.
(5) Anilin để lâu ngày trong không khí có thể bị oxi hóa và chuyển sang màu nâu đen.
(6) Các amino axit có nhiệt độ nóng chảy cao, đồng thời bị phân hủy.
Số nhận định đúng là
(1) Đúng
(2) Đúng
(3) Sai, chẳng hạn anilin có tính bazơ yếu hơn NH3.
(4) Sai, polipeptit mới là cơ sở tạo nên protein.
(5) Đúng
(6) Đúng
⇒ có 4 nhận định đúng ⇒ chọn B.
Hỗn hợp khí X có thể tích 4,48 lít (đo ở đktc) gồm H2 và vinylaxetilen có tỉ lệ mol tương ứng là 3:1. Cho hỗn hợp X qua xúc tác Ni nung nóng thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 14,5. Cho toàn bộ hỗn hợp Y ở trên từ từ qua dung dịch nước brom dư (phản ứng hoàn toàn) thì khối lượng brom đã phản ứng là
Tính được nH2 = 0,15 mol; n C4H4 = 0,05 mol.
Khi nung nóng thì khối lượng hỗn hợp: msau pư = mtrước pư = 0,15 × 2 + 0,05 ÷ 52 = 2,9 gam.
từ tỉ khối hh sau pư với H2 → n hh sau pư = 2,9 ÷ 2 ÷ 14,5 = 0,1 mol.
Chú ý: nH2 pư = n hh trước pư – n số mol hh sau pư = 0,2 – 0,1 = 0,1 mol.
Thêm nữa, H2 phản ứng sẽ cộng vào nối đôi, làm mất 0,1 mol liên kết π của hh trước pư.
Mà số mol lk π trước pư là: 0,05 × 3 = 0,15 nên sau phản ứng chỉ còn 0,15 – 0,1 = 0,05 mol π.
Vậy khối lượng brom đã phản ứng sé là: 0,05 × 160 = 8 gam.
Ta chọn đáp án C.
Hòa tan 10,92 gam hỗn hợp X chứa Al, Al2O3 và Al(NO3)3 vào dung dịch chứa NaHSO4 và 0,09 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chứa các chất tan có khối lượng 127,88 gam và 0,08 mol hỗn hợp khí Z gồm 3 khí không màu, không hóa nâu ngoài không khí. Tỉ khối hơi của Z so với He bằng 5. Cho từ từ đến dư dung dịch NaOH vào dung dịch Y, phản ứng được biểu diễn theo đồ thị sau:
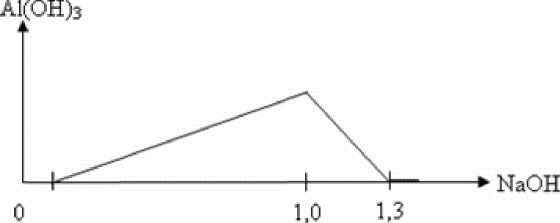
Phần trăm khối lượng của khí có khối lượng phân tử lớn nhất trong hỗn hợp Z là
gt ⇒ Z gồm N2O, N2, H2 ⇒ Y không chứa NO3–; khí có PTK lớn nhất trong Z là N2O.
\(\underbrace {\left\{ \begin{array}{l}
Al\\
A{l_2}{O_3}\\
Al{\left( {N{O_3}} \right)_3}
\end{array} \right\}}_{10,92\left( g \right)} + \left\{ \begin{array}{l}
NaHS{O_4}\\
HN{O_3}:0,09
\end{array} \right\} \to \left\{ \begin{array}{l}
{N_2}O\\
{N_2}\\
{H_2}
\end{array} \right\} + {H_2}O + \left\{ \begin{array}{l}
A{l^{3 + }}\\
N{a^ + }\\
NH_4^ + \\
{H^ + }\\
SO_4^{2 - }
\end{array} \right\}\)
Từ 1 mol NaOH đến 1,3 mol NaOH thì kết tủa từ cực đại đến tan hết do xảy ra phản ứng:
Al(OH)3 + NaOH → NaAlO2 + 2H2O ⇒ nAl3+ = nAl(OH)3 = 1,3 - 1 = 0,3 mol.
Đặt nNaHSO4 = x ⇒ nNa+/Y = nSO42– = x. Khi kết tủa đạt cực đại thì chỉ thu được Na2SO4.
⇒ nNa2SO4 = x ⇒ ∑nNa+ = 2x ⇒ nNa+/Y = 2x - 1 = x ⇒ x = 1.
Đặt nNH4+ = y; nH+ = z. Bảo toàn điện tích: 0,3 × 3 + 1 + y + z = 1 × 2
mmuối = 127,88(g) = 0,3 × 27 + 1 × 23 + 18y + z + 1 × 96
Giải hệ có: y = 0,04 mol; z = 0,06 mol. Bảo toàn khối lượng:
mH2O = 10,92 + 1 × 120 + 0,09 × 63 - 127,88 - 0,08 × 20 = 7,11g ⇒ nH2O = 0,395 mol.
Bảo toàn nguyên tố Hidro: nH2 = (1 + 0,09 - 0,04 × 4 - 0,06 - 0,395 × 2)/2 = 0,04 mol.
Đặt nN2O = a; nN2 = b ⇒ nZ = a + b + 0,04 = 0,08; mZ = 44a + 28b + 0,04 × 2 = 0,08 × 20
Giải hệ có: a = 0,025 mol; b = 0,015 mol ⇒ %mN2O = 0,025 × 44 ÷ 1,6 × 100% = 68,75%.
Cho các phát biểu sau:
(1) Hidro hoá hoàn toàn glucozơ tạo ra axit gluconic
(2) Phản ứng thuỷ phân xenlulozo xảy ra được trong dạ dày của động vật ăn cỏ.
(3) Xenlulozo trinitrat là nguyên liệu để sản xuất tơ nhân tạo.
(4) Saccarozo bị hoá đen trong H2SO4 đặc.
(5) Trong công nghiệp dược phẩm, saccarozo được dùng để pha chế thuốc.
(6) Nhóm cacbohidrat còn được gọi là gluxit hay saccarit thường có công thức chung là Cn(H2O)m.
(7) Fructozơ chuyển thành glucozo trong môi trường axit hoặc môi trường kiềm.
(8) Dung dịch mantozơ tác dụng với Cu(OH)2 khi đun nóng cho kết tủa Cu2O
(9) Thủy phân (xúc tác H+ ,t°) saccarozo cũng như mantozơ đều cho cùng một monosaccarit
(10) Dung dịch fructozơ hoà tan được Cu(OH)2
(11) Sản phẩm thủy phân xenlulozo (xúc tác H+, t°) có thể tham gia phản ứng tráng gương
Trong các phát biểu trên, số phát biểu đúng là
(1) Sai vì hidro hóa hoàn toàn glucozơ thu được sobitol.
(2) Đúng vì trong dạ dày của chúng có chứa các enzim thủy phân xenlulozơ.
(3) Sai vì xenlulozơ trinitrat dùng để chế tạo thuốc súng không khói.
(4) Đúng vì H2SO4 đặc có tính háo nước nên xảy ra phản ứng: C12H22O11 → 12CO2 + 11H2O
(5) Đúng
(6) Đúng
(7) Sai vì fructozơ và glucozơ chỉ chuyển hóa lẫn nhau trong môi trường kiềm.
(8) Đúng vì mantozơ tạo bởi 2 gốc α-glucozơ. Trong dung dịch, gốc α-gluczơ có thể mở vòng tạo nhóm -CHO.
(9) Sai vì thủy phân saccarozơ thu được 2 loại monosaccarit là glucozơ và fructozơ.
(10) Đúng vì fructozơ chứa nhiều nhóm -OH kề nhau.
(11) Đúng vì sản phẩm thủy phân là glucozơ có thể tráng gương.
⇒ (2), (4), (5), (6), (8), (10) và (11) đúng ⇒ chọn B.
Hỗn hợp A có khối lượng 8,14 gam gồm: CuO, Al2O3 và một oxit sắt. Cho H2 dư qua A nung nóng, sau khi phản ứng xong thu được 1,44 gam H2O. Hòa tan hoàn toàn A cần 170 ml dung dịch H2SO4 1M loãng được dung dịch B. Cho B tác dụng với NH3 dư lọc lấy kết tủa đem nung trong không khí thu được 6,66 gam chất rắn. Công thức phân tử của oxit sắt và khối lượng của nó trong A là
Quy A về Cu, Al, Fe và O
[O] + H2SO4 → SO42– + H2O ⇒ nO = nH2SO4 = 0,17 mol.
H2 + [O] → H2O (trừ Al2O3) ⇒ nAl2O3 = (0,17 - 0,08)/3 = 0,03 mol ⇒ nAl = 0,06 mol.
Rắn gồm 0,03 mol Al2O3 và Fe2O3 ⇒ nFe2O3 = (6,66 - 0,03 × 102)/160 = 0,0225 mol
⇒ nFe = 0,045 mol ⇒ nCu = (8,14 - 0,06 × 27 - 0,045 × 56 - 0,17 × 16)/64 = 0,02 mol.
⇒ nO/oxit sắt = 0,17 - 0,09 - 0,02 = 0,06 mo ⇒ Fe : O = 0,045 : 0,06 = 3 : 4 ⇒ Fe3O4
⇒ moxit sắt = 0,015 × 232 = 3,48(g) ⇒ chọn A.
Ba dung dịch A, B, C thoả mãn:
- A tác dụng với B thu được kết tủa X, cho X vào dung dịch HNO3 loãng dư, thấy thoát ra khí không màu hóa nâu ngoài không khí; đồng thời thu được kết tủa Y.
- B tác dụng với C thấy khí thoát ra, đồng thời thu được kết tủa.
- A tác dụng C thu được kết tủa Z, cho Z vào dung dịch HCl dư, thấy khí không màu thoát ra.
Các chất A, B và C lần lượt là
A tác dụng với B thu được 2 kết tủa và 1 kết tủa có tính khử ⇒ loại A và C.
B tác dụng với C thu được khí ⇒ loại B ⇒ chọn D.
Hòa tan hết 15,0 gam hỗn hợp X gồm Fe, Fe3O4, FeCO3 và Fe(NO3)2 trong dung dịch chứa NaHSO4 và 0,16 mol HNO3, thu được dung dịch Y và hỗn hợp khí Z gồm CO2 và NO (tỉ lệ mol tương ứng 1 : 4). Dung dịch Y hòa tan tối đa 8,64 gam bột Cu, thấy thoát ra 0,03 mol khí NO. Nếu cho dung dịch Ba(OH)2 dư vào Y, thu được 154,4 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn và khí NO là sản phẩm khử duy nhất của cả quá trình. Phần trăm khối lượng của Fe đơn chất trong hỗn hợp X là:
- Dung dịch Y gồm Fe3+, H+, Na+, NO3- và SO42- (dung dịch Y không chứa Fe2+, vì không tồn tại dung dịch cùng chứa Fe2+, H+ và NO3-).
- Khi cho dung dịch Y tác dụng với 0,135 mol Cu thì:
\(\left\{ \begin{array}{l}
{n_{F{e^{3 + }}}} = 2{n_{Cu}} - 3{n_{NO}} = 0,18{\rm{ mol}}\\
{n_{{H^ + }\left( {{\rm{d}}} \right)}} = 4{n_{NO}} = 0,12{\rm{ mol}}
\end{array} \right.\)
- Khi cho dung dịch Y tác dụng với Ba(OH)2 ta có:
\({n_{BaS{O_4}}} = {n_{NaHS{O_4}}} = \frac{{m \downarrow - 107{n_{F{e^{3 + }}}}}}{{233}} = 0,58{\rm{ mol}}\)
- Xét dung dịch Y, có: \( \to {n_{NO_3^ - }} = 2{n_{SO_4^{2 - }}} - \left( {3{n_{F{e^{3 + }}}} + {n_{{H^ + }}} + {n_{N{a^ + }}}} \right) = 0,08{\rm{ mol}}\)
\( \Rightarrow {m_Y} = 23{n_{N{a^ + }}} + 56{n_{F{e^{3 + }}}} + {n_{{H^ + }}} + 62{n_{NO_3^ - }} + 96{n_{SO_4^{2 - }}} = 84,18{\rm{ }}\left( g \right)\)
\( \to {n_{{H_2}O}} = \frac{{{n_{NaHS{O_4}}} + {n_{HN{O_3}}} - {n_{{H^ + }\left( {{\rm{d}}} \right)}}}}{2} = 0,31{\rm{ mol}}\)
- Xét hỗn hợp khí Z, có nCO2 = x mol và nNO = 4x mol. Mặt khác:
\( \to 44{n_{C{O_2}}} + 30{n_{NO}} = {m_X} + 120{n_{NaHS{O_4}}} + {n_{HN{O_3}}} - {m_T} - 18{n_{{H_2}O}} \to 44x + 3x.30 = 4,92\left( g \right) \Rightarrow x = 0,03{\rm{ mol}}\)
- Quay trở lại hỗn hợp rắn X, ta có:
\( \to {n_{Fe{{\left( {N{O_3}} \right)}_2}}} = \frac{{{n_{NO_3^ - }} + {n_{NO}} - {n_{HN{O_3}}}}}{2} = \frac{{0,08 + 0,12 - 0,16}}{2} = 0,02\) mol và \({n_{FeC{O_3}}} = {n_{C{O_2}}} = 0,03\) mol
mà \({n_{F{e_3}{O_4}}} = \frac{{{n_{O\left( {{\rm{trong oxit}}} \right)}}}}{4} \Rightarrow {n_{F{e_3}{O_4}}} = \frac{{{n_{NaHS{O_4}}} + {n_{HN{O_3}}} - 2{n_{C{O_2}}} - 4{n_{NO}} - {n_{{H^ + }\left( {{\rm{d}}} \right)}}}}{8} = 0,01{\rm{ mol}}\)
\( \Rightarrow \% {m_{Fe}} = \frac{{{m_X} - 232{n_{F{e_3}{O_4}}} - 116{n_{FeC{O_3}}} - 180{n_{Fe{{\left( {N{O_3}} \right)}_2}}}}}{{{m_X}}}.100 = 37,33\% \)
Hỗn hợp X gồm C3H8, C2H4(OH)2 và một số ancol no, đơn chức, mạch hở (C3H8 và C2H4(OH)2 có số mol bằng nhau). Đốt cháy hoàn toàn 5,444 gam X rồi hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ba(OH)2 dư thấy khối lượng bình tăng lên 16,58 gam và xuất hiện m gam kết tủa. Giá trị của m là
nhạy cảm: "một số ancol". nối: C3H8.C2H4(OH)2 = C5H14O2 = 2.C2,5H7O.
→ nhận ra vấn đề: hỗn hợp X gồm tất cả các chất đều có dạng CnH2n + 2O.
Quy 5,444 gam X gồm x mol CH2 và y mol H2O
→ 14x + 18y = 5,444 gam.
Bảo toàn C, H → mtăng = 62x + 18y = 16,58 gam.
m = 197 × (16,58 – 5,444) ÷ (62 – 14) = 45,704 gam. Chọn đáp án D.
Cho 5,6 gam Fe vào 200 ml dung dịch Cu(NO3)2 0,5M và HCl 1,2 M thu được khí NO và m gam kết tủa. Xác định m. Biết rằng NO là sản phẩm khử duy nhất của NO3– và không có khí H2 bay ra
Ta có nFe = 0,1
nCu(NO2)2 = 0,1
nHCl = 0,24
Nhận thấy nH+ = 0,24 và nNO3– = 0,2 ⇒ nNO = 0,06
Ta có 3nNO > 2nFe ⇒ Fe chỉ lên Fe2+.
⇒ nFe phản ứng với HNO3 = nNO × 3 ÷ 2 = 0,09 mol
⇒ nFe phản ứng với Cu2+ = 0,1 - 0,09 = 0,01 mol
⇒ m↓ = mCu = 0,01×64 = 0,64 gam ⇒ Chọn A

