Đề thi thử THPT QG môn Hóa học năm 2020 - Trường THPT Phan Đình Phùng lần 1
Đề thi thử THPT QG môn Hóa học năm 2020 - Trường THPT Phan Đình Phùng lần 1
-
Hocon247
-
40 câu hỏi
-
90 phút
-
39 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Trong các ion sau đây, ion nào có tính oxi hóa mạnh nhất?
Sự xuất hiện của các cặp điện hóa trong dãy điện hóa lần lượt là: Ca2+/Ca; Zn2+/Zn; Cu2+/Cu; Ag+/Ag.
Tính oxi hóa theo chiều từ trái sang phải tăng dần → Ag+ có tính oxi hóa mạnh nhất.
Kim loại có những tính chất vật lý chung nào sau đây?
Kim loại có những tính chất vật lí chung là: tính dẻo, tính dẫn điện, tính dẫn nhiệt và tính ánh kim
Trong công nghiệp, để sản xuất axit H3PO4 có độ tinh khiết và nồng độ cao, người ta làm cách nào sau đây ?
Để thu được axit H3PO4 có độ tinh khiết và nồng độ cao hơn, người ta đốt cháy photpho để thu được P2O5, rôi cho P2O5 tác dụng với nước:
4P + 5O2 → 2P2O5.
P2O5 + 3H2O → 2H3PO4
Etyl fomat là một este có mùi thơm, không độc, được dùng làm chất tạo hương trong công nghiệp thực phẩm. Công thức cấu tạo của etyl fomat là
Etyl fomat là este tạo bởi axit HCOOH và ancol C2H5OH → este: HCOOC2H5
Sắt khi tác dụng với hóa chất nào sau đây, thu được sản phẩm là hợp chất sắt(III) ?
2Fe + 3Cl2 → 2FeCl3
Dung dịch nào sau đây làm phenolphtalein chuyển sang màu hồng ?
Metylamin CH3NH2 có tính bazo → quỳ tím chuyển xanh
Khi để trong không khí nhôm khó bị ăn mòn hơn sắt là do
Khi để trong không khí nhôm khó bị ăn mòn hơn sắt là do trên bề mặt nhôm có lớp Al2O3 bảo vệ.
Hiện tượng xảy ra khi nhỏ vài giọt dung dịch H2SO4 vào dung dịch Na2CrO4 là:
2CrO42- + 2H+ ↔ Cr2O72- + H2O
(vàng) (da cam)
Nên khi nhỏ H2SO4 vào dung dịch Na2CrO4 dung dịch chuyển từ màu vàng sang da cam.
Polime nào sau đây là tơ được điều chế bằng phản ứng trùng hợp ?
Poliacrilonitrin được tạo ra bằng phản ứng trùng ngưng acrilonitrin CH2=CH-CN
Trong quá trình luyện gang, người ta thường sử dụng chất nào sau đây để loại bỏ SiO2 ra khỏi gang?
Chất chảy CaCO3 ở nhiệt độ cao bị phân hủy thành CaO, sau đó hóa hợp với SiO2 là chất khó nóng chảy có trong quặng sắt thành xỉ silicat dễ nóng chảy, có khối lượng riêng nhỏ nổi lên trên gang
Khi bị ốm, mất sức, nhiều người bệnh thường được truyền dịch đường để bổ sung nhanh năng lượng. Chất trong dịch truyền có tác dụng trên là
Glucozơ được dùng làm thuốc tăng lực cho người bệnh vì nó dễ hấp thu và cung cấp nhiều năng lượng
Cho mẫu nước cứng chứa các ion: Ca2+, Mg2+ và HCO3- . Hoá chất không thể dùng để làm mềm mẫu nước cứng trên là:
Khi cho HCl vào, mặc dù loại bỏ được ion HCO3- tuy nhiên lại có thêm ion Cl- → mẫu nước cứng ban đầu là nước cứng tạm thời trờ thành nước cững vĩnh cửu → không làm mềm được nước cứng
Khử hoàn toàn một lượng Fe2O3 bằng CO ở nhiệt độ cao thu được m gam Fe và 6,72 lít CO2 (ở đktc). Giá trị của m là
Fe2O3 + 3CO → 3CO2 + 2Fe.
Ta có: n(CO2) = 0,3 → n(Fe) = 0,2 → m = 11,2 (g)
Cho một mẫu hợp kim Na-K-Ba tác dụng với nước (dư), thu được dung dịch X và 0,784 lít H2 (ở đktc). Thể tích dung dịch axit HCl 0,5M cần dùng để trung hoà dung dịch X là
M + nH2O → M(OH)n + n/2 H2.
Ta có: n(H2) = 0,035 mol → n(OH-) = 0,07 mol → n(H+) = 0,07 → V = 0,07 : 0,5 = 0,14 lít
Cho các chất glucozơ, saccarozơ, xenlulozơ, glixerol và các phát biểu sau:
(a) Có 2 chất tác dụng được với dung dịch AgNO3/NH3, t0 .
(b) Có 2 chất có phản ứng thủy phân trong môi trường kiềm.
(c) Có 3 chất mà dung dịch của nó có thể hòa tan được Cu(OH)2.
(d) Cả 4 chất đều có nhóm -OH trong phân tử.
Số phát biểu đúng là:
(a) Có 1 chất tác dụng dụng với AgNO3/NH3: glucozơ.
(b) Không có chất nào thủy phân trong môi trường kiềm.
Lưu ý. 2 chất thủy phân trong môi trường axit: saccarozơ, xenlulozơ.
(c) Có 3 chất mà dd của nó hòa tan được Cu(OH)2: glucozơ, saccarozơ, glixerol.
(d) Cả 4 chất đều có nhóm -OH trong phân tử.
Số phát biểu đúng: 2.
Thủy phân hoàn toàn m gam saccarozơ trong môi trường axit, lấy toàn bộ sản phẩm hữu cơ tác dụng với dung dịch AgNO3/NH3, đun nóng (dùng dư), thu được 34,56 gam Ag. Giá trị của m là
C12H22O11 → C6H12O6 (Glucozo)+ C6H12O6 (Fructozo)
Ta có: n(Ag) = 0,32 → 2n(Glu) + 2n(Fruc) = 0,32 → n(Glu) = n(Fruc) = 0,08 → n(Saccarozo) = 0,08
→ m = 27,36 g
Cho 29,8 gam hỗn hợp 2 amin đơn chức kế tiếp tác dụng hết với dung dịch HCl, làm khô dung dịch thu được 51,7 gam muối khan. Công thức phân tử 2 amin là
BTKL: m(HCl) = 51,7 – 29,8 = 21,9 gam. → n(HCl) = 0,6 mol.
Vì amin đơn chức nên n(amin) = 0,6 → M(trung bình) = 29,8 : 0,6 = 49,67
Công thức CxHyN có: 12x + y + 14 = 49,67 → 12x + y = 35,67. nên 2 amin là C2H7N và C3H9N.
Nhận xét nào đưới đây về đặc điểm chung của chất hữu cơ là KHÔNG đúng:
Các hợp chất hữu cơ kém bền với nhiệt, dễ cháy.
Chất nào sau đây điện li không hoàn toàn khi tan trong nước ?
H3PO4 là 1 axit yếu → chất điện li yếu → điện li không hoàn toàn
Đốt cháy hoàn toàn chất hữu cơ nào sau đây sản phẩm thu được không có N2 ?
Amin, Amino axit, Peptit trong thành phần đều chứa nguyên tố N
Gluxit ( cabonhidrat)chứa nguyên tố C, H, O
Đốt cháy hoàn toàn Gluxit sản phẩm thu được không có N2.
Tiến hành các thí nghiệm sau:
(a) Cho lá Fe nguyên chất vào dung dịch CuCl2
(b) Cho lá Ni nguyên chất vào dung dịch HCl.
(c) Cho lá Zn nguyên chất vào dung dịch FeCl3
(d) Cho lá Ni nguyên chất vào dung dịch FeCl2.
Số thí nghiệm có thể xảy ra ăn mòn điện hóa là
Các thí nghiệm xảy ra ăn mòn điện hóa là a và c.
Số α-aminoaxit có công thức phân tử C4H9O2N là
Các đồng phân: CH3-CH2-CH(NH2)-COOH và CH3-C(CH3)(NH2)-COOH
Cho hình vẽ mô tả thí nghiệm điều chế khí Y từ chất rắn X như sau:
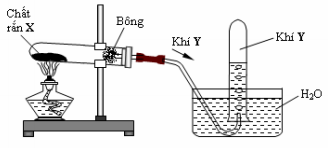
Hình vẽ trên minh họa cho phản ứng nào sau đây?
Nhận thấy Y là khí không tan trong nước (do được thu bằng phương pháp đẩy nước)
Chất rắn X là KMnO4; khí Y là O2
Cho dãy các chất: triolein, saccarozơ, nilon-6,6, tơ lapsan, xenlulozơ và Gly-Ala-Val. Số chất trong dãy cho được phản ứng thủy phân trong môi trường kiềm là
Các chất đó là:triolein, nilon-6,6; tơ lapsan; Gly-Ala-Val.
Hấp thụ hết 4,48 lít CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Lấy 100 ml dung dịch X cho từ từ vào 300 ml dung dịch HCl 0,5M thu được 2,688 lít khí (đktc). Mặt khác, 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư thu được 39,4 gam kết tủa. Giá trị của x là
\({n_{C{O_2}}} = 0,2mol\)
Cho 100ml dung dịch X vào dung dịch chứa 0,15mol HCl thu được 0,12 mol CO2
Do \({n_{C{O_2}}} < {n_{HCl}} < 2{n_{C{O_2}}}\) nên dung dịch X chứa K2CO3 và KHCO3
Gọi số mol K2CO3 và KHCO3 phản ứng lần lượt là a và b.
→ a + b = 0,12; 2a + b = 0,15
Giải được a = 0,03, b = 0,09 vậy trong X tỷ lệ số mol K2CO3 và KHCO3 là 1 : 3
Gọi số mol K2CO3 trong X là m suy ra KHCO3 là 3m.
Cho 100ml dung dịch X tác dụng với Ba(OH)2 dư thu được 0,2 mol kết tủa BaCO3
Do đó 200ml dung dịch X tác dụng thì thu được 0,4mol kết tủa.
→m + 3m = 0,4 → m = 0,1
Bảo toàn C: \({n_{{K_2}C{O_3}}} = 0,4 - 0,2 = 0,2mol\)
Bảo toàn K: \({n_{KOH}} = 0,1.2 + 0,3 - 0,2.2 = 0,1\)
Vậy x = 0,1
Cho a gam hỗn hợp X gồm 2 chất hữu cơ có công thức phân tử C2H8O3N2 và C4H12O4N2 đều no mạch hở tác dụng với dung dịch NaOH vừa đủ thu được 5,6 lit (đktc) hỗn hợp khí Y gồm 2 chất hữu cơ đều làm xanh giấy quỳ tím ẩm có tỉ khối so với H2 bằng 19,7 và dung dịch Z có chứa b gam hỗn hợp 3 muối. Giá trị của b gần nhất với
Ta có C2H8O3N2 là C2H5NH3NO3.
Cho hỗn hợp X tác dụng với NaOH vừa đủ thu được 0,25 mol hỗn hợp khí gồm 2 chất hữu cơ đều xanh màu quỳ tím ấm của Mtb=39,4 mà trong đó có C2H5NH2, do vậy khí còn lại phải là CH3NH2.
Giải được số mol CH3NH2 và C2H5NH2 lần lượt là 0,1 và 0,15 mol.
Dung dịch Z chứa hỗn hợp 3 muối nên C4H12O4N2 phải là HCOOH3NCH2COOH3NCH3.
Vậy thu được hỗn hợp 3 muối gồm NaNO3 0,15 mol, HCOONa 0,1 mol và H2NCH2COONa 0,1 mol.
→ b = 29,25 gam
Thực hiện sơ đồ phản ứng sau (đúng với tỉ lệ mol các chất):
(1) X + 2NaOH → X1 + X2 + 2H2O
(2) mX2 + mX3 → Tơ nilon-6,6 + 2mH2O
(3) X1 + H2SO4 → X3 + Na2SO4
(4) X3 + X4 → X6 + 2H2O
(5) nX3 + nX4 → Tơ lapsan + 2nH2O
(6) X5 + X4 → X7 + H2O
Nhận định sai là:
Để sinh ra nilon-6,6 thì 2 chất X2, X5 phải NH2-(CH2)6-NH2 và HOOC-(CH2)4-COOH.
Mà X2 được tạo ra từ phản ứng 1 vậy X2 không thể là axit → X2 là NH2-(CH2)6-NH2.
→ X5 là HOOC-(CH2)4-COOH.
X1 phản ứng với H2SO4 cho X3 vậy X1 là muối natri còn X3 là axit tương ứng.
X3 + X4 cho tơ lapsan vậy X3 và X4 phải là HOOC-C6H4-COOH và HO-CH2-CH2-OH.
→ X3 là HOOC-C6H4-COOH → X4 là HO-CH2-CH2-OH.
→ X1 là NaOOC-C6H4-COONa
→ X có thể là HOOC-C6H4-COO-NH3(CH2)6-NH2 (X lưỡng tính)
X6 là sản phẩm thu được khi X3 + X4 cho 2 H2O. vậy X6 là hợp chất vòng.
Vậy tổng pi trong X là 5.
→ X7 HOOC-(CH2)4-COOCH2-CH2-OH. (có chứa -OH)
Tổng số H trong X6, X7 là 8 + 14 = 22
Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư.
(b) Dẫn khí H2 (dư) qua bột MgO nung nóng.
(c) Cho dung dịch AgNO3 tác dụng với dung dịch Fe(NO3)2 dư.
(d) Cho Na vào dung dịch MgSO4.
(e) Đốt FeS2 trong không khí.
(f). Điện phân dung dịch Cu(NO3)2 với các điện cực trơ
Số thí nghiệm không tạo thành kim loại là
Các thí nghiệm:
(a): Mg + 2Fe3+dư → Mg2+ + 2Fe2+.
(b): H2 + MgO → (không tác dụng)
(c): Ag+ + Fe2+ → Ag + Fe3+
(d): Na + H2O → NaOH + ½ H2. Sau đó: MgSO4 + 2NaOH → Mg(OH)2+ Na2SO4.
(e): FeS2 + O2 → Fe2O3 + SO2
(f): Cu2+ + 2e → Cu
Cho các phát biểu sau:
(a) Nhôm và crom đều phản ứng với clo theo cùng tỉ lệ mol.
(b) Ở nhiệt độ thường, tất cả các kim loại kiềm thổ đều tác dụng được với nước.
(c) Nhôm bền trong môi trường không khí và nước là do có màng oxit Al2O3 bền vững bảo vệ.
(d) Theo chiều tăng dần của điện tích hạt nhân, nhiệt độ nóng chảy của kim loại kiềm thổ giảm dần.
(e) Trong công nghiệp, gang chủ yếu được sản xuất từ quặng manhetit.
(f) Hợp chất crom (VI) như CrO3, K2Cr2O7 có tính khử rất mạnh.
Số phát biểu đúng là:
Các phát biểu đúng là a, c.
b sai do Be không tác dụng với H2O, Mg không phản ứng với nước ở nhiệt độ thường.
d sai theo chiều tăng dần điện tích hạt nhân thì nhiệt độ nóng chảy của kim loại kiềm thổ biến đổi không theo quy luật.
e sai do quặng manhetit hiếm trong tự nhiên hơn nên không phải nguyên liệu dùng trong công nghiệp
f sai do CrO3, K2Cr2O7 có tính oxi hóa rất mạnh.
Hỗn hợp X gồm axetilen (0,15 mol), vinylaxetilen (0,1 mol), etilen (0,1 mol) và hiđro (0,4 mol). Nung X với xúc tác niken một thời gian thu được hỗn hợp Y có tỉ khối đối với hiđro bằng 12,7. Hỗn hợp Y phản ứng vừa đủ với dung dịch chứa a mol Br2. Giá trị của a là
n(X) = 0,15 + 0,1 + 0,1 + 0,4 = 0,75 mol;
n(π trong X) = 0,15.2 + 0,1.3 + 0,1 = 0,7 mol.
m(X) = 0,15.26 + 0,1.52 + 0,1.28 + 0,4.2 = 12,7 gam.
BTKL: m(X) = m(Y) → n(Y) = 12,7 : (12,7.2) = 0,5.
=> n(H2 phản ứng) = n(X) – n(Y) = 0,25 mol = n(π phản ứng)
→ n(π dư) = n(Br2) = 0,7 – 0,25 = 0,45 mol.
Hòa tan hết hỗn hợp gồm Na2O và Al (tỉ lệ mol 1 : 1) trong dung dịch H2SO4 loãng, thu được 6a mol khí H2 và dung dịch X. Cho từ từ dung dịch NaOH đến dư vào X, phản ứng được biểu diễn theo đồ thị sau:
.png)
Với trị số của x = 0,64 và y = 0,72. Đem cô cạn X, thu được m gam muối khan. Giá trị của m là
Hòa tan hết Na2O và Al tỉ lệ 1:1 ta thu được dung dịch chứa Na2SO4, Al2SO4 và H2SO4 dư có thể có.
Ta có: \({n_{{H_2}}} = 6a \to {n_{Al}} = 4a\)
Nhận thấy lúc thêm x và y y mol NaOH đều trong giai đoạn kết tủa giảm tức hòa tan kết tủa nên lúc này tương ứng 1 mol Al(OH)3 bị hòa tan thì có 1 mol NaOH được thêm
Do vậy:
X chứa Al2(SO4)3 0,08 mol và Na2SO4 0,16 mol
m = 50,08
Cho các phát biểu sau:
(a) Amino axit là những hợp chất có cấu tạo ion lưỡng cực.
(b) Anilin có tính bazơ, dung dịch anilin làm hồng phenolphtalein.
(c) Hiđro hóa hoàn toàn triolein thu được tristearin.
(d) Tinh bột là chất rắn, ở dạng bột vô định hình, màu trắng, không tan trong nước lạnh.
(e) Cho glyxylalanin vào Cu(OH)2 thấy tạo phức màu tím đặc trưng.
(f) Xenlulozơ có công thức là [C6H7O2(OH)3]n.
Trong các phát biểu trên, số phát biểu đúng là
Các phát biểu đúng a, c, d, e.
Phát biểu khác sai vì:
(b) anilin không làm hồng phenolphtalein.
(e) Vì glyxylalanin là đipeptit vào Cu(OH)2 không tạo phức màu tím đặc trưng.
Tiến hành điện phân dung dịch chứa 0,25 mol Cu(NO3)2 và 0,18 mol NaCl bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi tới khi dung dịch giảm 21,75 gam thì dừng điện phân. Cho m gam bột Fe vào dung dịch sau điện phân, kết thúc phản ứng, thấy thoát ra khí NO (sản phẩm khử duy nhất) và còn lại 0,75m gam rắn không tan. Giá trị m là:
\(\begin{array}{l} C{u^{2 + }} + 2e \to Cu\\ a{\rm{ }} \to 2a \to a \end{array}\)
\(\begin{array}{*{20}{l}} {2C{l^ - } \to C{l_2} + 2e}\\ {0,18 \to 0,09 \to 0,18}\\ {2{H_2}O \to 4{H^ + } + {O_2} + 4e}\\ {b\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,4b} \end{array}\)
\(\left\{ \begin{array}{l} 2a = 0,18 + 4b\\ 64a + 0,09.71 + 32b = 21,75 \end{array} \right. \Leftrightarrow \left\{ \begin{array}{l} a = 0,21\\ b = 0,06 \end{array} \right.\)
\(\left\{ {\begin{array}{*{20}{l}} {C{u^{2 + }}\left( {0,04} \right)}\\ {{H^ + }\left( {0,24} \right)}\\ {NO_3^ - \left( {0,5} \right)}\\ {N{a^ + }\left( {0,18} \right)} \end{array}} \right.\left\{ {\begin{array}{*{20}{l}} {CR\left\{ {\begin{array}{*{20}{l}} {Fe\left( z \right)}\\ {Cu\left( {0,04} \right)} \end{array}} \right.}\\ {{\rm{dd}}\left\{ {\begin{array}{*{20}{l}} {N{a^ + }}\\ {F{e^{2 + }}\left( x \right)}\\ {NO_3^ - } \end{array}} \right.}\\ {NO\left( y \right)}\\ {{H_2}O} \end{array}} \right.\)
BTBT(Cu): nCu = 0,04
BT e: 2x = 0,04.2 + 3y
BTNT (N): \({n_{NO_3^ - \left( {{\rm{dd}}} \right)}} = 0,5 – y\)
BTDT: 2x + 0,18 = 0,5 - y
\(\to \left\{ \begin{array}{l} x = 0,13\\ y = 0,06 \end{array} \right.\)
\(56z + 0,04.64 = 0,75\left( {56x + 56z} \right)\)
\( \to z = \frac{{29}}{{140}} \to m = \left( {0,13 + \frac{{29}}{{140}}} \right)56 = 18,88\left( g \right)\)
X, Y là hai axit cacboxylic đều hai chức, mạch hở thuộc cùng dãy đồng đẳng kế tiếp; Z và T là hai este thuần chức hơn kém nhau 14 đvC, đồng thời Y và Z là đồng phân của nhau (MX < MY < MT). Đốt cháy 11,52 gam hỗn hợp E chứa X, Y, Z, T cần dùng 7,168 lít O2 (đktc). Mặt khác, để tác dụng hết với 11,52 gam E cần dùng 200 ml dung dịch NaOH 1M thu được 2,8 gam hỗn hợp gồm 3 ancol có cùng số mol. Số mol của X trong E là
Đốt cháy 11,52 gam hỗn hợp E cần 0,32 mol O2.
Mặt khác để tác dụng với hết lượng E trên cần 0,2 mol NaOH thu được 2,8 gam 3 ancol cùng số mol.
Vì X, Y, Z, T đều 2 chức nên
Mặt khác: \({n_{O\left( E \right)}} = 0,4mol\)
BTKL: \({m_{C{O_2}}} + {m_{{H_2}O}} = 11,52 + 0,32.32 = 21,76gam\)
BTNT O: \(2{n_{C{O_2}}} + {n_{{H_2}O}} = 0,32.2 + 0,4 = 1,04mol\)
Giải được số mol CO2 và H2O lần lượt là 0,38 và 0,28 mol
Mặt khác ta thấy: \({n_E} = {n_{C{O_2}}} - {n_{{H_2}O}}\)
nên các chất trong E đều no 2 chức
Ta có: \(\overline {{C_E}} = \frac{{0,38}}{{0,1}} = 3,8\)
mà X,Y là hai axit đồng đẳng kế tiếp, Y là đồng phân của Z, và Z là este 2 chức nên Z có ít nhất 4 C nên Y có ít nhất 4C, vậy X có ít nhất 3C.
Vậy X là C3H4O4, Y là C4H6O4, Z là C4H6O4 và T là C5H8O4.
Nhận thấy Z phải là CH3OOC-COOCH3 hoặc HCOOCH2CH2OOCH mà cho E tác dụng với NaOH thu được 3 ancol cùng số mol.
Vậy T phải tạo được 2 ancol nên T là CH3OOC-COOC2H5 nên Z phải là HCOOCH2CH2OOCH.
Gọi số mol của X, Y lần lượt là x, y, Z, T đều có số mol là z
Ta có: \({m_{ancol}} = 32z + 62z + 46z = 2,8 \to z = 0,02mol\)
→ x + y + 0,02.2 = 0,1
Và 3x + 4y + 0,02.3 + 0,02.5 = 0,38
Giải được:
Hòa tan hết m gam hỗn hợp gồm Na, Na2O, Ba và BaO vào nước, thu được 0,15 mol khí H2 và dung dịch X. Sục 0,32 mol khí CO2 vào dung dịch X, thu được dung dịch Y chỉ chứa các muối và kết tủa Z. Chia dung dịch Y làm 2 phần bằng nhau.
+ Cho từ từ phần 1 vào 200 ml dung dịch HCl 0,6M thấy thoát ra 0,075 mol khí CO2.
+ Nếu cho từ từ 200 ml dung dịch HCl 0,6M vào phần 2, thấy thoát ra 0,06 mol khí CO2.
Các phản ứng xảy ra hoàn toàn. Giá trị của m là:
+Cho từ từ phần 1 vào 0,12 mol HCl thu được 0,075 mol khí CO2.
Gọi số mol HCO3- và CO32- phản ứng lần lượt là a,b.
→ a + b = 0,075,a + 2b = 0,12
Giải được: a=0,03; b=0,045.
Do vậy tỉ lệ HCO3- và CO32- trong dung dịch Y là 1:1,5.
+Cho từ từ 0,12 mol HCl vào phần 2 thu được 0,06 mol khí CO2.
\( \to {n_{CO_3^{2 - }}} = 0,12 - 0,06 = 0,06mol\)
Do vậy trong mỗi phần chứa 0,04 mol HCO3- và 0,06 mol CO32-.
Vậy Y chứa 0,08 mol HCO3- và 0,12 mol CO32-.
Bảo toàn C: \({n_{BaC{O_3}}} = 0,32 - 0,12 - 0,08 = 0,12mol\)
Bảo toàn điện tích Y chứa 0,32 mol Na+.
Vậy hỗn hợp ban đầu chứa 0,32 mol Na, 0,12 mol Ba và O.
Bảo toàn e: \({n_{NO}} = \frac{{0,32 + 0,12.2 - 0,15.2}}{2} = 0,13\)
→ m = 25,88gam
Tiến hành thí nghiệm điều chế isoamyl axetat theo các bước sau đây:
Bước 1: Cho 1 ml CH3CH(CH3)CH2CH2OH, 1 ml CH3COOH và vài giọt dung dịch H2SO4 đặc vào ống nghiệm.
Bước 2: Lắc đều ống nghiệm, đun cách thủy (trong nồi nước nóng) khoảng 5 - 6 phút ở 65 – 700C.
Bước 3: Làm lạnh, sau đó rót 2 ml dung dịch NaCl bão hòa vào ống nghiệm.
Phát biểu nào sau đây đúng?
Xét lần lượt từng mệnh đề:
1. H2SO4 đặc chỉ có vai trò làm chất xúc tác cho phản ứng.
=> Sai. H2SO4 đặc có vai trò làm chất xúc tác, hút ẩm và làm tăng hiệu suất của phản ứng.
2. Mục đích chính của việc thêm dung dịch NaCl bão hòa là để tránh phân hủy sản phẩm.
=> Sai. Mục đích chính của việc thêm dung dịch NaCl bão hòa là để tạo hiện tượng tách lớp rõ ràng hơn.
3. Sau bước 2, trong ống nghiệm vẫn còn CH3CH(CH3)CH2CH2OH và CH3COOH.
=> Đúng. Vì đây là phản ứng thuận nghịch.
4. Sau bước 3, chất lỏng trong ống nghiệm trở thành đồng nhất.
=> Sai. Chất lỏng trong ống nghiệm trở nên tách lớp.
Cho m gam hỗn hợp X gồm Al4C3 và CaC2 vào nước dư thu được dung dịch Y; a gam kết tủa Z và hỗn hợp khí T. Lọc bỏ kết tủa. Đốt cháy hoàn toàn khí T rồi dẫn sản phẩm cháy vào dung dịch Y thu được thêm a gam kết tủa nữa. Trong hỗn hợp X, tỉ lệ mol giữa Al4C3 và CaC2 được trộn là
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CaC2 + 2H2O → C2H2 + Ca(OH)2 .
\(\left\{ \begin{array}{l} A{l_4}{C_3}:x{\rm{ mol}}\\ {\rm{Ca}}{{\rm{C}}_2}:y{\rm{ mol}} \end{array} \right. \to T\left\{ \begin{array}{l} C{H_4}:3x\\ {C_2}{H_2}:y \end{array} \right. \to \left\{ \begin{array}{l} {H_2}O\\ C{O_2}:3x + y \end{array} \right.\)
2Al(OH)3 + Ca(OH)2 → Ca(AlO2)2 + 4H2O
4x y
2y ← y → y
4x – 2y - y
Ca(AlO2)2 + 2CO2 + 4H2O → 2Al(OH)3 + Ca(HCO3)2.
\(\left\{ \begin{array}{l} Y:Ca{\left( {Al{O_2}} \right)_2}\left( y \right) \to Al{\left( {OH} \right)_3}\\ Z:Al{\left( {OH} \right)_3}\left( {4x - 2y} \right) \end{array} \right.\)
Vì cùng thu được a gam kết tủa nên có: 4x – 2y = 2y → x = y
Nên tỉ lệ trong hh X là: 1 : 1.
Hỗn hợp X gồm ba este đều no, mạch hở và có tỉ lệ mol là 7 : 5 : 3, trong mỗi phân tử este chỉ chứa một loại nhóm chức. Đun 34,4 gam X với 260 gam dung dịch NaOH 8% vừa đủ, thu được hỗn hợp Y gồm các ancol và 37,6 gam hỗn hợp Z gồm các muối của các axit đơn chức. Hóa hơi hoàn toàn Y thì thể tích hơi chiếm 6,72 lít (đktc). Phần trăm khối lượng của muối có khối lượng phân tử nhỏ nhất trong Z là:
\(34,4\left( g \right) \to \left\{ \begin{array}{l} Y:0,3mol\\ Z:37,6g \end{array} \right.\)
\({n_{{\rm{COO}}}} = {n_{OH}} = {n_{{\rm{COONa}}}} = {n_{NaOH}} = 0,52mol\)
\({n_Y} = 0,3mol < {n_{NaOH}}\)
Vậy chứng tỏ có ancol đa chức.
\(Z\left\{ \begin{array}{l} HCOONa:0,52mol\\ C{H_2} \end{array} \right. \to {n_{C{H_2}}} = \frac{{37,6 - 0,52.68}}{{14}} = 0,16mol\)
\(\left\{ \begin{array}{l} {n_Y} = {n_{Este}} = 0,3mol\\ {n_{{E_1}}}:{n_{{E_2}}}:{n_{{E_3}}} = 7:5:3 \end{array} \right. \to \left\{ \begin{array}{l} {n_{{E_1}}} = 0,14mol\\ {n_{{E_2}}} = 0,1mol\\ {n_{{E_3}}} = 0,06mol \end{array} \right.\)
\({n_{C{H_2}}} = {n_{{E_2}}} + {n_{{E_3}}}\)
Chứng tỏ E2 và E3 cùng gốc axit và gốc này là CH3COO-
\(\to Z\left\{ \begin{array}{l} HCOONa:0,52 - 0,16 = 0,36mol\\ C{H_3}{\rm{COONa:0,16mol}} \end{array} \right. \to \% = 65,11\% \)
Đốt cháy m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm Cl và O thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chỉ chứa 2 muối. Cho AgNO3 dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác hòa tan hết m gam hỗn hợp X trên trong dung dịch HNO3 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất; đktc). Nồng độ C% của Fe(NO3)3 có trong dung dịch T gần nhất với giá trị nào sau đây ?
Có m(hh khí) = 6,11; n(hh khí) = 0,13
=> n(Cl2) = 0,05; n(O2) = 0,08.
Hòa tan hết Y trong HCl nên có: n(HCl) = 2.n(H2O) = 2.n(O2-) = 0,32 mol
- BTNT (Cl):
n(Cl- trong Z) = n(AgCl) = n(HCl) + n(Cl-) = 0,32 + 0,1 = 0,42. → m(AgCl) = 0,42.143,5 = 60,27 gam
→ m(kết tủa) = m(AgCl) + m(Ag) → m(Ag) = 73,23 – 60,27 = 12,96 → n(Ag) = 0,12 mol.
=> n(Fe2+) = 0,12.
BTĐT trong Z: 2.0,12 + 2.n(Cu) = 0,42 => n(Cu) = 0,09.
Vậy X chứa Fe (0,12) và Cu(0,09).
Khi X tác dụng HNO3, ta thấy: (0,12 × 3 + 0,09 × 2) ÷ 3 = 0,18 mol > n(NO) = 0,15 mol
có nghĩa là Fe không lên hết Fe3+ mà có 1 phần chỉ lên Fe2+
Khi phản ứng với HNO3: nFe(III) = a mol ; nFe(II) = bmol. ta có hệ:
a + b = 0,12
3a + 2b + 0,09.2 = 0,15.3
Giải hệ: a = 0,03; b = 0,09.
Vì HNO3 dùng hết, n(HNO3) = 4n(NO) = 0,6 mol → m(HNO3) = 37,8 → m(dd HNO3) = 120 gam.
→ BTKL: m(dd T) = m(X) + m(HNO3) – m(NO) = 127,98 gam.
C%(Fe(NO3)3 trong T) = 0,03 . 242 : 127,98 ≈ 5,67%.
Cho X là peptit được tạo thành từ các α-amino axit no, mạch hở, có chứa 1 nhóm -COOH, 1 nhóm –NH2 trong phân tử, Y và Z là 2 axit thuộc dãy đồng đẳng của axit acrylic, T là este tạo bởi Y, Z và etylen glicol. Đốt cháy hoàn toàn 11,76 gam hỗn hợp E gồm X, Y, Z, T (nX = nT) cần dùng 0,535 mol O2 thu đc 6,48 gam H2O. Mặt khác, đun nóng 11,76 gam hỗn hợp E trong 160ml dung dịch NaOH 1M vừa đủ, cô cạn dung dịch sau phản ứng, lấy phần rắn đem nung với vôi tôi xút (dư) thì được hỗn hợp khí F có tỉ khối hơi so với He là 8,375. Số liên kết peptit trong X là
Đồng đẳng hóa quy hỗn hợp E về C2H3NO, CH2, H2O, C2H3COOH và C2H6O2
Để ý rằng số mol X = số mol T. Khi đồng đẳng hóa E thì X tách H2O và este bổ sung 2H2O
Số mol H2O trong E = - số mol C2H6O2
Trong E gồm x mol C2H3NO, y mol CH2, z mol H2O, t mol C2H3COOH và –zmol C2H6O2
Khối lượng E = 57x + 14y +18z + 72t – 62z = 11,76
Số mol H2O = 1,5x + y +z +2t – 3z = 0,36
Bảo toàn KL có khối lượng CO2 + N2 = 22,4 (2x + y + 3t – 2z).44 + 14x = 22,4
Phản ứng với NaOH xó x + t = 0,16
Giải hệ ta được x = 0,06, y = 0,05, z = -0,01 và t = 0,1mol
Số mol peptit = 0,01mol và số mắt xích trong peptit = 6
Số liên kết peptit trong X = 5.

