Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Lý Thái Tổ
Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Lý Thái Tổ
-
Hocon247
-
40 câu hỏi
-
90 phút
-
23 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Thủy tinh hữu cơ plexiglas là loại chất dẻo rất bền, trong suốt nên có thể được sử dụng làm kính ô tô, kính xây dựng. Polime dùng để chế tạo thủy tinh hữu cơ có tên gọi là poli
Polime dùng để chế tạo thủy tinh hữu cơ có tên gọi là poli metyl metacrylat
Thí nghiệm Fe chỉ bị ăn mòn hóa học là
Thí nghiệm Fe chỉ bị ăn mòn hóa học là đốt cháy dây Fe trong không khí khô.
Cho hỗn hợp gồm Fe(NO3)2 và Al2O3 vào dung dịch H2SO4 (loãng, dư) thu được dung dịch X. Cho dung dịch KOH dư vào X thu được kết tủa Y. Kết tủa Y có
Kết tủa Y có Fe(OH)3.
Các tơ nào đều là tơ tổng hợp?
Các tơ nilon-6,6 và nitron. đều là tơ tổng hợp
Cho 0,10 mol Ba vào dung dịch chứa 0,12 mol HCl và 0,15 mol CuSO4. Sau khi các phản ứng xảy ra hoàn toàn, lọc lấy kết tủa nung ở nhiệt độ cao đến khối lượng không đổi thu được x gam chất rắn. Giá trị của x là
Đáp án D
phản ứng: Ba + HCl + H2O → 0,06 mol BaCl2 + 0,04 mol Ba(OH)2 + 0,1 mol H2.
sau đó: 0,1 mol Ba2+ + 0,15 mol SO42– ||→ tạo 0,1 mol BaSO4↓ (tính theo Ba).
0,08 mol OH– + 0,15 mol Cu2+ ||→ 0,04 mol Cu(OH)2↓ (tính theo OH–).
Nung BaSO4 vẫn là BaSO4; nung Cu(OH)2 → CuO
||→ x gam gồm 0,04 mol CuO và 0,1 mol BaSO4 ||→ x = 26,5 gam. Chọn đáp án D
Cho x mol Ca(OH)2 vào dung dịch A chứa Mg2+ (0,10 mol), Na+ (0,15 mol), Cl– (0,15 mol) và HCO3– thì dung dịch A không còn tính cứng. Giá trị tối thiểu của x là
Đáp án B
bảo toàn điện tích xác định A gồm: 0,1 mol Mg2+; 0,15 mol Na+; 0,15 mol Cl– và 0,2 mol HCO3–.
► chú ý: dùng Ca(OH)2 làm mất tính cứng của A là một tình huống "may mắn" và cần cân đo đong đếm.!
lí do dùng Ca(OH)2 thì chính thêm Ca2+ vào rồi, làm mất không được lại còn thêm.!
Tuy nhiên, "may" ở đây là nếu thêm 0,1 mol Ca(OH)2 vào sẽ cung cấp 0,2 mol OH–.
Xảy ra OH– + HCO3– → CO32– + H2O tủa hết Mg2+ và Ca2+ mới thêm.
Cái "may" này có điều kiện, chỉ cần nước là cứng tạm thời + thêm Ca(OH)2 "khéo" (vừa đủ) là ok.!
(ở tình huống này như các em thấy là ghép vừa khít Cl cho Na tạo 0,15 mol NaCl, phần còn lại là nước cứng tạm thời đó.!).
Cho các phát biểu sau:
(a) Thép là hợp kim của sắt chứa từ 2-5% khối lượng cacbon.
(b) Bột nhôm trộn với bột sắt (III) oxit dùng để hàn đường ray bằng phản ứng nhiệt nhôm.
(c) Dùng Na2CO3 để làm mất tính cứng tạm thời và tính cứng vĩnh cửu của nước.
(d) Dùng bột lưu huỳnh để xử lí thủy ngân rơi vãi khi nhiệt kế bị vỡ.
(e) Khi làm thí nghiệm kim loại đồng tác dụng với dung dịch HNO3, người ta đậy nút ống nghiệm bằng bông tẩm dung dịch kiềm.
Số phát biểu đúng là
Đáp án C
Hướng giảiF[Vận dụng] (a) Sai vì thép chứa từ 0,01 – 2 % hàm lượng cacbon.
Cho 6,58 gam chất X tác dụng mãnh liệt với 100 gam H2O tạo ra dung dịch Y. Cho Y tác dụng với một lượng BaCl2 thấy tạo ra 4,66 gam kết tủa trắng và dung dịch Z. Cho Z tác dụng với kim loại Zn dư thu được 1,792 lít H2 (đktc) và dung dịch E. Nồng độ phần trăm của chất có trong phân tử khối lớn nhất trong dung dịch E là
Đáp án C
kết tủa màu trắng với Ba; 4,66 gam ||→ là 0,02 mol BaSO4 → có 0,02 mol BaCl2.
Zn dư + dung dịch Z thu 0,08 mol H2 ||→ có 0,16 mol H+ trong Z
||→ có 0,04 mol HCl (Cl suy từ 0,02 mol BaCl2) + 0,06 mol H2SO4 (bảo toàn H).
Vậy tổng nSO4 = 0,08 mol. chú ý X phản ứng mãnh liệt với H2O sinh H2SO4 ||→ X là oleum.
biết khối lượng, số mol ||→ xác định được X là H2SO4.7SO3.
Tuy nhiên, đọc yêu cầu: trong E chứa 0,02 mol ZnCl2 và 0,06 mol ZnSO4Lại có mE = 100 + 6,58 + 0,02 × 208 – 4,66 + 0,08 × 65 – 0,08 × 2 = 111,12 gam. MZnSO4 >MZnCl2
||→ Yêu cầu %mZnSO4 trong E = 0,06 × 161 ÷ 111,12 ≈ 8,69%. Chọn đáp án C.
Cho các chất sau: H2NCH2COOH (X), CH3COOH3NCH3 (Y), C2H5NH2 (Z), H2NCH2COOC2H5 (T). Dãy gồm các chất đều tác dụng được với dung dịch NaOH và dung dịch HCl là
Đáp án B
Hòa tan hoàn toàn x gam hỗn hợp A gồm Al2O3 và Al trong 250,0 ml dung dịch NaOH 1,6M thu được dung dịch B và 3,36 lít khí H2 (đktc). Thêm 240,0ml hoặc 560,0 ml dung dịch HCl 1,25M vào dung dịch B đều thu được cùng một lượng kết tủa có khối lượng x gam. Giá trị gần nhất của x là
Đáp án D
Xử lí đặc trưng, YTHH 03: thêm 0,15 mol O vào A (0,15 mol O ⇄ 0,15 mol H2)
quy về (x + 2,4) gam A chỉ chứa ½.b mol Al2O3 ||→ 51b = x + 2,4 (1).
hòa tan hoàn toàn ||→ dung dịch B chứa NaOH và NaAlO2. khi cho HCl vào xảy ra các phản ứng:
NaOH + HCl → NaCl + H2O || 1NaAlO2 + 1HCl + 1H2O → 1Al(OH)3 + 1NaCl.
nếu HCl còn dư thì 3HCl + 1Al(OH)3 → 1AlCl3 + 3H2O. THẬT chú ý tỉ lệ → có đồ thị:
||→ quan sát → có phương trình:4b = a + (0,7 – 0,3) + 3a ⇄ b = a + 0,1 (2).
Lại có a là số mol của x gam kết tủa Al(OH)3 nên x = 78a (3).
Từ (1), (2), (3) thế hoặc giải hệ đều có x = 7,8 gam.
Hỗn hợp X gồm 2 este đơn chức A, B. Cho 0,05 mol X tác dụng vừa đủ với dung dịch NaOH thu được hỗn hợp sản phẩm hữu cơ Y. Đốt cháy hoàn toàn Y thu được 2,688 lít CO2 (đktc) và 3,18 gam Na2CO3. Khi làm bay hơi Y thu được x gam chất rắn. Giá trị của x là
Đáp án A
Ta có: X + NaOH → ? + Y || đốt Y + O2 → 0,03 mol Na2CO3 + 0,12 mol CO2 + ? mol H2O.
X đơn chức, 0,05 mol mà NaOH dùng lại là 0,06 mol ||→ X có este của phenol, số mol 0,01 ||→ este kia 0,04 mol.
Y là hỗn hợp các chất hữu cơ nên ∑nC trong X = ∑nC trong Y = 0,03 + 0,12 = 0,15 mol.
X gồm 0,01 mol este Cm (este của phenol nên m ≥ 7); 0,04 mol este Cn (este thường, n ≥ 2).
Nghiệm nguyên: 0,01m + 0,04n = ∑nC trong X = 0,15 ⇄ m + 4n = 15. điều kiện ||→ duy nhất (m; n) = (7; 2) thỏa mãn.
||→ Các este là HCOOC6H5 và HCOOCH3 ||→ muối trong Y gồm 0,05 mol HCOONa và 0,01 mol C6H5Ona
||→ Yêu cầu mrắn = 0,05 × 68 + 0,01 × 116 = 4,56 gam. Chọn đáp án A.
Dung dịch X gồm 0,02 mol Cu(NO3)2 và 0,1 mol H2SO4. Khối lượng Fe tối đa phản ứng được với dung dịch X là (biết NO là sản phẩm khử duy nhất của NO3-)
Đáp án B
Fe dùng tối đa nên sinh Fe2+
|
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O 0,06 0,16 ¬ 0,04 Dư 0,04 |
Fe + Cu2+ → Fe2+ + Cu 0,02 ¬ 0,02 |
Fe + 2H+ ® Fe2+ + H2 0,02 ¬0,04
|
→mFe = 5,6 gam
A là hỗn hợp gồm Mg và MgO (MgO chiếm 40% khối lượng). B là dung dịch gồm H2SO4 và NaNO3. Cho 6,0 gam A tan hoàn toàn vào B thu được dung dịch D (chỉ chứa 3 muối trung hòa) và hỗn hợp 2 khí (gồm khí X và 0,04 mol H2). Cho dung dịch BaCl2 dư vào D, thu được 55,92 gam kết tủa. Biết D có khả năng tác dụng vừa đủ với dung dịch chứa 0,44 mol KOH. X là
Đáp án D
Quan sát sơ đồ và một số xử lí giả thiết cơ bản:
đặc trưng: KOH xử lí dung dịch sau phản ứng: K và đừng quên Na trong D sẽ đi về đâu?
Và đi về 0,22 mol K2SO4 và Na2SO4 mà SO4 có 0,24 mol → nNa = 0,04 mol.
Dung dịch D đã biết 0,24 mol SO42–; 0,21 mol Mg2+ và 0,04 mol Na+ ||→ đọc ra có 0,02 mol NH4+.
Trước đó để ý ta suy từ Na ra có 0,04 mol NaNO3 và từ SO4 ra 0,24 mol H2SO4.
||→ bảo toàn N có nN spk = 0,02 mol; bảo toàn H có nH2O = 0,16 mol
||→ bỏ sụm SO4 2 vế rồi bảo toàn O có ngay nO spk = 0,02 mol.
Tỉ lệ nN spk ÷ nO spk = 1 ÷ 1 đọc cho ta biết khí X spk là NO.
Cho hỗn hợp A gồm Al, Mg, Ag nặng 25,24 gam tác dụng vừa đủ với 525 gam dung dịch HNO3 30% thu được 4,48 lít (đktc) hỗn hợp khí B gồm N2 và N2O có dB/H2 = 18 và dung dịch D chứa x gam muối. Cô cạn dung dịch D rồi nung chất rắn thu được đến khối lượng không đổi thu được y gam chất rắn (khan). Giá trị của (x – y) là
Đáp án D
Al, Mg + HNO3 không nhắc spk → "mùi" muối amoni, tránh quên.!
giải khí có B gồm 0,1 mol N2 và 0,1 mol N2O. không có oxit
||→ bảo toàn electron mở rộng: nHNO3 = 2,5 mol = 12nN2 + 10nN2O + 10nNH4NO3
||→ nNH4NO3 = 0,03 mol ||→ ∑nNO3– trong muối kim loại = 2,04 mol.
♦ Nhiệt phân muối nitrat gồm: Al(NO3)2 + Mg(NO3)2 + AgNO3 + 0,03 mol NH4NO3.
||→ thu được y gam rắn gồm Al2O3 + MgO + Ag và thoát: NO2 + O2 + (N2O + H2O).
||→ (x – y) chính là giá trị giảm rắn ⇄ gồm: 0,03 mol NH4NO3 + 2,04 mol NO2 và a mol O2.
Cần chú ý: muối nitrat nhôm và Mg đều cho 4NO2 + 1O2 || AgNO3 nhiệt phân thu 2NO2 + 1O2.
||→ 2,04 ÷ 4 = 0,51 mol < nO2 < 2,04 ÷ 2 = 1,02 mol. Kết hợp (x – y) theo trên
||→ chặn 112,56 gam < (x – y) < 128,88 gam. Quan sát A, B, C, D thấy mỗi D thỏa mãn
Cho hỗn hợp A gồm X, Y là hai este đều mạch hở, không phân nhánh và không chứa nhóm chức khác (MX < MY). Khi đốt cháy X cũng như Y với lượng O2 vừa đủ thì số mol O2 đã phản ứng bằng số mol CO2 thu được. Đun nóng 30,24 gam hỗn hợp A (số mol X gấp 1,5 lần số mol Y) cần dùng 400ml dung dịch KOH 1M, thu được hỗn hợp B chứa 2 ancol và hỗn hợp D chứa 2 muối. Dẫn toàn bộ B qua bình đựng Na dư thấy khối lượng bình tăng 15,2 gam. Đốt cháy hoàn toàn hỗn hợp D cần dùng 0,42 mol O2. Tổng số nguyên tử có trong Y là
Đáp án A
hỗn hợp A gồm X, Y dạng Ca(H2O)b (đốt có nO2 cần đốt = nCO2).
cần chú ý nchức ancol –OH = nKOH = 0,4 mol ||→ mancol = 15,2 + 0,4 ÷ 2 × 2 = 15,6 gam.
♦ Thủy phân: 30,24 gam A + 0,4 mol KOH → 2 muối D + 15,6 gam 2 ancol B
||→ mmuối D = 37,04 gam (theo BTKL). Giải đốt D: đủ giả thiết
Đốt 37,04 gam muối D cần 0,42 mol O2 → 0,2 mol K2CO3 + x mol CO2 + y mol H2O.
bảo toàn O + bảo toàn khối lượng ||→ đủ giải ra x = 0,52 mol và y = 0 mol.
► X, Y không phân nhánh ||→ có không quá 2 chức, este không phải là vòng (*)
kết hợp y = 0 cho biết muối không chứa nguyên tố H
||→ 2 muối đều 2 chức dạng Ce(COOH)2 (với e phải chẵn)
Lại biết tỉ lệ số mol X, Y là 1,5 ||→ nX = 0,12 mol và nY = 0,08 mol.
số Caxit tạo X = m; số Caxit tạo Y = n (m, n nguyên dương và chẵn)
||→ nghiệm nguyên: 0,12m + 0,08n = ∑nC trong muối = 0,72 mol ⇄ 3m + 2n = 18
||→ duy nhất cặp chẵn m = 2; n = 6 thỏa mãn ||→ axit tạo X là (COOH)2 và Y là C4(COOH)2.
Mặt khác: X, Y dạng Ca(H2O)4; gốc axit không chứa H → ∑gốc ancol có 8H.
Lại có ở (*) cho biết hai ancol phải là đơn chức nên nB = 0,4 mol; MB = 15,6 ÷ Ans = 39
||→ có ancol là CH3OH; gốc ancol này có 3C → còn 5C trong gốc ancol còn lại → là C2H5
Vậy đã rõ: X là H3C-OOC-COOC2H5 và Y là H3C-OOC-C≡C-C≡C-COOC2H5.
ĐỌc yêu cầu, xem lại Y có CTPT C9H8O4 ||→ ∑số nguyên tử = 21.
Cấu hình electron của nguyên tử S (Z=16) là
Cấu hình electron của nguyên tử S (Z=16) là 1s22s22p63s23p4
Loại phản ứng nào luôn luôn là phản ứng oxi hóa – khử?
Phản ứng thế trong hóa học vô cơ luôn luôn là phản ứng oxi hóa – khử
Oxi có thể thu được từ phản ứng nhiệt phân chất nào sau đây?
Oxi có thể thu được từ phản ứng nhiệt phân KMnO4
Cho phenolphtalein vào dung dịch nào sau đây sẽ hóa hồng ?
Cho phenolphtalein vào dung dịch KOH sẽ hóa hồng
Công thức phân tử khí metan là
Công thức phân tử khí metan là CH4.
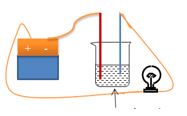
Cho sơ đồ thử tính dẫn điện của các chất như hình vẽ. Bóng đèn không sáng khi X là
Bóng đèn không sáng khi X là dung dịch saccarozo (đường)
Este C2H5COOCH3 có tên là
Este C2H5COOCH3 có tên là etyl propionat
Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là gì?
Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là ns1
Chất nào sau đây thuộc loại đisaccarit ?
Saccarozơ thuộc loại đisaccarit
Trong các khí dưới đây, nguyên nhân chính gây ra hiệu ứng nhà kính là chất nào?
nguyên nhân chính gây ra hiệu ứng nhà kính là CO2
Trường hợp không xảy ra phản ứng hoá học là
Ag + dung dịch FeCl2 không xảy ra phản ứng hóa học
Thạch cao sống có công thức là gì?
Thạch cao sống có công thức là CaSO4.2H2O.
Trong số các kim loại sau, kim loại nào cứng nhất?
Cr là kim loại cứng nhất
Phản ứng thủy phân este trong môi trường kiềm, đun nóng được gọi là phản ứng
Phản ứng thủy phân este trong môi trường kiềm, đun nóng được gọi là phản ứng xà phòng hóa
Chất nào sau đây có thể dùng để làm mềm nước cứng có tính cứng vĩnh cửu ?
Na2CO3 có thể dùng để làm mềm nước cứng có tính cứng vĩnh cửu
Cho các dung dịch có cùng nồng độ, dãy dung dịch nào sau đây được sắp xếp theo chiều tăng dần về độ pH ?
Dãy dung dịch được sắp xếp theo chiều tăng dần về độ pH: HNO3, NaCl, KOH
Thuốc thử duy nhất có thể dùng để phân biệt 3 chất lỏng phenol, stiren và ancol benzylic là
Thuốc thử duy nhất có thể dùng để phân biệt 3 chất lỏng phenol, stiren và ancol benzylic là dung dịch Brom.
Dãy nào sau đây đều tác dụng với Na ?
Dãy đều tác dụng với Na: C2H5OH, HCOOH
Dãy gồm các chất nào sau đây không bị thủy phân ?
Dãy chất không bị thủy phân : Glucozơ, axit axetic, fructozơ.
Cho phản ứng: C4H8O2 + NaOH → muối + ancol bậc 2. Công thức cấu tạo của C4H8O2 là ?
Công thức cấu tạo của C4H8O2 là HCOOCH(CH3)2
Khi cho từ từ khí CO2 đến dư vào dung dịch NaAlO2. Hiên tượng quan sát được là
Khi cho từ từ khí CO2 đến dư vào dung dịch NaAlO2. Hiên tượng quan sát được là xuất hiện kết tủa keo trắng
Thủy phân không hoàn toàn tetrapeptit X mạch hở, thu được hỗn hợp sản phẩm trong đó có Gly–Ala, Phe-Val và Ala-Phe. Cấu tạo của X là
Cấu tạo của X là Gly-Ala-Phe-Val.
Cho phản ứng: NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O. Sau khi cân bằng với các số nguyên tối giản thì hệ số của NaCrO2 là
2NaCrO2 + 3Br2 + 8NaOH → 2Na2CrO4 + 6NaBr + 4H2O

.JPG)