Đề thi thử THPT QG năm 2022 môn Hóa học - Trường THPT Phạm Công Bình
Đề thi thử THPT QG năm 2022 môn Hóa học - Trường THPT Phạm Công Bình
-
Hocon247
-
40 câu hỏi
-
90 phút
-
34 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Ancol và amin nào sau đây cùng bậc?
CH3CH(NH2)CH3 là amin bậc 1 và CH3CH2OH là ancol bậc 1. → Đáp án C
Cho số hiệu nguyên tử của các nguyên tố sau: Na(Z=11); K(Z=19); Ca(Z=20); Cl(Z=17). Ion nào sau đây có cấu hình electron 1s22s22p6?
Cấu hình e của các ion:
Na+: 1s22s22p6;
Cl-; Ca2+ và K+ đều có cấu hình e: 1s22s22p63s23p6;
Đáp án A.
Trong các cặp chất dưới đây, cặp chất nào không cùng tồn tại trong dung dịch?
Các cặp chất: NaCl và Ba(NO3)2; AlCl3 và CuSO4; Na2CO3 và KOH; đều không có phản ứng.
Cặp chất NaOH và NaHCO3 có phản ứng nên không thể cùng tồn tại trong dung dịch:
NaOH + NaHCO3 → Na2CO3 + H2O; → Đáp án D.
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Mg (Z = 12) là
Cấu hình e của nguyên tử Mg (Z = 12) là: 1s22s22p63s2.
Đáp án B.
Để nhận biết ion \(NO_3^ - \) trong dung dịch có thể dùng thuốc thử nào sau đây?
Để nhận biết ion NO\(_{3}^{-}\) trong dung dịch có thể dùng thuốc thử là Cu và dd H2SO4 loãng vì có hiện tượng Cu tan tạo khí không màu hóa nâu trong không khí:
3Cu + 8H+ + 2NO\(_{3}^{-}\) → 3Cu2+ + 2NO + 4H2O;
2NO + O2 → 2NO2 (khí màu nâu đỏ);
→ Đáp án D.
Nồng độ phần trăm của dung dịch tạo thành khi hòa tan 23 gam natri kim loại vào 178 gam nước là kết quả nào sau đây?
Ta có: nNa = nNaOH = 1 mol; n\(_{{{\text{H}}_{2}}}\)= 0,5 mol;
Khối lượng dd sau pư: mdds = mNa + m\(_{{{\text{H}}_{2}}\text{O}}\)- m\(_{{{\text{H}}_{2}}}\) = 23 + 178 – 0,5×2 = 200(g);
C%(NaOH) = \(\frac{40}{200}\times 100%\)= 20%; → Đáp án D.
Số nguyên tử H có trong phân tử vinyl axetat là
Công thức của vinyl axetat là: CH3COOCH = CH2; → có 6 nguyên tử H
Đáp án A.
Thí nghiệm nào sau đây chứng tỏ trong phân tử glucozơ có nhiều nhóm OH kề nhau?
Cho glucozơ tác dụng với Cu(OH)2 tạo dung dịch có màu xanh lam.
Đáp án D
Ảnh hưởng của gốc C6H5 đến nhóm NH2 trong phân tử anilin thể hiện qua phản ứng giữa anilin với chất nào sau đây?
Gốc C6H5 hút e làm cho mật độ e trên nguyên tử N giảm; → Tính bazơ giảm nên quỳ tím không đổi màu; → Đáp án A.
Hợp chất nào sau đây không thuộc loại đipeptit ?
Hợp chất H2N-CH2CH2CONH-CH2-CH2COOH có 1 liên kết CO-NH nhưng không phải liên kết giữa các đơn vị a-aminoaxit nên không phải đi peptit; → Đáp án B
Kim loại nào sau đây không khử được ion Cu2+ trong dung dịch CuSO4 thành Cu?
Trong dd K khử H2O nên không khử được ion Cu2+ thành Cu;
Đáp án D.
Cho sơ đồ chuyển hóa sau: Alanin (+ HCl) → X (+ NaOH) → Y
Chất Y là chất nào sau đây?
Các phản ứng: CH3 – CH(NH2) – COOH + HCl → CH3 – CH(NH3Cl) – COOH;
CH3 – CH(NH3Cl) – COOH + NaOH → CH3-CH(NH2)-COONa + NaCl + H2O;
Đáp án D.
Hợp chất hữu cơ X có công thức:
H2N – CH2 – COOH. X có tên gọi là
Hợp chất hữu cơ X có công thức: H2N – CH2 – COOH. X có tên gọi là Glyxin.
Đáp án A
Trong các phản ứng giữa các cặp chất sau, phản ứng nào thuộc loại phản ứng tăng mach polime?
Nhựa Rezol → Nhựa Rezit (cấu trúc mạng không gian, làm tăng mạch polime).
→ Đáp án A.
Dung dịch H2SO4 loãng phản ứng được với kim loại nào sau đây?
dd H2SO4 loãng pư với Fe: H2SO4 + Fe → FeSO4 + H2.
→ Đáp án C.
Chất nào sau đây không bị thủy phân?
Fructozơ thuộc loại monosacarit nên không bị thủy phân. Þ Đáp án B.
Cho số hiệu nguyên tử của các nguyên tố sau: Na(Z=11); Mg(Z=12); Al(Z=13); K(Z=19). Dãy nào sau đây được sắp xếp theo thứ tự tính kim loại giảm dần?
Trong các kim loại đã cho:
- Các kim loại Na, Mg, Al cùng thuộc chu kỳ III tính kim loại giảm dần nên: Na>Mg>Al.
- Các kim loại Na và K cùng thuộc nhóm IA tính kim loại tăng dần nên: Na<K.
Vậy tính kim loại giảm dần theo dãy: K; Na; Mg; Al. →Đáp án C.
Phương trình hóa học nào sau đây viết sai?
Phản ứng của Cu và HNO3 không tạo sản phẩm là H2 vì ion H+ không oxi hóa được Cu. → Đáp án D.
Este (X) được tạo thành từ axit axetic và ancol metylic có công thức phân tử là
Este (X) được tạo thành từ axit axetic và ancol metylic có CT là: CH3COOCH3.
→ CTPT: C3H6O2. Đáp án A.
Sản phẩm hữu cơ của phản ứng nào sau đây được dùng để chế tạo tơ tổng hợp?
Trùng hợp vinyl xianua (thường được gọi là acrilonitrin) thu được polime là poliacrilonitrin dùng để sản xuất tơ nitron hay tơ olon.
Đáp án C.
Tiến hành các thí nghiệm sau:
(1) Cho dung dịch NaOH vào dung dịch Ca(HCO3)2.
(2) Cho dung dịch HCl tới dư vào dung dịch NaAlO2 (hoặc Na[Al(OH)4]).
(3) Sục khí H2S vào dung dịch FeCl3.
(4) Sục khí NH3 tới dư vào dung dịch AlCl3.
(5) Sục khí CO2 tới dư vào dung dịch NaAlO2 (hoặc Na[Al(OH)4]).
Sau khi các phản ứng kết thúc, có bao nhiêu thí nghiệm thu được kết tủa?
Có 4 thí nghiệm thu được kết tủa là:
(1) Cho dung dịch NaOH vào dung dịch Ca(HCO3)2:
OH- + HCO3- → CO32- + H2O;
CO32- + Ca2+ → CaCO3¯.
(3) Sục khí H2S vào dung dịch FeCl3: H2S + 2Fe3+ → 2Fe2+ + S¯ + 2H+.
(4) Sục khí NH3 tới dư vào dung dịch AlCl3: 3NH3 + 3H2O + Al3+ → Al(OH)3¯ + 3NH .
(5) Sục khí CO2 tới dư vào dung dịch NaAlO2 (hoặc Na[Al(OH)4]):
CO2 + 2H2O + AlO2- → Al(OH)3 + HCO3-
→ Đáp án C.
Đun nóng 45,54 gam hỗn hợp E gồm hexapeptit X và tetrapeptit Y cần dùng 580 ml dung dịch NaOH 1M chỉ thu được dung dịch chứa muối natri của glyxin và valin. Mặt khác, đốt cháy cùng lượng E ở trên trong oxi vừa đủ thu được hỗn hợp CO2, H2O, N2, trong đó tổng khối lượng của CO2 và H2O là 115,18 gam. Công thức phân tử của peptit Y là
Theo bài ra ta có phương trình: 0,58(14n + 29) + 18x = 45,54;
Theo bảo toàn nguyên tố C, H: 0,58n × 44 + 18(0,58n – 0,29) + 18x = 115,18;
Giải hệ 2 pt trên ta được: n = 191/58; x = 0,11;
Gọi CT của peptit X là: (Gly)n(Val)6-n; Y là: (Gly)m(Val)4-m;
Ta có: \(\begin{array}{l} \left\{ \begin{array}{l} {\rm{X + 6NaOH}}\\ {\rm{Y + 4NaOH}} \end{array} \right\} \to {\rm{ muoi + }}{{\rm{H}}_2}{\rm{O}}\\ \left\{ \begin{array}{l} {{\rm{n}}_{\rm{X}}}{\rm{ + }}{{\rm{n}}_{\rm{Y}}}{\rm{ = 0,11}}\\ {\rm{6}}{{\rm{n}}_{\rm{X}}}{\rm{ + 4}}{{\rm{n}}_{\rm{Y}}}{\rm{ = }}{{\rm{n}}_{{\rm{NaOH}}}}{\rm{ = 0,58}} \end{array} \right. \to \left\{ \begin{array}{l} {{\rm{n}}_{\rm{X}}}{\rm{ = 0,07}}\\ {{\rm{n}}_{\rm{Y}}}{\rm{ = 0,04}} \end{array} \right. \end{array}\)
Theo bảo toàn mol C: 0,07(30 – 3n) + 0,04(20 – 3m) = 0,58.\(\frac{191}{58}\) = 1,91;
→ 7n + 4m = 33; Þ n = 3; m = 3;
Vậy CT phân tử của peptit Y là: (C2H3ON)3(C5H9ON)H2O; hay C11H20N4O5.
→ Đáp án C.
Cho dãy các chất: benzyl axetat, anlyl axetat, vinyl fomat, etyl fomat, tripanmitin. Số chất trong dãy khi thủy phân trong dung dịch NaOH (dư), đun nóng sinh ra ancol là
Có 4 chất khi thủy phân trong dd NaOH dư đun nóng sinh ra ancol là:
- Benzyl axetat sinh ra ancol là C6H5CH2OH:
CH3COOCH2-C6H5 + NaOH → CH3COONa + C6H5CH2OH.
- Anlyl axetat sinh ra ancol là CH2 = CH – CH2OH
CH3COOCH2-CH = CH2 + NaOH → CH3COONa + CH2 = CH–CH2OH.
- Etyl fomat sinh ra ancol là C2H5OH
HCOOC2H5 + NaOH→ HCOONa + C2H5OH.
- Tripanmitin sinh ra ancol là C3H5(OH)3
(C15H31COO)3C3H5 + 3NaOH → 3C15H31COONa + C3H5(OH)3.
→ Đáp án B.
Cho hỗn hợp gồm Fe và Mg vào dung dịch AgNO3 đến khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X gồm hai muối và chất rắn Y gồm hai kim loại. Hai muối trong dung dịch X là
Khi cho hỗn hợp Fe và Mg vào dd AgNO3 các phản ứng xảy ra theo thứ tự:
Mg + 2Ag+ → Mg2+ + 2Ag;
Fe + 2Ag+ → Fe2+ + 2Ag;
Sau khi pư xảy ra hoàn toàn thu được chất rắn Y gồm 2 kim loại là Ag và Fe còn dư.
→ ion Ag+ pư hết. Vậy 2 muối trong dd X là Mg(NO3)2 và Fe(NO3)2; → Đáp án B.
Cho các phát biểu sau về cacbohiđrat:
(a) Glucozơ và saccarozơ đều là chất rắn có vị ngọt, dễ tan trong nước.
(b) Tinh bột và xenlulozơ đều là polisaccarit.
(c) Trong dung dịch, glucozơ và saccarozơ đều hoà tan Cu(OH)2, tạo phức màu xanh lam.
(d) Khi thuỷ phân hoàn toàn hỗn hợp gồm tinh bột và saccarozơ trong môi trường axit, chỉ thu được một loại monosaccarit duy nhất.
(e) Khi đun nóng glucozơ (hoặc fructozơ) với dung dịch AgNO3 trong NH3 thu được Ag.
(g) Glucozơ và fructozơ đều tác dụng với H2 (xúc tác Ni, đun nóng) tạo sobitol.
Số phát biểu đúng là
Trong các phát biểu đã cho về cacbohiđrat:
- Các phát biểu đúng là: (a), (b), (c), (e), (g);
- Phát biểu (d) sai vì thủy phân saccarozơ thu được 2 loại monosaccarit là glucozơ và fructozơ.
→ Đáp án A.
Xà phòng hoá hoàn toàn m gam chất béo trung tính bằng dung dịch KOH dư thì thu được 18,77 gam xà phòng. Nếu thay dung dịch KOH bằng dung dịch NaOH dư thì chỉ thu được 17,81 gam xà phòng. Giá trị của m là
Ta có pư xà phòng hóa: (RCOO)3C3H5 + 3XOH → 3RCOONa + C3H5(OH)3.
Theo pt ta thấy:
Cứ 3 mol XOH pư thì khối lượng xà phòng tạo thành chênh lệch 3.(39 – 23) = 48 gam.
0,06 mol …………………………………………………(18,77 – 17,81) = 0,96 gam.
Vậy số mol glixerol tạo thành = 0,02
Theo bảo toàn khối lượng: mchất béo = 18,77 + 0,02 . 92 – 0,06 . 56 = 17,25 gam.
→ Đáp án B.
Cho 2 phương trình ion rút gọn
1) R2+ + X → R + X2+;
2) R + 2X3+ → R2+ + 2X2+
Nhận xét nào sau đây là đúng?
Từ pt (1): R2+ + X → R + X2+;
\(\left\{ \begin{array}{l}
{\rm{ - Tinh khu: X > R}}\\
{\rm{ - Tinh oxi hoa: }}{{\rm{R}}^{2 + }}{\rm{ > }}{{\rm{X}}^{2 + }}
\end{array} \right.\)
Từ pt (2): R + 2X3+ → R2+ + 2X2+
\(\left\{ \begin{array}{l}
{\rm{ - Tinh khu: R > }}{{\rm{X}}^{2 + }}\\
{\rm{ - Tinh oxi hoa: }}{{\rm{X}}^{3 + }}{\rm{ > }}{{\rm{R}}^{2 + }}
\end{array} \right.\)
Vậy: Tính oxi hóa: X3+ > R2+ > X2+; → Đáp án B.
Phản ứng giữa các chất nào sau đây không tạo ra hai muối?
Phản ứng giữa NO2 và dung dịch NaOH dư tạo 2 muối là NaNO3 và NaNO2.
Phản ứng giữa Ba(HCO3)2 và dung dịch KOH dư tạo 2 muối là BaCO3 và K2CO3.
Phản ứng giữa Fe3O4 và dung dịch HNO3 dư chỉ tạo 1 muối là Fe(NO3)3.
Phản ứng giữa Fe3O4 và dung dịch HCl dư tạo 2 muối là FeCl2 và FeCl3.
→ Đáp án C.
Cho 12,55 gam hỗn hợp rắn X gồm FeCO3, MgCO3 và Al2O3 tác dụng hoàn toàn với dung dịch H2SO4 và NaNO3 (trong đó tỷ lệ mol của H2SO4 và NaNO3 tương ứng là 19:1) thu được dung dịch Y (không chứa ion NO3-) và 2,464 lít khí Z (đktc) gồm NO, CO2, NO2 có tỷ khối hơi so với H2 là 239/11. Cho dung dịch Y tác dụng với dung dịch NaOH đến khi thu được kết tủa cực đại thấy có 0,37 mol NaOH tham gia phản ứng. Mặt khác, khi cho dung dịch Y tác dụng dung dịch NaOH dư đun nóng không thấy khí bay ra. Phần trăm về khối lượng của FeCO3 trong hỗn hợp X có giá trị gần nhất với giá trị nào sau đây?
Theo bảo toàn mol Na: n\(_{\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{4}}}\) = n\(_{{{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}}\)= \(\frac{1}{2}\)(nNaOH + n\(_{\text{NaN}{{\text{O}}_{3}}}\)); → 38a = 0,37 + a; Þ a = 0,01;
Ta có: nkhí Z = 0,11 mol; Bảo toàn N: nNO + n\(_{\text{N}{{\text{O}}_{2}}}\)= n\(_{\text{NO}_{3}^{-}}\)= 0,01; Þ n\(_{\text{C}{{\text{O}}_{2}}}\)= 0,1;
mkhí Z = \(\frac{239\times 2}{11}\times 0,11\) = 4,78 (g);
→ mNO + m\(_{\text{N}{{\text{O}}_{2}}}\)= 0,38 → 30nNO + 46n\(_{\text{N}{{\text{O}}_{2}}}\)= 0,38;
→ nNO = n\(_{\text{N}{{\text{O}}_{2}}}\)= 0,005; Theo bảo toàn mol e: ne nhận = ne cho = 3×0,005 + 0,005 = 0,02;
→ n\(_{\text{FeC}{{\text{O}}_{3}}}\)(oxi hóa khử) = n\(_{\text{F}{{\text{e}}^{3+}}}\)= 0,02;
→ 3×2z + 2y + 3×0,02 + 2(x – 0,02) = nNaOH = 0,37;
→ 6z + 2y + 2x = 0,35; Theo bài ra: x + y = n\(_{\text{C}{{\text{O}}_{2}}}\)= 0,1; → z = 0,025;
Từ đó ta có hệ pt: \(\left\{ \begin{align} & \text{x + y = 0,1} \\ & \text{116x + 84y = 10} \\ \end{align} \right.\)
→ x = y = 0,05; → %m\(_{\text{FeC}{{\text{O}}_{3}}}\)= 46,22%;
Đáp án A.
Hỗn hợp X gồm Ba, BaO, Na, Na2O và K. Cho m gam hỗn hợp X vào nước dư thu được 3,136 lít H2 (đktc); dung dịch Y chứa 7,2 gam NaOH; 0,93m gam Ba(OH)2 và 0,044m gam KOH. Hấp thụ 7,7952 lít CO2 (đktc) vào dung dịch Y thu được a gam kết tủa. Giá trị của a gần nhất với giá trị nào sau đây?
Dùng pp quy đổi.
hh X có: nBa = x; nK = y; nO = z; nNa = nNaOH = 0,18
\(n_{{{\text{H}}_{2}}}= 0,14; n_{\text{C}{{\text{O}}_{2}}}\)= 0,348;
\(x = \frac{0,93\text{m}}{171}=\text{ }\frac{0,31\text{m}}{57}; y = \frac{0,044\text{m}}{56}\text{ = }\frac{0,011\text{m}}{14}\)
Theo bảo toàn mol e:
2x + 0,18 + y = 2z + 2×0,14 = 2z + 0,28;
\(z = x + \frac{\text{y}}{2} - 0,05 = \frac{0,31\text{m}}{57}\text{ + }\frac{0,011\text{m}}{28}\text{ - 0,05}\)
Theo bài ra ta có pt:
\(137\times \frac{0,31\text{m}}{57}\text{ + 39}\times \frac{0,011\text{m}}{14}\text{ + 16(}\frac{0,31\text{m}}{57}\text{ + }\frac{0,011\text{m}}{28}\text{ - 0,05) + 0,18}\times \text{23} = m;\)
→ m = 25,5 (g).
Ta có: \(n_{\text{O}{{\text{H}}^{-}}}(dd Y) = 0,18 + 2×\frac{0,31\times 25,5}{57} + \frac{0,011\times 25,5}{14}\) = 0,4774 (mol);
Khi hấp thụ CO2 vào dd Y: tạo ra a mol HCO\(_{3}^{-}\); b mol CO\(_{3}^{2-}\) ta được hệ pt:
\(\left\{ \begin{align} & \text{a + b = 0,348} \\ & \text{a + 2b = 0,4774} \\ \end{align} \right.\)
\(\left\{ \begin{align} & \text{a = 0,2186} \\ & \text{b = 0,1294} \\ \end{align} \right.\)
→ Ba2+ dư; n\(_{\text{BaC}{{\text{O}}_{3}}}\) = n\(_{\text{CO}_{3}^{2-}}\) = 0,1294; → m\(_{\text{BaC}{{\text{O}}_{3}}}\)= 25,9418 (g);
→ Đáp án A.
Nung nóng 30,005 gam hỗn hợp X gồm KMnO4, KClO3 và MnO2, sau một thời gian thu được khí oxi và 24,405 gam chất rắn Y gồm K2MnO4, MnO2, KMnO4, KCl. Để phản ứng hoàn toàn Y cần vừa đủ 2,0 lít dung dịch chứa HCl 0,4M thu được 4,844 lít khí Cl2 (đktc). Phần trăm KMnO4 bị nhiệt phân là
Theo bảo toàn khối lượng: m\(_{{{\text{O}}_{2}}}\)= 30,005 – 24,405 = 5,6 (g); → n\(_{{{\text{O}}_{2}}}\) = 0,175 mol;
Bảo toàn e: 5x + 6y + 2z = 0,175×4 + 0,21625×2 = 1,1325;
Bảo toàn H: n\(_{{{\text{H}}_{2}}\text{O}}\)= \(\frac{1}{2}\)nHCl = 0,4 mol;
Bảo toàn O: 4x + 3y + 2z = 0,175×2 + 0,4 = 0,75;
Theo bài ra ta có hệ pt: \(\left\{ \begin{align} & 158\text{x + 122,5y + 87z = 30,005} \\ & \text{5x + 6y + 2z = 1,1325} \\ & \text{4x + 3y + 2z = 0,75} \\ \end{align} \right.\)
→ \(\left\{ \begin{align} & \text{x = 0,12} \\ & \text{y = 0,0875} \\ & \text{z = 0,00375} \\ \end{align} \right.\)
Ta thấy: 0,0875 mol KClO3 bị nhiệt phân hoàn toàn sinh 0,13125 mol O2
→còn 0,04375 mol O2 nữa là do 0,0875 mol KMnO4;
→ %(KMnO4 đã bị nhiệt phân) = \(\frac{0,0875}{0,12}\)×100% = 72,92%.
Đáp án C.
Cho chất X tác dụng với một lượng vừa đủ dung dịch NaOH, sau đó cô cạn dung dịch thu được chất rắn Y và chất hữu cơ Z. Cho Z tác dụng với dung dịch AgNO3 trong NH3 thu được chất hữu cơ T. Cho T tác dụng với dung dịch NaOH lại thu được chất Y. Chất X có thể là chất nào trong số các chất sau?
\(\underbrace {{\rm{C}}{{\rm{H}}_3}{\rm{COOCH = C}}{{\rm{H}}_2}}_{\rm{X}}{\rm{ + NaOH }} \to {\rm{ }}\underbrace {{\rm{C}}{{\rm{H}}_3}{\rm{COONa}}}_{\rm{Y}}{\rm{ + }}\underbrace {{\rm{C}}{{\rm{H}}_3}{\rm{CHO}}}_{\rm{Z}}\)
CH3CHO + AgNO3 + NH3 → \(\underbrace {{\rm{C}}{{\rm{H}}_3}{\rm{COON}}{{\rm{H}}_4}}_{\rm{T}}\)
CH3COONH4 + NaOH → CH3COONa + NH3 + H2O;
→ Đáp án C.
Cho X, Y là hai chất thuộc dãy đồng đẳng của axit acrylic (MX < MY); cho Z là ancol có cùng số nguyên tử cacbon với X; T là este hai chức tạo bởi X, Y và Z. Đốt cháy hoàn toàn 11,16 gam hỗn hợp E gồm X, Y, Z, T cần vừa đủ 13,216 lít khí O2 (đktc), thu được khí CO2 và 9,36 gam nước. Mặt khác 11,16 gam E tác dụng tối đa với dung dịch chứa 0,04 mol Br2. Khối lượng muối thu được khi cho cùng lượng E trên tác dụng với NaOH dư là
n\(_{{{\text{O}}_{2}}}\) = 0,59 mol;
Theo bảo toàn khối lượng: 11,16 + 0,59 × 32 = m\(_{\text{C}{{\text{O}}_{2}}}\) + 9,36;
n\(_{\text{C}{{\text{O}}_{2}}}\)= 0,47; n\(_{{{\text{H}}_{2}}\text{O}}\)= 0,52;
→ Z là ancol no 2 chức;
→ mO(trong E) = 11,16 – 0,47 × 12 – 0,52 × 2 = 4,48 (g); → \( n_{\text{O}}^{\text{trong E}}\)= 0,28 mol;
Xét hh E:
\(\left\{ \begin{align} & \text{axit: x mol} \\ & \text{este: y mol} \\ & \text{ancol: z mol } \\ \end{align} \right\}\)
Ta có:
\(\left\{ \begin{align} & \xrightarrow{\text{BTNT O}}\text{ 2x + 4y + 2z = 0,28} \\ & \xrightarrow{\text{BTLK }\pi }\text{ x + 2y = 0,04} \\ \end{align} \right.\)
z = 0,1;
→ ancol có 3C và hai axit có 3C và 4C
→ Axit X: C3H4O2 (a mol); Axit Y: C4H6O2 (b mol);
Este: C10H14O4 (y mol); Ancol: C3H8O2 (0,1 mol); Þ a + b + 2y = 0,04;
Theo BTNT C: 3a + 4b + 10y = 0,47 – 3 × 0,1 = 0,17;
Theo bài ra: 72a + 86b + 198y = 11,16 – 76 × 0,1 = 3,56;
Giải hệ 3 pt ta được: a = 0,01; b = 0,01; y = 0,01;
m = 0,01 × 2(94 + 108) = 4,04 (g).
Đáp án D.
Đốt cháy hoàn toàn 1 mol chất béo trung tính, thu được lượng CO2 và H2O hơn kém nhau 6 mol. Mặt khác a mol chất béo trên tác dụng tối đa với 600 ml dung dịch Br2 1M. Giá trị của a là
Gỉa sử độ bất bão hòa trong phân tử chất béo = a. Ta có:
1 = \(\frac{{{\text{n}}_{\text{C}{{\text{O}}_{2}}}}-\text{ }{{\text{n}}_{{{\text{H}}_{2}}\text{O}}}}{\text{a - 1}}\text{ = }\frac{6}{\text{a - 1}}\) → a = 7
Phân tử chất béo có CT: (RCOO)3C3H5;
→ Có 4 lk p ở gốc R. Nghĩa là 1 mol chất béo tác dụng với tối đa 4 mol Br2;
→ Để td 0,6 mol Br2 số mol chất béo là 0,15 mol.
→ Đáp án D.
Tiến hành 2 thí nghiệm sau:
Thí nghiệm 1: Cho m gam bột Fe (dư) vào V1 lit dung dịch Cu(NO3)2 0,2M.
Thí nghiệm 2: Cho m gam bột Fe (dư) vào V2 lit dung dịch AgNO3 0,1M.
Sau khi các phản ứng xảy ra hoàn toàn, khối lượng chất rắn thu được ở 2 thí nghiệm đều bằng nhau. Biểu thức liên hệ giữa V1 và V2 là
Sau khi các pư xảy ra hoàn toàn, khối lượng chất rắn thu được ở 2 thí nghiệm bằng nhau Þ khối lượng kim loại tăng ở 2 thí nghiệm bằng nhau.
Thí nghiệm 1: 1 mol Cu2+ pư khối lượng kim loại tăng 8 gam
0,2V1 mol Cu2+ pư lượng kim loại tăng 8×0,2V1 (gam).
Thí nghiệm 2: 2 mol Ag+ pư khối lượng kim loại tăng 160 gam.
0,1V2 mol Ag+ pư .................................8V2 (gam).
Từ đó ta có: 8V2 = 1,6V1; → V1 = 5V2; → Đáp án A.
Thủy phân hoàn toàn 1 mol pentapeptit X thì thu được 3 mol glyxin, 1 mol alanin và 1 mol valin. Khi thủy phân không hoàn toàn X trong hỗn hợp sản phẩm thấy có các đipeptit Gly-Gly; Ala-Gly; và tripeptit Gly-Val-Gly. Amino axit đầu N, amino axit đầu C của X là
Theo bài ra pentapeptit là: Ala-Gly-Val-Gly-Gly. → Đáp án B.
Cho m (gam) hỗn hợp Na và Ca vào một lượng nước dư thu được dung dịch X và V lit khí (đktc). Sục từ từ đến dư khí CO2 vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
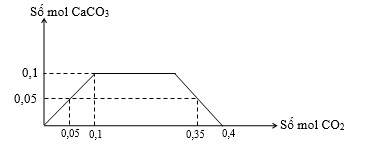
Giá trị của V là
Từ đồ thị ta có: nCa = n\(_{\text{CaC}{{\text{O}}_{3}}}\)(max) = 0,1;
Lượng kết tủa giảm là quá trình CaCO3 → Ca(HCO3)2;
Lượng kết tủa chạy ngang (không đổi ) là quá trình \(NaOH\to NaHC{{O}_{3}}\);
→ nNaOH = n\(_{\text{C}{{\text{O}}_{2}}}\)= 0,35 – 0,05 – 0,1 = 0,2;
n\(_{\text{O}{{\text{H}}^{-}}}\) = 2nCa + nNa = 0,4;
→ n\(_{{{\text{H}}_{2}}}\)= \(\frac{1}{2}\)n\(_{\text{O}{{\text{H}}^{-}}}\)= 0,2 mol;
V = 4,48 lit;
Đáp án B.
Chất X có công thức phân tử C6H8O4. Cho 1 mol X phản ứng hết với dung dịch NaOH, thu được chất Y và 2 mol chất Z. Đun Z với dung dịch H2SO4 đặc, thu được đimetyl ete. Chất Y phản ứng với dung dịch H2SO4 loãng (dư), thu được chất T. Cho T phản ứng với HBr, thu được hai sản phẩm là đồng phân cấu tạo của nhau. Phát biểu nào sau đây không đúng?
Khi đun Z với dd H2SO4 đặc thu được đimetyl ete → Z là CH3OH;
Theo bài ra ta có sơ đồ: C6H8O4 + NaOH → Y + 2CH3OH;
Vậy CT của X là: C2H2(COOCH3)2;
CT của Y là: C2H2(COONa)2;
→ Đáp án B.
Cho 10 gam amin đơn chức X phản ứng hoàn toàn với HCl (dư), thu được 15 gam muối. Số đồng phân amin bậc 2 của X là
Theo bảo toàn khối lượng: namin = nHCl = \(\frac{15-10}{36,5}\)
→ Mamin = \(\frac{10\times 36,5}{5}\)= 73;
Vậy CTPT của amin là C4H11N; → 3 đồng phân amin bậc 2
Đáp án D.
Đun nóng dung dịch chứa 18 gam glucozơ với lượng vừa đủ dung dịch bac nitrat trong amoniac đến phản ứng hoàn toàn. Khối lượng bạc đã sinh ra là
nAg = 2nglucozơ = 0,2 mol → mAg = 21,6 gam → Đáp án C.

