Đề thi thử tốt nghiệp THPT QG môn Hóa năm 2020 - Trường THPT Lê Văn Thọ
Đề thi thử tốt nghiệp THPT QG môn Hóa năm 2020 - Trường THPT Lê Văn Thọ
-
Hocon247
-
40 câu hỏi
-
90 phút
-
38 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Dung dịch HCl đặc, nóng sẽ oxi hóa crom đến mức oxi hóa nào?
Dung dịch HCl đặc, nóng sẽ oxi hóa crom đến mức oxi hóa +2
Đáp án A
Bột kim loại X trộn với chất oxi hóa dùng để chế tạo chất chiếu sáng ban đêm dùng trong pháo sáng, máy ảnh. X là
X là Mg
Đáp án C
Cho Cu phản ứng với dung dịch HNO3 đặc, nóng thu được khí X có màu nâu đỏ. Khí X là
Cho Cu phản ứng với dung dịch HNO3 đặc, nóng thu được khí NO2
Đáp án C
Tơ nilon-6,6 thuộc loại tơ
Tơ nilon-6,6 thuộc loại tơ tổng hợp
Đáp án D
Kim loại nào sau đây điều chế được bằng phương pháp nhiệt nhôm?
Những kim loại đứng sau nhôm được điều chế bằng phản ứng nhiệt nhôm
Đáp án D
Hơi thuỷ ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thuỷ ngân thì chất bột được dùng để rắc lên thuỷ ngân rồi gom lại là
Hơi thuỷ ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thuỷ ngân thì ta dùng lưu huỳnh để rắc lên thuỷ ngân.
X là một polisaccarit chiếm khoảng 20 – 30% khối lượng của tinh bột. X là
X là một polisaccarit chiếm khoảng 20 – 30% khối lượng của tinh bột. X là amilozơ.
Đáp án B
Nước cứng có chứa các ion Ca2+ và HCO3- thuộc loại nước cứng
Nước cứng có chứa các ion Ca2+ và HCO3- thuộc loại nước cứng tạm thời
Công thức tổng quát của amin no, đơn chức, mạch hở có dạng là
Công thức tổng quát của amin no, đơn chức, mạch hở có dạng là CnH2n+3N (n ≥ 1).
Trong dung dịch CuSO4, ion Cu2+ không bị khử bởi kim loại nào sau đây?
Trong dung dịch CuSO4, ion Cu2+ không bị khử bởi kim loại Ag
Số nguyên tử oxi có trong một phân tử triglixerit là
Số nguyên tử oxi có trong một phân tử triglixerit là 6
Metyl axetat được điều chế trực tiếp từ
Metyl axetat được điều chế trực tiếp từ axit axetic và metanol.
Đáp án A
Cho 1 mảnh Na nhỏ bằng hạt đậu vào ống nghiệm đựng 2 - 3 ml chất lỏng X. Quan sát thấy có sửi bọt khí và khí đó gây nổ khi đưa đến gần ngọn lửa đèn cồn. Chất X là
Cho 1 mảnh Na nhỏ bằng hạt đậu vào ống nghiệm đựng 2 - 3 ml chất lỏng X. Quan sát thấy có sửi bọt khí và khí đó gây nổ khi đưa đến gần ngọn lửa đèn cồn. Chất X là Ancol etylic.
Đốt cháy hoàn toàn m gam Fe trong khí Cl2 dư, thu được 6,5 gam FeCl3. Giá trị của m là
Đáp án A.
nmuối = 0,04 (mol)
2Fe + 3Cl2 → 2FeCl3
0,04 ← 0,04 (mol)
mFe = 0,04.56 = 2,24 (g)
Cho một mẫu hợp kim Na-Ba tác dụng với nước (dư), thu được dung dịch X và 3,36 lít H2 (đktc). Thể tích dung dịch axit H2SO4 2M cần dùng để trung hoà dung dịch X là
Đáp án B
Na + H2O NaOH + H2 (1)
Ba + 2H2O → Ba(OH)2 + H2 (2)
Theo (1) và (2) nOH− (dd X) = 2nH2 = 0,3 mol
Phương trình ion rút gọn của dung dịch axit với dung dịch bazơ là
H+ + OH- → H2O
⇒ nH+ = nOH− = 0,3 mol → nH2SO4 = 0,15 mol
⇒ VH2SO4 = 0,15 : 2 = 0,075 lit
⇒ Đáp án B
Cho dãy các chất sau: saccarozơ, glucozơ, fructozơ và axetilen. Số chất trong dãy có tham gia phản ứng tráng gương là
Đáp án B
Đối với dung dịch HF 0,01M, nếu bỏ qua sự điện li của nước thì đánh giá nào sau đây là đúng?
HF là axit yếu, chỉ phân ly một phần nền [H+] < 0,01 (hay pH >2)
Thuỷ phân hoàn toàn 1 mol pentapeptit X thì thu được 3 mol glyxin; 1 mol alanin và 1 mol valin. Phân tử khối của X là
Pentapeptit X là Gly - Ala - Gly - Gly - Val
mX = 75.3 + 89 + 117 - 4.18 = 359
Sắt tây là sắt tráng thiếc dùng làm hộp đựng thực phẩm vì thiếc là kim loại khó bị oxi hóa ở nhiệt độ thường, màng oxit thiếc mỏng và mịn cũng có tác dụng bảo vệ thiếc và thiếc oxit không độc lại có màu trắng bạc khá đẹp. Phương pháp chống ăn mòn kim loại trên thuộc vào phương pháp nào sau đây?
Đáp án C
Đốt cháy hoàn toàn 3,75 gam amino axit X (công thức có dạng H2NCxH2xCOOH) trong khí oxi dư, thu được N2, H2O và 4,4 gam CO2. Giá trị của x là
nCO2 = 0,1 mol → nX = 0,1 : (x + 1)
MX = 14x + 61 = 3,75.(x + 1)/0,1
→ x = 1
Cho m gam glucozơ vào nước thu dược dung dịch X. Dung dịch X này làm mất màu vừa đủ 16 gam dung dịch brom 20%. Giá trị của m là
nC6H12O6 = nBr2 = 16.20%/160 = 0,02
→ mC6H12O6 = 3,2 gam
Cho hỗn hợp M gồm anđehit X (no, đơn chức, mạch hở) và hiđrocacbon Y, có tổng số mol là 0,2 (số mol của X nhỏ hơn của Y). Đốt cháy hoàn toàn M, thu được 8,96 lít khí CO2 (đktc) và 7,2 gam H2O. Tổng số nguyên tử có trong phân tử chất Y là
Chọn D.
Theo bảo toàn C và H ta có: CM = 2 và HM = 4 → X là C2H4O và Y là C2H4 (vì \({n_{C{O_2}}} = {n_{{H_2}O}}\))
Lưu ý: Trường hợp CH2O và C3H6 không thoả mãn vì nX = nY.
Hòa tan hoàn toàn 28,6 gam Na2CO3.xH2O vào nước thu được dung dịch Y. Nhỏ từ từ đến hết V ml dung dịch HCl 1M vào Y, khi các phản ứng kết thúc thu được dung dịch Z và 1,12 lít CO2 (đktc). Tiếp tục nhỏ dung dịch Ba(OH)2 tới dư vào Z thu được tối đa 9,85 gam kết tủa. Giá trị của x và V lần lượt là
Chọn D.
H+ + CO32- → HCO3-
H+ + HCO3- → CO2 + H2O
Đặt a là số mol của Na2CO3.xH2O. Dung dịch Z có chứa Na+ (2a mol); HCO3-, CO32- và Cl-.
\( \to {n_{HC{O_3}^ - }} + {n_{C{O_3}^{2 - }}} = a - 0,05\) (1)
Khi cho Ba(OH)2 vào thì: \({n_{BaC{O_3}}} = {n_{HC{O_3}^ - }} + {n_{C{O_3}^{2 - }}} = 0,05\)
\( \to a = 0,1 \Rightarrow {M_{N{a_2}C{O_3}.x{H_2}O}} = 286 \Rightarrow x = 10\) và \({n_{HCl}} = a + 0,05 = 0,15 \Rightarrow V = 150\;ml\)
Đun nóng m gam hỗn hợp E chứa triglixerit X và các axit béo tự do với 200 ml dung dịch NaOH 1M (vừa đủ), thu được hỗn hợp Y chứa các muối có công thức chung C17HxCOONa. Đốt cháy 0,07 mol E thu được 1,845 mol CO2. Mặt khác, m gam E tác dụng vừa đủ với 0,1 mol Br2. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
Chọn A.
Triglixerit X có 57 nguyên tử C và Axit béo có 18 nguyên tử C.
\(\left\{ \begin{array}{l}
X:a\;mol\\
Axit:b\;mol
\end{array} \right. \Rightarrow \left\{ {\begin{array}{*{20}{c}}
{3a + b = 0,2}\\
{\frac{{a + b}}{{57a + 18b}} = \frac{{0,07}}{{1,845}}}
\end{array}} \right. \Rightarrow \left\{ {\begin{array}{*{20}{c}}
{a = 0,03}\\
{b = 0,11}
\end{array}} \right.\)
Số mol trong m (g) X gấp đôi với 0,07 mol E.
Khi cho X tác dụng với Br2 thì:
\({n_{C{O_2}}} - {n_{{H_2}O}} = ({k_1} + 3 - 1).0,03 + ({k_2} + 1 - 1).0,11\)
\( \Rightarrow 3,69 - {n_{{H_2}O}} = ({k_1}.0,03 + {k_2}.0,11) + 0,06 \Rightarrow 3,69 - {n_{{H_2}O}} = {n_{B{r_2}}} + 0,06 \Rightarrow {n_{{H_2}O}} = 3,53\;mol\)
Vậy \(m = 12{n_{C{O_2}}} + 2{n_{{H_2}O}} + 16.(6a + 2b) = 57,74\;(g)\)
Cho sơ đồ các phản ứng sau:
(1) AlCl3 + NaOH → X1 + X2 + X3.
(2) CO2 + X1 + X2 → X4 + X5.
(3) X4 + NaOH → X1 + X2.
(4) CO2 + X5 + X2 → X6.
Các chất X1, X4 và X6 lần lượt là
Chọn C.
(1) AlCl3 + 4NaOH → NaAlO2 (X1) + 3NaCl (X3) + 2H2O (X2)
(2) CO2 + 2NaAlO2 (X1) + 3H2O (X2) → 2Al(OH)3 (X4) + Na2CO3 (X5)
(3) Al(OH)3 (X4) + NaOH → NaAlO2 (X1) + 2H2O (X2)
(4) CO2 + Na2CO3 (X5) + H2O (X2) → 2NaHCO3 (X6)
Hợp chất X có công thức phân tử C10H18O4. Khi cho X tác dụng hết với dung dịch NaOH, thu được một muối natri của axit hữu cơ Y mạch không phân nhánh và 2 ancol là Z và T (MZ < MT). Oxi hoá hoàn toàn Z và T bằng CuO ở nhiệt độ thích hợp, thu được hai chất hữu cơ là fomanđehit và axeton. Kết luận nào sau đây không đúng?
Chọn A.
Theo đề ta có Z là CH3OH và T là ancol bậc II có cấu tạo: CH3-CH(OH)-CH3.
Vậy X là CH3-OOC-(CH2)4-COO-CH(CH3)2 → Y là HOOC-(CH2)4-COOH
A. Sai, Tên gọi của X là etyl isopropyl ađipat.
Thực hiện các thí nghiệm sau:
(a) Điện phân nóng chảy NaCl.
(b) Dẫn hỗn hợp gồm hơi nước và khí CO2 qua cacbon nung đỏ.
(c) Nhúng thanh sắt (làm bằng thép cacbon) vào dung dịch H2SO4 loãng.
(d) Đun nóng dung dịch Ca(HCO3)2.
(e) Cho dung dịch Na2SO3 tác dụng với dung dịch HCl.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được đơn chất khí là
Chọn C.
(a) NaCl → Na + Cl2 (đpnc).
(b) C + H2O → CO + H2, C + 2H2O → CO2 + 2H2, C + CO2 → 2CO.
(c) Fe + H2SO4 loãng → FeSO4 + H2.
(d) Ca(HCO3)2 → CaCO3 + CO2 + H2O.
(e) Na2SO3 + 2HCl → NaCl + SO2 + H2O.
Thí nghiệm thu được đơn chất khí là (a), (b), (c).
Cho các phát biểu sau
(a) Các este thường được điều chế bằng cách đun sôi hỗn hợp gồm ancol và axit cacboxylic, có axit H2SO4 đặc làm xúc tác.
(b) Một số dầu thực vật được dùng làm nhiên liệu cho động cơ.
(c) Ngoài fructozơ, trong mật ong cũng chứa nhiều glucozơ.
(d) Dạng ion lưỡng cực là dạng tồn tại chính của aminoaxit.
(e) Cao su buna có tính đàn hồi và độ bền tốt hơn cao su thiên nhiên.
Số phát biểu đúng là
Chọn D.
(e) Sai, Cao su buna có tính đàn hồi và độ bền kém hơn cao su thiên nhiên.
Cho từ từ đến dư dung dịch NaOH 0,1M vào 300 ml dung dịch hỗn hợp gồm H2SO4 a mol/lít và Al2(SO4)3 b mol/lít. Đồ thị dưới đây mô tả sự phụ thuộc của số mol kết tủa vào số mol NaOH đã dùng.
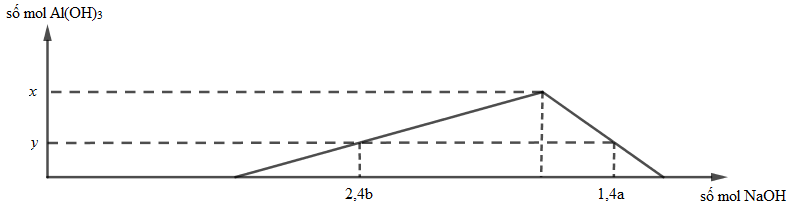 Tỉ số a : b gần nhất với giá trị nào nhất sau đây?
Tỉ số a : b gần nhất với giá trị nào nhất sau đây?
Chọn B.
Theo đề: \({n_{{H_2}S{O_4}}}\; = 0,3a{\rm{ }}mol \Rightarrow {n_{{H^ + }}}\; = 0,6a{\rm{ }}mol\) và \({n_{A{l_2}{{(S{O_4})}_3}}}\; = 0,3b\;mol \Rightarrow {n_{A{l^{3 + }}}}\; = 0,6b{\rm{ }}mol.\)
Vì nH+ = 0,6a mol ⇒ nNaOH dùng để trung hòa = 0,6a mol.
+ Với 2,4b mol NaOH ta có: \({n_{Al{{(OH)}_3}}}\; = \;\frac{{2,4b - 0,6a}}{3} = y\) (1)
+ Với 1,4a mol NaOH ta có: \({n_{Al{{(OH)}_3}}}\; = 4{n_{A{l^{3 + }}}}--{n_{O{H^ - }}} = 4.0,6b--\left( {1,4a--0,6a} \right) = y{\rm{ }}\left( 2 \right)\)
+ Từ (1) và (2) ⇒ 0,8b – 0,2a = 2,4b – 0,8a \( \Leftrightarrow \frac{a}{b} = \frac{{1,6}}{{0,6}} = 2,667\)
X là axit cacboxylic no, hai chức, mạch hở; Y và Z là hai este thuần chức (biết MX < MY < MZ và MZ = MY + 14 = MX + 28). Đốt cháy hoàn toàn 45,8 gam hỗn hợp E chứa X, Y, Z cần dùng 28 lít O2 (ở đktc). Mặt khác, 45,8 gam E tác dụng hết dung dịch NaOH dư, thu được 14 gam hỗn hợp gồm ba ancol có cùng số mol. Phần trăm khối lượng của Y có trong hỗn hợp E là
Chọn B.
Đặt CTTQ của hỗn hợp E là CnH2n – 2O4 (a mol) với \(\left\{ \begin{array}{l}
(14n + 62)a = 45,8\\
(3n - 5)a = 2,5
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
n = 3,75\\
a = 0,4
\end{array} \right.\)
Từ dữ kiện của đề bài ta suy ra X là CH2(COOH)2; Y là (HCOO)2C2H4 và Z là CH3OOC-COOC2H5
→ 104nX + 118nY + 132nZ = 45,8 (1) và nX + nY + nZ = 0,4 (2)
Vì thu được 3 ancol có cùng số mol nên \({n_Y} = 2{n_Z}\) (3)
Từ (1), (2), (3) ta suy ra: nX = 0,175 mol ; nY = và nZ = 0,075 mol
Vậy %mY = 38,64%
Điện phân dung dịch X chứa a mol CuSO4 và 0,2 mol KCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi, hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch). Thể tích khí thu được trong quá trình điện phân (ở cả hai điện cực) theo thời gian điện phân như sau:
Chọn A.
Tại thời điểm t (s) chỉ có khí Cl2 thoát ra ở anot ne (1) = 0,12 mol
Tại thời điểm 3t (s) có khí Cl2 (0,1 mol); O2 (x mol) thoát ra ở anot và H2 (y mol) ở catot.
+ Ta có: x + y = 0,08 (1) và bảo toàn e: 4x + 0,1.2 = 0,12.3 (2)
+ Từ (1), (2) ta tính được: x = 0,04 và y = 0,04. Vậy a = 0,14 mol.
Hoà tan hết m gam hỗn hợp X gồm FeCl2, FeSO4 vào nước thu được dung dịch Y. Để oxi hóa hết các chất trong Y cần tối thiểu 200 ml dung dịch KMnO4 0,5M trong H2SO4 loãng. Nếu cho Y tác dụng với lượng dư dung dịch NaOH, kết tủa thu được đem nung trong không khí đến khối lượng không đổi, thu được 24 gam chất rắn. Thành phần phần trăm về số mol của FeCl2 trong X là
Chọn A.
Chất rắn thu được là Fe2O3 với \({n_{FeC{l_2}}} + {n_{FeS{O_4}}} = 2{n_{F{e_2}{O_3}}} = 0,3\) (1)
Khi cho Y tác dụng với KMnO4/H2SO4, áp dụng bảo toàn e có: \(3{n_{FeC{l_2}}} + {n_{FeS{O_4}}} = 5{n_{KMn{O_4}}} = 0,5\) (2)
Từ (1), (2) ta tính được: \({n_{FeC{l_2}}} = 0,1\;mol\) và \({n_{FeS{O_4}}} = 0,2\,mol\) .
Vậy \(\% {n_{FeC{l_2}}} = 33,33\% \)
Hỗn hợp X gồm FeO, Fe2O3 và Fe3O4. Cho khí CO qua 7,12 gam X nung nóng, sau một thời gian thu được hỗn hợp chất rắn Y có khối lượng là 6,48 gam và hỗn hợp khí Z. Mặt khác, hòa tan hoàn toàn Y trong dung dịch H2SO4 đặc, nóng (dư), thu được a mol khí SO2 (sản phẩm khử duy nhất) và dung dịch chứa 18 gam muối. Dẫn toàn bộ hỗn hợp khí Z và a mol khí SO2 trên vào 1 lít dung dịch hỗn hợp Ba(OH)2 0,02M và NaOH 0,062M, sau phản ứng thu được m gam kết tủa. Giá trị của m là
Chọn D.
Vì trong Z có hai khí CO2 và CO dư nên \({n_{O\;(oxit)}} = {n_{C{O_2}}} = \frac{{7,12 - 6,48}}{{16}} = 0,04\;mol\)
Khi cho Y tác dụng với H2SO4 đặc thu được Fe2(SO4)3 \( \to {n_{S{O_2}}} = \frac{3}{2}{n_{Fe}} = 3{n_{F{e_2}{{(S{O_4})}_3}}} = 0,045\;mol\)
Dẫn hỗn hợp khí gồm CO2 (0,04 mol) và SO2 (0,045 mol) vào dung dịch có chứa OH- (0,102 mol) thì:
\(\frac{{{n_{O{H^ - }}}}}{{{n_{X{O_2}}}}} = 1,2 \Rightarrow {n_{X{O_3}^{2 - }}} = {n_{O{H^ - }}} - {n_{X{O_2}}} = 0,017\;mol\) (với \({M_{X{O_2}}} = \frac{{{m_{C{O_2}}} + {m_{S{O_2}}}}}{{0,04 + 0,045}} = \frac{{928}}{{17}} \Rightarrow {M_X} = \frac{{384}}{{17}}\))
Kết tủa được tạo thành từ Ba2+ (0,02 mol) và XO32- (0,017 mol) → m = 3,529 (g) (tính theo XO32-).
Tiến hành thí nghiệm phản ứng tráng gương của glucozơ theo các bước sau đây:
- Bước 1: Rửa sạch ống nghiệm thủy tinh bằng cách cho vào một ít kiềm, đun nóng nhẹ, tráng đều, sau đó đổ đi và tráng lại ống nghiệm bằng nước cất.
- Bước 2: Nhỏ vào ống nghiệm 1 ml dung dịch AgNO3 1%, sauđó thêm từng giọt NH3, trong ống nghiệm xuất hiện kết tủa nâu xám, nhỏ tiếp vài giọt dung dịch NH3 đến khi kết tủa tan hết.
- Bước 3: Thêm tiếp 1 ml dung dịch glucozơ 1%, đun nóng nhẹ trên ngọn lửa đèn cồn một thời gian.
Cho các nhận định sau đây:
(a) Trong phản ứng trên, glucozơ đã bị oxi hóa bởi dung dịch AgNO3/NH3.
(b) Trong bước 2, khi nhỏ tiếp dung dịch NH3 vào, kết tủa nâu xám của bạc hidroxit bị hòa tan do tạo thành phức bạc [Ag(NH3)2]+.
(c) Trong bước 3, để kết tủa bạc nhanh bám vào thành ống nghiệm ta phải lắc đều hỗn hợp phản ứng.
(d) Trong bước 1, NaOH được dùng để làm sạch bề mặt ống nghiệm do thủy tinh bị NaOH ăn mòn.
Số nhận định sai là
Chọn C.
(c) Sai, Không nên lắc đều, giữ nguyên ống nghiệm hoặc có thể đun cách thuỷ trong cốc nước.
Hỗn hợp X gồm glyxin, axit glutamic và hai axit cacboxylic no, đơn chức kế tiếp nhau trong dãy đồng đẳng. Cho m gam X tác dụng vừa đủ với 500 ml dung dịch NaOH 1M, thu được 41,05 gam hỗn hợp muối. Mặt khác, đốt cháy hoàn toàn m gam X cần dùng 17,64 lít khí O2. Cho sản phẩm cháy qua dung dịch H2SO4 đặc, dư thì thu được 20,72 lít hỗn hợp khí CO2 và N2. Thể tích các khí đo ở đktc. Thành phần trăm theo khối lượng của axit cacboxylic có phân tử khối nhỏ hơn trong X là
Chọn C.
Khi cho X tác dụng với NaOH thì: \({n_{{H_2}O}} = {n_{NaOH}} = {n_{COOH}} = 0,5\;mol \to {m_X} = 30,05\;(g)\)
Đặt \(\left\{ \begin{array}{l}
C{O_2}:x\;mol\\
{H_2}O:y\;mol\\
{N_2}:z\;mol
\end{array} \right. \to \left\{ \begin{array}{l}
x + t = 0,925\\
2x + y = 2,575\\
44x + 18y + 28z = 55,25
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
x = 0,85\\
y = 0,875\\
z = 0,075
\end{array} \right.\)
Đặt \(\left\{ \begin{array}{l}
Gly:a\;mol\\
Glu:b\;mol\\
{C_n}{H_{2n}}{O_2}:c\;mol
\end{array} \right. \to \left\{ \begin{array}{l}
a + b = 2{n_{{N_2}}} = 0,15\\
- 0,5a + 0,5b = {n_{C{O_2}}} - {n_{{H_2}O}} = - 0,025\\
a + 2b + c = 0,5
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
a = 0,1\\
b = 0,05\\
c = 0,3
\end{array} \right. \to n = \frac{4}{3}\)
→ Axit cacboxylic nhỏ hơn trong X là HCOOH: 0,2 mol → %m = 30,62%.
X là este hai chức, Y, Z là hai este đều đơn chức (X, Y, Z đều mạch hở và MZ > MY). Đun nóng 5,7m gam hỗn hợp E chứa X, Y, Z (số mol Z lớn hơn số mol của X) với dung dịch NaOH vừa đủ, thu được hỗn hợp F gồm hai ancol kế tiếp và hỗn hợp muối G. Dẫn toàn bộ F qua bình đựng Na dư, thấy khối lượng bình tăng 17,12 gam; đồng thời thoát ra 5,376 lít khí H2 (đktc). Nung nóng G với vôi tôi xút, thu được duy nhất một hiđrocacbon đơn giản nhất có khối lượng là m gam. Khối lượng của X có trong hỗn hợp E là
Chọn B.
Xét hỗn hợp ancol F ta có:
\(\left\{ \begin{array}{l}
{m_F} = 2{n_{{H_2}}} + {m_{\rm{b}}} = 17,6\,(g)\,{\rm{ }}\\
{n_F} = 2{n_{{H_2}}} = 0,48\,mol
\end{array} \right. \Rightarrow {\bar M_F} = 36,67 \Rightarrow \left\{ \begin{array}{l}
{n_{C{H_3}OH}} = 0,32\,mol\\
{n_{{C_2}{H_5}OH}} = 0,16\,mol
\end{array} \right.(a)\)
Khi nung hỗn hợp muối với vôi tôi xút thì \(\bar R{(COONa)_{\bar n}} + \bar nNaOH \to C{H_4} + \bar nN{a_2}C{O_3}\)
\( \to {n_{ - COONa}} = {n_{NaOH}} = {n_{N{a_2}C{O_3}}} = 2{n_{{H_2}}} = 0,48\,mol\)
\( \to {m_{\bar R{{(COONa)}_{\bar n}}}} = {m_{C{H_4}}} + {m_{N{a_2}C{O_3}}} - {m_{NaOH}} = m + 31,68\,(g)\)
\( \to 5,7m + 40.0,48 = m + 31,68 + 17,6 \Rightarrow m = 6,4\,mol\)
+ Theo đề thì hidrocacbon thu được là CH4 → \({n_E} = {n_{C{H_4}}} = 0,4\,mol\)
→ Hỗn hợp muối gồm CH2(COONa)2 và CH3COONa
Xét E ta có: \(\left\{ \begin{array}{l}
{n_X} + ({n_Y} + {n_Z}) = {n_E}\\
2{n_X} + ({n_Y} + {n_Z}) = 2{n_{{H_2}}}
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
{n_X} = 0,08\,mol\\
{n_Z} + {n_Y} = 0,32\,mol
\end{array} \right.\) (b)
Theo đề bài ta có các dữ kiện “số mol Z lớn hơn số mol của X và MZ > MY” (c)
Từ (a), (b) và (c) ta suy ra X là CH3OOC-CH2-COOC2H5 (0,08 mol). Vậy mZ = 11,68 (g).
Hòa tan hết 30,56 gam hỗn hợp gồm Mg, Fe3O4 và FeCO3 trong dung dịch chứa HCl và 0,24 mol HNO3, thấy thoát ra hỗn hợp khí X gồm CO2, NO và 0,08 mol N2O; đồng thời thu được dung dịch Y có khối lượng tăng 22,60 gam so với dung dịch ban đầu. Tỉ khối hơi của X so với He bằng 9,95. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thu được 0,03 mol khí NO (sản phẩm khử duy nhất của N+5) và 239,66 gam kết tủa. Phần trăm khối lượng của Fe3O4 có trong hỗn hợp ban đầu là
Chọn D.
Khối lượng dung dịch tăng: \(30,56 - {m_X} = 22,6 \Rightarrow 44{n_{C{O_2}}} + 30{n_{NO}} = 4,44\) (1)
và \({n_X} = \frac{{{m_X}}}{{{M_X}}} = 0,2 \Rightarrow {n_{C{O_2}}} + {n_{NO}} = 0,12\) (2).
Từ (1), (2) có: \({n_{C{O_2}}} = {n_{NO}} = 0,06\;mol\)
\( \Rightarrow {n_{FeC{O_3}}} = 0,06\;mol \to {n_{N{H_4}^ + }} = 0,02\;mol\)
Khi đó: 24x + 232y + 0,06.116 = 30,56 (1)
Ta có: \({n_{{H^ + }}} = 10{n_{N{H_4}^ + }} + 2{n_{C{O_2}}} + 4{n_{NO}} + 10{n_{{N_2}O}} + 2{n_{O\;(F{e_3}{O_4})}} = {n_{HCl}} + {n_{HN{O_3}}} \Rightarrow {n_{HCl}} = 1,24 + 8y\)
Kết tủa thu được gồm AgCl (1,24 + 8y) và Ag (z mol) → 143,5.(1,24 + 8y) + 108z = 239,66 (2)
\( \to 2x + y + 0,06 = 0,09.3 + 0,08.8 + 0,02.8 + z\;\;(3)\)
Từ (1), (2), (3) suy ra: x = 0,5; y = 0,05; z = 0,04 → \(\% {m_{F{e_3}{O_4}}} = 37,96\% \) .

