Đề thi thử THPT QG môn Hóa học năm 2018 - Trường THPT Chuyên Bắc Ninh
Đề thi thử THPT QG môn Hóa học năm 2018 - Trường THPT Chuyên Bắc Ninh
-
Hocon247
-
40 câu hỏi
-
90 phút
-
30 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Cho các phát biểu sau:
(1) Nhôm là kim loại lưỡng tính.
(2) Trong công nghiệp, photpho được sản xuất bằng cách đun nóng hỗn hợp quặng photphoric,cát và than cốc ở 12000C trong lò điện.
(3) Crom(III) oxit và crom (III) hidroxit đều là chất có tính lưỡng tính.
(4) Khí CO2 gây ra hiện tượng hiệu ứng nhà kính.
(5 ) Kim cương, than chì, fuleren là các dạng thù hình của cacbon.
(6) Nhúng thanh sắt vào dung dịch H2SO4 loãng, xảy ra ăn mòn điện hóa học.
Số phát biểu đúng là:
Đáp án C
1) sai vì không có khái niệm kim loại lưỡng tính
2) đúng
3) đúng vì Cr2O3 và Cr(OH)3 đều có tính chất lưỡng tính
4) đúng
5) đúng
6) sai vì chỉ xảy ra hiện tượng ăn mòn hóa học
=> có 4 phát biểu đúng
Cho các phát biểu sau:
(1) Công thức hóa học của phèn chua là K2SO4.Al2(SO4)3.24H2O.
(2) Các kim loại Na, K, Ba đều phản ứng mạnh với nước ở nhiệt thường.
(3) Quặng boxit có thành phần chính là Al2O3.2H2O.
(4) Nhôm là kim loại màu trắng, nhẹ, có nhiều ứng dụng quan trọng.
(5) Nước cứng là nước có chứa nhiều ion cation Ca2+ , Mg2+.
(6) Có thể điều chế kim loại Na bằng phương pháp điện phân dung dịch NaCl.
Số phát biểu đúng là:
Đáp án C
1) ; 2) ; 3) ; 4) ; 5) đều đúng
6) sai điều chế kim loại Na bằng cách điện phân nóng chảy NaCl
=> có 5 phát biểu đúng
Hỗn hợp X gồm metan, propen và isopropen. Đốt cháy hoàn toàn 9,00 gam X cần vừa đủ 22,176 lít O2 (đktc). Mặt khác, a mol X phản ứng tối đa với 0,06 mol brom. Giá trị của a là
Ta thấy ( Về số C và H)
→ Quy đổi hỗn hợp về CH4: x (mol) và C5H8: y (mol) vẫn đảm bảo về số liên kết pi
Phản ứng đốt cháy:
CH4 + 2O2 → CO2 + 2H2O
a → 2a (mol)
C5H8 + 7O2 → 5CO2 + 4H2O
b → 7b (mol)
Giải hệ phương trình:
\(\left\{ \begin{gathered}
{m_X} = 16x + 68y = 9 \hfill \\
{n_{{O_2}}} = 2x + 7y = \frac{{22,176}}{{22,4}} = 0,99 \hfill \\
\end{gathered} \right. = > \left\{ \begin{gathered}
x = 0,18 \hfill \\
y = 0,09 \hfill \\
\end{gathered} \right.\)
Xét trong a mol X nC5H8 = ½ nBr2 = ½. 0,06 = 0,03 (mol)
→ a mol X có số mol CH4 là \(\frac{{0,03.0,18}}{{0,09}} = 0,06\,(mol)\)
→ a = nCH4 + nC5H8 = 0,06 + 0,03 = 0,09 (mol)
Cho hỗn hợp X gồm amino axit Y (H2NCxHyCOOH) và 0,01 mol (H2N)2C5H9COOH tác dụng với 50 ml dung dịch HCl 1M, thu được dung dịch Z. Dung dịch Z tác dụng vừa đủ với dung dịch chứa 0,04 mol NaOH và 0,05 mol KOH, thu được dung dịch chứa 8,135 gam muối. Phân tử khối của Y là
Đáp án B
Ta có ∑nCOOH + nH+ = ∑nOH–.
⇒ Y + 0,01×2 + nHCl = nNaOH + nKOH
⇒ nY = 0,02 mol và nH2O tạo thành = ∑nOH– = 0,09 mol.
⇒ Bảo toàn khối lượng ta có:
mY + mH2NC3H5(COOH)2 + mHCl = mNaOH + mKOH + mH2O
→ mY = 2,06 gam → MY = (2,06:0,02) = 103
Cho hỗn hợp X gồm 2 este đơn chức, mạch hở Y và Z ( Z có nhiều hơn Y một nguyên tử cacbon). Đốt cháy hoàn toàn m gam X cần vừa đủ 1,53 mol O2. Mặt khác, thủy phân hết m gam X cần dung dịch chứa 0,3 mol KOH sau phản ứng thu được 35,16 gam hỗn hợp muối T và một ancol no, đơn chức, mạch hở Q. Đốt cháy hoàn toàn lượng hỗn hợp muối T ở trên cần vừa đủ 1,08 mol O2. Công thức của Z là
Gọi CTPT của 2 este là RCOOR’: 0,3 (mol) ( vì este đơn chức nên = nKOH)
Lượng O2 dùng để đốt X = lượng O2 để đốt T + ancol
=> nO2 (đốt ancol) = 1,53 – 1,08 = 0,45 (mol)
Gọi CTPT của ancol no, đơn chức, mạch hở là CnH2n+2O
CnH2n+2O + 1,5nO2 → nCO2 + (n +1)H2O
1 (mol) → 1,5n (mol)
0,3 (mol) → 0,45 (mol)
→ 0,3.1,5n = 0,45 → n = 1
Vậy CT của ancol là CH3OH: 0,3 (mol)
BTKL ta có: mX + mKOH = mmuối + mancol
→ mX = 35,16 + 0,3.32 – 0,3.56 = 27,96 (g)
Gọi a và b là số mol CO2 và H2O khi đốt cháy X
\(\begin{array}{l}
\sum {{m_{(C{O_2} + {H_2}O)}} = 44x + 18y = 27,96 + 1,53.32} \\
\to 2x + y = 0,3.2 + 1,53.2\\
\to x = 1,38{\mkern 1mu} (mol)\\
y = 0,9{\mkern 1mu} (mol)
\end{array}\)
Gọi k là độ bất bào hòa của 2 este
Ta có:
\(\begin{array}{l}
{n_X} = \frac{{{n_{C{O_2}}} - {n_{{H_2}O}}}}{{k - 1}} \to 0,3 = \frac{{1,38 - 0,9}}{{k - 1}}\\
\to k = 2,6\\
{M_{RCOOC{H_3}}} = \frac{{27,96}}{{0,3}} = 93,2\\
\to R + 44 + 15 = 93,2 \to R = 34,2
\end{array}\)
→ 1 este phải có 3 liên kết pi trong phân tử
→ Z có CTPT là C5H6O2
Lên men m gam tinh bột thành ancol etylic với hiệu suất 75%, hấp thụ toàn bộ khí CO2 sinh ra vào dung dịch chứa 0,03 mol Ba(OH)2, thu được kết tủa và dung dịch X. Cho từ từ dung dịch NaOH vào X, đến khi kết tủa lớn nhất thì cần ít nhất 6 ml dung dịch NaOH 1M. Giá trị của m là
(C6H10O5)n → nC6H12O6 → 2nC2H5OH +2nCO2 ( %H = 75%)
\(C{O_2} + \underbrace {Ba{{(OH)}_2}}_{0,03\,mol}\xrightarrow{{}}\left\{ \begin{gathered}
BaC{O_3} \downarrow (1) \hfill \\
Ba{(HC{O_3})_2}\xrightarrow{{ + 0,006\,\,mol\,NaOH}}BaC{O_3} \downarrow + NaHC{O_3} + {H_2}O \hfill \\
\end{gathered} \right.\)
Vì lượng NaOH cần dùng ít nhất để thu được kết tủa lớn nhất → phản ứng xảy ra theo tỉ lệ mol NaOH : Ba(HCO3) = 1 : 1
Ba(HCO3)2 + NaOH → BaCO3↓ + NaHCO3 + H2O
0,006 (mol)←0,006 (mol)
BTNT Ba → nBaCO3 (1) = nBa(OH)2 – nBa(HCO3) = 0,03 – 0,006=0,024 (mol)
BTNT C → nCO2 = nBaCO3(1) + 2nBa(HCO3) = 0,024 + 2.0,006 = 0,036 (mol)
Từ sơ đồ → ntb = ½ nCO2 = 0,018 (mol)
→ mtb lí thuyết = 0,018.162=2,916 (g)
Vì H = 75% → mtb thực tế cần lấy = mtb lí thuyết : 0,75 = 3,888(g)
Cho các kim loại sau: Li, Na, Al, Ca. Số kim loại kiềm trong dãy là
Các kim loại kiềm trong dãy là: Li, Na => có 2 kim loại
Dung dịch CuSO4 có màu nào sau đây?
Đáp án C
Dung dịch CuSO4 có màu xanh
“ Hiệu ứng nhà kính” là hiện tượng Trái Đất ấm dần lên do các bức xạ có bước sóng dài trong vùng hồng ngoại bị khí quyển giữ lại mà không bức xạ ra ngoài vũ trụ. Khí nào dưới đây là nguyên nhân chính gây ra hiệu ứng nhà kính?
Đáp án D
CO2 là khí gây nên hiệu ứng nhà kính
Hỗn hợp E chứa 3 peptit đều mạch hở gồm peptit X ( C4H8O3N2), peptit Y ( C7HxOyNz) và peptit Z (C11HnOmNt). Đun nóng 14,21 gam E với dung dịch KOH vừa đủ, thu được hỗn hợp T gồm 3 muối của glyxin, analin và valin. Đốt cháy toàn bộ T cần dùng 18,48 gam O2, thu được CO2, H2O, N2 và 0,11 mol K2CO3. Phần trăm khối lượng của X trong hỗn hợp E có giá trị gần nhất với
Ta thấy: Gly có 2C, Ala có 3C, Val có 5C
+ X có CTPT C4H8O3N2 nên là Gly-Gly.
+ Y có 7C nên chỉ có thể là Gly-Val hoặc Gly-Gly-Ala → Y có tối đa có 3 mắt xích
- Do X, Y, Z được tạo nên từ a.a có 1 nhóm NH2 và 1 nhóm COOH nên quy đổi thành: CONH, CH2, H2O (số mol H2O bằng tổng mol peptit)
- Bảo toàn Na → nNaOH = 2nNa2CO3 = 0,44 mol
+) Bảo toàn O → \({n_{CONH}} + {n_{{H_2}O(1)}} + {n_{NaOH}} = {n_{{H_2}O(2)}} + 3{n_{N{a_2}C{O_3}}} + 2{n_{C{O_2}}} + {n_{{H_2}O(3)}}\)
→ 0,44 + y + 0,44 = y + 3.0,22 + 2(x + 0,22) + (x + 0,44) → x = 0,55
+) mE = mCONH + mCH2 + mH2O → 28,42 = 0,44.43 + 14.0,55 + 18.y → y = 0,1
→ nE = nH2O = 0,1 mol
- Số mắt a.a xích trung bình = nN : nE = 0,44 : 0,1 = 4,4
- Biện luận tìm các peptit:
+ X là đipeptit, Y có tối đa 3 mắt xích → Z có từ 5 mắt xích trở lên
+ Mặt khác Z có 11C → Z chỉ có thể là Gly4Ala
+ X, Z không chứa Val → Y chứa Val → Y là Gly-Val
- Giả sử E chứa: Gly2 (a mol); Gly-Val (b mol); Gly4Ala (c mol)
Ta lập hệ: \(\left\{ \begin{array}{l}{m_E} = 132{\rm{a}} + 174b + 317c = 28,42\\{n_E} = a + b + c = 0,1\\{n_{NaOH}} = 2{\rm{a}} + 2b + 5c = 0,44\end{array} \right. \to \left\{ \begin{array}{l}a = 0,01\\b = 0,01\\c = 0,08\end{array} \right.\)
→ %mX = 4,64%
Để hòa tan hết 38,36 gam hỗn hợp X gồm Mg, Fe3O4, Fe(NO3)2 cần dùng 0,87 mol H2SO4 loãng, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 111,46 gam muối sunfat trung hòa và 5,6 lít (đktc) hỗn hợp khí Z gồm hai khí không màu ( có một khí không màu hóa nâu ngoài không khí). Tỉ khối hơi của Z so với H2 là 3,8. Phần trăm khối lượng Mg trong X gần nhất với giá trị nào sau đây?
\(38,36\,\,(g)\,X\left\{ \begin{gathered}
Fe \hfill \\
F{e_3}{O_4} \hfill \\
Fe{(N{O_3})_2} \hfill \\
\end{gathered} \right. + {H_2}S{O_4}:\,0,87\,mol\xrightarrow{{}}\left\{ \begin{gathered}
Z\left\{ \begin{gathered}
NO:0,05\,(mol) \hfill \\
{H_2}O:\,0,2\,(mol) \hfill \\
\end{gathered} \right. \hfill \\
\underbrace {M{g^{2 + }};F{e^{3 + }};N{H_4}^ + ;S{O_4}^{2 - }\,}_{{m_Y} = 111,46\,g} \hfill \\
{H_2}O \hfill \\
\end{gathered} \right.\)
nZ = 5,6 : 22,4 = 0,25 (mol); MZ = 3,8.2 = 7,6 (g/mol)
→ mZ = 0,25. 7,6 = 1,9 (g)
Gọi x và y là số mol của NO và H2
\(\left\{ \begin{gathered}
x + y = 0,25 \hfill \\
30x + 2y = 1,9 \hfill \\
\end{gathered} \right. = > \left\{ \begin{gathered}
x = 0,05\,(mol) \hfill \\
y = 0,2\,(mol) \hfill \\
\end{gathered} \right.\)
BTKL: mX + mH2SO4 = mY + mZ + mH2O
→ mH2O = 38,36 + 0,87.98 – 111,46 – 1,9 = 10,26 (g)
→ nH2O = 0,57 (mol)
BTNT H → nNH4+ = (2nH2SO4 – 2nH2 – 2nH2O )/4 = (2.0,87 – 2.0,2 – 2. 0,57)/4 = 0,05 (mol)
BTNT N: nFe(NO3)2 = ( nNO + nNH4+)/2 = ( 0,05+ 0,05)/2 = 0,05 (mol)
BTNT O: 4nFe3O4 + 6nFe(NO3)2 = nNO + nH2O → nFe3O4 = ( 0,05 + 0,57 – 6. 0,05)/4 = 0,08 (mol)
BTKL: mMg = mX – mFe3O4 – mFe(NO3)2 = 38,36 – 0,08.232 – 0,05. 180 = 10,8 (g)
%Mg = (10,8 : 38,36).100% = 28,15%
Cho 5,2 gam hỗn hợp X gồm Fe và Mg tác dụng hết với lượng vừa đủ dung dịch H2SO4 thu được dung dịch Y và 3,36 lít khí ở đktc, khối lượng muối có trong Y là
Đáp án D
nH2 = 3,36 : 22,4 = 0,15 (mol) => nSO42-= nH2 = 0,15 (mol)
BTKL : mmuối = mKL + mSO42- = 5,2 + 0,15.96 = 19,6 (gam)
Cho các phát biểu sau:
(a) Dung dịch lòng trắng trứng có phản ứng màu biure.
(b) Amino axit là chất rắn kết tinh, dễ tan trong nước.
(c) Dung dịch phenol không làm đổi àu quỳ tím.
(d) Hiđro hóa hoàn toagn triolein ( xúc tác Ni, t0) thu được tristearin.
(e) Fructozo là đồng phân của glucozơ.
(f) Amilozo có cấu trúc mạch phân nhánh.
Số phát biểu đúng là:
Đáp án A
Các phát biểu đúng là: a), b), c), d), e)
f) sai vì amilozo có cấu trúc mạch không phân nhánh
=> có 5 đáp án đúng
Hỗn hợp X gồm glyxin, alanin, valin, metylamin và trimetylamin. Đốt cháy hoàn toàn 0,18 mol hỗn hợp X cần dùng vừa đủ 0,615 mol O2. Sản phẩm cháy gồm CO2, H2O và N2 (trong đó số mol CO2 là 0,40 mol). Cho lượng X trên vào dung dịch KOH dư thấy có a mol KOH tham gia phản ứng. Giá trị của a là
Đáp án C
Ta thấy:
Glyxin = NH3 + CH2 + CO2
Ala = NH3 +2CH2 + CO2
Val = NH3 + 4CH2 + CO2
CH3NH2 = NH3 +CH2
C2H5NH2 = NH3 + 2CH2
Quy đổi X thành NH3: 0,18 (mol) ; CH2 : x (mol) ; CO2 : y (mol)
PTHH đốt cháy:
4NH3 + 3O2 t0→→t0 2N2 + 6H2O
0,18 → 0,135 (mol)
CH2 + 1,5O2 t0→→t0 CO2 + H2O
x → 1,5x → x ( mol)
∑ nO2 = 0,135 + 1,5x = 0,615 (1)
∑ nCO2= x + y = 0,4 (2)
Từ (1) và (2) => x = 0,32 và y = 0,08 (mol)
=> nNaOH = nGly + nAla + nVal = nCO2 = 0,08 (mol)
Điện phân dung dịch X chứa hỗn hợp gồm CuSO4 và NaCl ( tỉ lệ mol tương ứng 1: 3) với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi 2A.Sau thời gian điện phân t ( giờ) thu được dung dịch Y ( chứa hai chất tan) có khối lượng giảm 12,45 gam so với dung dịch X. Dung dịch Y phản ứng vừa hết với 3,06 gam Al2O3. Bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước, hiệu suất điện phân 100%. Giá trị của t gần nhất với giá trị nào sau đây?
Gọi số mol của CuSO4 và NaCl lần lượt là x và 3x (mol)
Thứ tự điện phân các chất tại catot và anot
Cu2+ +2e → Cu↓
2Cl- → Cl2 + 2e
2H2O + 2e → 2OH- + H2
2H2O → 4H+ + O2↑ + 4e
Vì nCl- = 3nCu2+ và chất tan thu được hòa tan được Al2O3 => Cl- điện phân hết.
2 chất tan thu được là Na2SO4 : x ( mol) ; NaOH: (3x – 2x) = x (mol)
2NaOH + Al2O3 → 2NaAlO2 + H2O
0,06 ← 0,03 (mol)
→ x = nNaOH = 0,06 (mol)
Tại catot: Cu: 0,06 mol; nH2 = a (mol)
Tại anot: Cl2: 0,09 mol; nO2 = b (mol)
\(\begin{array}{l}
\sum {{n_{e{\kern 1pt} nhuong}}{\mkern 1mu} = \sum {n{{\mkern 1mu} _{e{\kern 1pt} nhan}}} } \\
{m_{giam}}{\mkern 1mu} = {m_{Cu}} + {m_{C{l_2}}} + {m_{{H_2}}} + {m_{{O_2}}}\\
\to 0,06.2 + 2a = 0,09.2 + 4b\\
0,06.64 + 0,09.71 + 2a + 32b = 12,45\\
\to a = 0,15\\
b = 0,06
\end{array}\)
→ ∑ ne = 0,06.2 + 2.0,15 = 0,42 (mol)
Áp dung CT ta có: ne = It/F → t = 0,42.96500/2 = 20265 (s) = 5,63 (giờ)
Gần nhất với 5,6 giờ
Thực hiện các thí nghiệm sau:
(a) Cho thanh nhôm vào dung dịch HNO3 đặc ở nhiệt độ thường.
(b) Cho dung dịch K2CO3 vào dung dịch NaOH.
(c) Cho SiO2 vào dung dịch HF.
(d) Cho NaOH vào dung dịch NaHCO3.
(e) Sục khí NH3 vào dung dịch CuSO4.
(f) Sục khí CO2 vào dung dịch NaOH.
Số thí nghiệm không xảy ra phản ứng hóa học là
Đáp án A
a) Al thu động với HNO3 đặc nguội do vậy không có phản ứng
b) K2CO3 + NaOH → không xảy ra vì không tạo kết tủa hoặc chất bay hơi
c) SiO2 + 4HF → SiF4 + 2H2O
d) NaOH + NaHCO3 → Na2CO3 + H2O
e) 2NH3 + 2H2O + CuSO4 → Cu(OH)2↓ + (NH4)2SO4
Nếu NH3 dư: 4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
f) CO2 + 2NaOH → Na2CO3 + H2O
hoặc CO2 + NaOH → NaHCO3
=> Có 2 phản ứng không xảy ra
Trong phòng thí nghiệm, khí X được điều chế và thu vào bình tam giác theo hình vẽ dưới đây:
Khí X là
Đáp án C
Từ hình vẽ ta thấy khí X nặng hơn không khí vì thu khí X bằng cách để ngửa bình
=> Trong các đáp án C chỉ có CO2 là khí nặng hơn không khí
Chất nào sau đây không phải là chất hữu cơ?
Đáp án D
CO2 không phải là hợp chất hữu cơ
Kim loại nào sau đây không phản ứng với dung dịch H2SO4 loãng?
Đáp án C
Cu là kim loại đứng sau H trong dãy điện hóa nên không tác dụng được với H2SO4 loãng
Hỗn hợp X chứa etylamin và trimetylamin. Hỗn hợp Y chứa 2 hiđrocacbon mạch hở có số liên kết (∏) nhỏ hơn 3. Trộn X và Y theo tỉ lệ mol nX : nY = 1: 5 thu được hỗn hợp Z. Đốt cháy hoàn toàn 3,17 gam hỗn hợp Z cần dùng vừa đủ 7,0 lít khí oxi (đktc), sản phẩm cháy gồm CO2, H2O và N2 được dẫn qua dung dịch NaOH đặc, dư thấy khối lượng dung dịch tăng 12,89 gam. Phần trăm khối lượng của etylamin trong X gần nhất với giá trị nào sau đây?
nO2=0,3125 mol
BTKL→ mN2 = 3,17 + 0,3125.32 - 12,89 = 0,28 gam
→ nN2 = 0,01 mol → n amin=0,02 mol
→ n hiđrocacbon=0,1 mol
- Giả sử số mol CO2 và H2O lần lượt là x, y
44x + 18y = 12,89
0,3125.2 = 2x+y (BTNT: O)
→ x = 0,205; y = 0,215
Ctb = 0,205/0,12 = 1,7 → CH4
Htb= 0,215/0,12 = 1,8 → C2H2 (Do số liên kết pi nhỏ hơn 3)
Đặt:
C2H7N: a
C3H9N: 0,02-a
CH4: b
C2H2: 0,1-b
BTNT C: 2a + 3(0,02-a) + b + 2(0,1-b) = 0,205
BTNT H: 7a + 9(0,02-a) + 4b + 2(0,1-b) = 0,215.2
→ a = 0,015; b = 0,04 → CH4 (0,04 mol) C2H2 (0,06 mol)
%C2H7N = [(0,015.45) : (0,015.45 + 0,005.59)].100% = 69,58%
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau:
Đáp án C
X tạo hợp chất màu xanh tím với dd iot => X là tinh bột
Y phản ứng với dd AgNO3/NH3 tạo ra Ag => Y là glucozo
Z làm mất màu dd nước brom và tạo ra kết tủa trắng => Z là anilin hoặc phenol
Theo các đáp án thì Đáp án C là phù hợp
Cho dung dịch AgNO3 tác dụng với dung dịch chứa chất X thấy tạo kết tủa T màu vàng. Cho kết tủa T tác dụng với dung dịch HNO3 loãng dư thấy kết tủa tan. Chất X là
Đáp án C
AgNO3 + X → T↓
T↓ + HNO3dư →
=> T phải là kết tủa có gốc axit yếu hơn HNO3
=> chỉ có đáp án (NH4)3PO4 phù hợp
(NH4)3PO4 + AgNO3 → NH4NO3 + Ag3PO4↓ vàng
Ag3PO4↓ + 3HNO3 → 3AgNO3 + H3PO4
Tiến hành các thí nghiệm sau:
(a) Cho dung dịch chứa 3a mol NaOH vào dung dịch chứa a mol AlCl3.
(b) Cho a mol Fe3O4 vào dung dịch chứa 5a mol H2SO4 loãng.
(c) Cho khí CO2 đến dư vào dung dịch Ca(OH)2.
(d) Cho Cu vào dung dịch Fe2(SO4)3 dư.
(e) Cho dung dịch chứa a mol KHSO4 vào dung dịch chứa a mol NaHCO3.
(g) Cho Al vào dung dịch HNO3 dư ( phản ứng thu được chất khử duy nhất là khí NO).
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được dung dịch chứa 2 muối là:
Đáp án B
a) 3NaOH + AlCl3 → Al(OH)3 ↓+ NaCl => thu được 1 muối
3a a (mol)
b) Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O => thu được 2 muối
a → 4a (mol)
c) 2CO2 dư + Ca(OH)2 → Ca(HCO3)2 => thu được 1 muối
d) Cu + Fe2(SO4)3 dư → CuSO4 + FeSO4 => thu được 3 muối
e) 2KHSO4 + 2NaHCO3 → K2SO4 + Na2SO4 + CO2 + 2H2O => thu được 2 muối
g) Al+ 4HNO3 → Al(NO3)3 + NO ↑ + 2H2O => thu được duy nhất 1 muối
Vậy chỉ có 2 thí ngiệm b, e thu được 2 muối
Hòa tan hoàn toàn hỗn hợp X gồm BaO, NH4HCO3, KHCO3 ( có tỉ lệ mol lần lượt là 5 :4: 2) vào nước dư, đun nóng. Đến khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chứa.
Đáp án C
BaO + H2O → Ba(OH)2
5 → 5 (mol)
Ba(OH)2 + NH4HCO3 → BaCO3↓ + NH3 + 2H2O
4 ← 4 (mol)
Ba(OH)2 + 2KHCO3 → BaCO3↓ + K2CO3 + H2O
1 ← 2 (mol)
Vậy dd Y chỉ chứa K2CO3
Hòa tan hết 23,76 gam hỗn hợp X gồm FeCl2, Cu, Fe(NO3)2 vào dung dịch chứa 0,40 mol HCl thu được dung dịch Y và khí NO. Cho từ từ dung dịch AgNO3 vào Y đến khi các phản ứng xảy ra hoàn toàn thì dùng hết 0,58 mol AgNO3, kết thúc các phản ứng thu được m gam kết tủa và 0,448 lít NO (đktc). Biết trong các phản ứng, NO là sản phẩm khử duy nhất của NO3–. Giá trị của m gần nhất với:
Ta có sơ đồ:
23,76g X + 0,4 mol HCl → NO + dd Y → 0,02 mol NO + Kết tủa + dd Z
Trong Z có Fe(NO3)3 , Cu(NO3)2
nH+ = 0,4 mol → nNO = ¼ nH+ = 0,1 mol
Trong TN1 : nNO = 0,1 – 0,02 = 0,08 mol
→ Trong X có 0,04 mol Fe(NO3)2 → Trong Z
nNO3 = 0,58 – 0,02 = 0,56 mol
Gọi số mol FeCl2 và Cu trong X lần lượt là a và b
→ 127a + 64b = 16,56g (1)
nNO3 (Z) = (a + 0,04).3 + 2b = 0,56(2)
Từ (1,2) → a = 0,08 ; b = 0,1 mol
Kết tủa thu được gồm :
nAgCl = nCl- = 0,4 + 2.0,08 = 0,56 mol
nAg = 0,08 + 0,1.2 + 0,04 – 0,1.3 = 0,02 mol
→ mkết tủa = 82,52g
Cho m gam hỗn hợp Al và Na vào nước dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,24 lít khí H2 (đktc) và 1,35 gam chất rắn không tan. Giá trị của m là
Đáp án B
Rắn không tan là Al dư => mAl dư = 1,35 (g)
nH2 = 2,24 : 22,4 = 0,1 (mol)
Gọi số mol Na = số mol Al pư = a (mol)
BT e ta có: nNa + 3nAl = 2nH2 => a + 3a = 2. 0,1
=> a = 0,05 (mol)
=> m = mNa + mAl pư + mAl dư = 0,05.23 + 0,05.27 + 1,35 = 3,85 (g)
Cho 0,15 mol tristearin ( (C17H35COO)3C3H5) tác dụng hoàn toàn với dung dịch NaOH dư, đun nóng, thu được m gam glixerol. Giá trị của m là
Đáp án A
nC3H5(OH)3 = n(C17H35COO)3C3H5 = 0,15 (mol)
=> mC3H5(OH)3 = 0,15.92 = 13,8 (g)
Một este X có công thức phân tử là C3H6O2 và không tham gia phản ứng tráng bạc. Công thức cấu tạo của este X là
Đáp án C
Este không tham gia phản ứng tráng bạc => không phải là este tạo bởi axit fomic (HCOOH)
Vậy CTCT của este X có CTPT C3H6O2 là CH3COOCH3
Phân tử polime nào sau đây chứa ba nguyên tố C, H và O ?
A. Có 3 nguyên tố C, H, O
B. Chỉ chứa 2 nguyên tố C, H
C. Chỉ chứa 2 nguyên tố C, H
D. Có 3 nguyên tố C, H, Cl
Cho m gam alanin phản ứng vừa đủ với dung dịch NaOH, thu được 27,75 gam. Giá trị của m là
Đáp án D
Alanin có công thức là: CH3-CH2(NH2)-COOH
CH3-CH2(NH2)-COOH + NaOH → CH3-CH2(NH2)-COONa + H2O
nAla-Na = 27,75/111 = 0,25 (mol)
=> nAla = nAla-Na = 0,25 (mol) => mAla = 0,25.89 = 22,25 (g)
Công thức của crom(III) oxit là
Công thức của crom(III) oxit là Cr2O3.
Hợp chất KCl được sử dụng làm phân bón hóa học nào sau đây?
Đáp án B
KCl có chứa nguyên tố K => được dùng làm phân kali
Chất nào sau đây là chất điện li yếu?
Chất điện li yếu là nước
Đáp án A
Một số axit cacboxylic như axit oxalic, axit tactric, ….gây ra vị chua cho quả sấu xanh. Trong quá trình làm món sấu ngâm đường, người ta sử dụng dung dịch nào sau đây để làm giảm vị chua của quả sấu:
Đáp án B
Các axit oxalic, axit tactric có vị chua => ta dùng Nước vôi trong do nước vôi trong có môi trường bazo (OH-) kết hợp với H+ của axit => dẫn đến giảm được vị chua
OH- + H+ → H2O
Đốt cháy hoàn toàn m gam một este X đơn chức, không no ( phân tử có một liên kết đôi C=C), mạch hở cần vừa đủ 0,405 mol O2, thu được 15,84 gam CO2. Mặt khác, m gam X tác dụng vừa đủ với dung dịch KOH, cô cạn dung dịch thu được x gam muối khan và 3,96 gam một chất hữu cơ. Giá trị của x là
Gọi CTPT của este X: CnH2n-2O2: a (mol) ( có độ bất bão hòa k = 2)
Gọi số mol H2O là b (mol) ; nCO2 = 15,84/44 = 0,36 (mol)
Ta có hệ phương trình:
2a + 0,405.2 = 0,36.2 + b
và a = 0,36 - b
→ a = 0,09 và b = 0,27
→ n = nCO2 : nX = 0,36 : 0,09 = 4
Vậy CTPT của X là C4H6O2: 0,09 (mol)
X + KOH dư → muối + 3,96 g hữu cơ
\(M = \frac{{3,96}}{{0,09}} = 44 \to C{H_3}CHO\)
Vậy CTCT của este X là: CH3COOCH=CH2
→ mmuối = mCH3COOK = 0,09.98 = 8,82 (g)
Nung nóng bình kín chứa a mol hỗn hợp NH3 và O2 ( có xúc tác Pt) để chuyển toàn bộ NH3 thành NO. Làm nguội và thêm nước vào bình, lắc đều thu được 1 lít dung dịch HNO3 có pH = 1, còn lại 0,25a mol khí O2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là
pH = 1 → [H+] = 10-1 = 0,1 (M) → nHNO3 = 0,1 (mol)
BTNT N → nNH3 = nHNO3 = 0,1 (mol)
→ nO2 = a – 0,1 (mol)
Sau quá trình
NH3 + 8e → N+5
O2 → 2O-2 + 4e
BT e → 8nNH3 = 4nO2
→ 8.0,1 = 4 ( a – 0,1)
→ a = 0,4 (mol)
Cho m gam bột sắt vào dung dịch chứa 0,12 mol Cu(NO3)2 và 0,12 mol H2SO4 ( loãng), thấy thoát ra khí NO ( sản phẩm khử duy nhất của N+5, ở đktc) và sau phản ứng thu được 3,84 gam kết tủa. giá trị của m là
Đáp án C
Sau phản ứng thu được chất rắn => có phản ứng Fe + Cu2+ → Fe2+ + Cu↓
Nếu tất cả Cu2+ chuyển thành Cu => mCu = 0,12.64 = 7,68 (g) > 3,84 (g)
Vậy Cu2+ không chuyển hết thành Cu, tức Fe phản ứng hết => do vậy Fe phản ứng chỉ tạo muối Fe2+
nCu = 3,84/64 = 0,06 (mol)
3Fe2+ + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O (Tính toán theo số mol của H+ chứ không theo NO3-)
0,09 ← 0,24 →0,06 (mol)
Fe + Cu2+ → Fe2+ + Cu↓
0,06 ← 0,06 (mol)
=> ∑ mFe = (0,09 + 0,06). 56 = 8,4 (g)
Thủy phân hoàn toàn m gam triglixerit X trong dung dịch NaOH dư, thu được 4,6 gam glixerol và hỗn hợp hai muối gồm natri stearat và natri panmitat có tỉ lệ mol tương ứng là 1: 2. Giá trị của m là
\({n_{{C_3}{H_5}{{(OH)}_3}}} = \frac{{4,6}}{{92}} = 0,05\,\,(mol)\)
Vì muối C17H35COONa : C15H31COONa = 1: 2
→ CTCT của triglixerit X là:
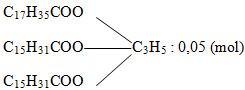
→ m = 0,05. 834 = 41,7 (g)
Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch hỗn hợp gồm a mol HCl và b mol AlCl3, kết quả thí nghiệm được biểu thị trên đồ thị sau:
Tỉ lệ y : x là:
Khi cho dd OH- vào hỗn hợp gồm H+ và muối Al3+
Sẽ xảy ra các phản ứng hóa học theo thứ tự sau:
OH- + H+ → H2O (1)
OH- + 3Al3+ → Al(OH)3↓ (2)
OH- + Al(OH)3↓ → AlO2- + 2H2O (3)
Khi phản ứng (1) kết thúc , bắt đầu xảy ra (2) thì xuất hiện kết tủa → đồ thị bắt đầu đi lên
Khi đồ thị đi lên từ từ đến điểm cực đại → xảy ra phản ứng (1) và (2)
Ta có công thức nhanh: nOH- = 3n↓ + nH+
Khi đồ thị bắt đầu đi xuống → phản ứng (3) xảy ra, kết tủa bắt đầu bị hòa tan dần dần đến hết
→ Ta có công thức tính nhanh: nOH- = 4nAl3+ - n↓ + nH+
Từ đây ta có các phương trình sau:
\(\begin{array}{l}
\left\{ \begin{array}{l}
0,5 = 3x + a\\
0,8 = 3.(x + 0,5a) + a\\
y = 4b - (x + 0,5a) + a\\
7a + 0,1 = 4b - x + a
\end{array} \right. \to \left\{ \begin{array}{l}
a = 0,2\\
x = 0,1\\
b = 0,35\\
y = 1,4
\end{array} \right.\\
\to \frac{y}{x} = \frac{{1,4}}{{0,1}} = 14
\end{array}\)
Đáp án cần chọn là: A
Cho X, Y là hai chất thuộc dãy đồng đẳng của axit acrylic và MX < MY; Z là ancol có cùng số nguyên tử cacbon với X; T là este hai chức tạo bởi X, Y và Z. Đốt cháy hoàn toàn 11,16 gam hỗn hợp E gồm X, Y, Z, T cần vừa đủ 13,216 lít khí O2 (đktc), thu được khí CO2 và 9,36 gam nước. Mặt khác 11,16 gam E tác dụng tối đa với dung dịch chứa 0,04 mol Br2. Khối lượng muối thu được khi cho cùng lượng E trên tác dụng với KOH dư là m gam. Giá trị gần nhất với m là
\({n_{{O_2}}} = 0,59\,\,mol;{n_{{H_2}O}} = 0,52\,\,mol\)
Bảo toàn khối lượng \( \to {n_{C{O_2}}} = 0,47\,\,mol\)
Do \({n_{{H_2}O}} > {n_{C{O_2}}}\)nên ancol no
Quy đổi E thành C3H4O2 (0,04 mol), C3H8O2 (x mol), CH2 (y mol) và H2O (z mol)
Ta có: mE = 0,04.72 + 76x + 14y + 18z = 11,16
\({n_{C{O_2}}} = 0,04.3 + 3{\rm{x}} + y = 0,47\)
\({n_{{H_2}O}} = 0,04.2 + 4{\rm{x}} + y + z = 0,52\)
→ x = 0,11; y = 0,02; z = -0,02
Do y < x nên ancol không chứa thêm CH2 → axit gồm C3H4O2 (0,04 mol) và CH2 (0,02 mol)
Muối gồm C3H3O2K (0,04 mol) và CH2 (0,02 mol)
→ mmuối = 4,68 gam

.PNG)

