Đề thi thử THPT QG môn Hóa học năm 2018 - Trường THPT Nguyễn Du
Đề thi thử THPT QG môn Hóa học năm 2018 - Trường THPT Nguyễn Du
-
Hocon247
-
40 câu hỏi
-
90 phút
-
25 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Kim loại Fe phản ứng được với lượng dư dung dịch nào sau đây tạo thành muối sắt (III)?
A. Fe + HCl → FeCl3 + H2
B. Fe + H2SO4 (loãng) → FeSO4 + H2
C. Fe + HNO3 (loãng) → Fe(NO3)3 + NO + 2H2O
D. Fe + CuSO4 → FeSO4 + Cu
Chất nào sau tác dụng được với dung dịch HCl và tác dụng được với dung dịch NaOH?
A. Không thỏa mãn vì không tác dụng với HCl
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
Nếu NaOH dư thì: NaOH + Al(OH)3 → NaAlO2 + 2H2O
B. Không thỏa mãn vì không tác dụng với NaOH
NaAlO2 + HCl + H2O → NaCl + Al(OH)3
Al(OH)3 + 3HCl → AlCl3 + 3H2O
C. Thõa mãn
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
D. Không thoãn mãn vì không tác dụng với NaOH và HCl
Trường hợp nào sau đây không xảy ra phản ứng hóa học
A. Si + dung dịch HCl đặc → không phản ứng
B. CO2 + Na2SiO3 + H2O → Na2CO3 + H2SiO3
C. Si + NaOH + H2O → Na2SiO3 + 2H2
D. SiO2 + Mg → MgO + Si
Ở điều kiện thường, chất nào sau đây là chất khí?
A, B, D ở điều kiện thường là chất lỏng
Tính chất hóa học đặc trưng của các kim loại là
Đáp án C
Tính chất vật lí chung của kim loại là tính dẻo, tính dẫn nhiệt, dẫn điện, ánh kim
Tính chất hóa học chung của kim loại là tính khử
Khí thải công nghiệp và khí thải của động cơ đốt trong (ô tô, xe máy) có chứa khí X. Khí X là một trong những khí chủ yếu gây ra hiện tượng mưa axit. Khí X là
Đáp án D
A, B, C là các khí chủ yếu gây ra hiệu ứng nhà kính
Muối nào sau đây dễ tan trong nước?
Đáp án A
B, C, D là các chất kết tủa tan rất ít trong nước (tích số tan rất bé)
Trong các chất sau: \(NaOH,{\rm{ }}Ca{\left( {OH} \right)_2},{\rm{ }}N{a_2}C{O_3},{\rm{ }}N{a_3}P{O_4},{\rm{ }}NaCl,{\rm{ }}HCl.\) Số chất có thể làm mềm nước có tính cứng tạm thời là
Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+
Dựa vào thành phần của anion gốc axit → Phân làm 3 loại
- Nước cứng tạm thời: chứa amoni HCO3-
- Nước cứng vĩnh cửu: chứa anion Cl- và SO42-
- Nước cứng toàn phần: chứa 3 loại amoni nói trên
Các chất có theer làm mềm nước có tính cứng tạm thời là: NaOH, Ca(OH)2, Na2CO3 và Na3PO4
Phát biểu nào sau đây sai?
B sai vì tơ visco thuộc loại tơ bán tổng hợp (hay tơ nhân tạo)
Chú ý: tơ poliamit chứa liên kết amit CO-NH, mà tơ visco không chứa N
Phản ứng nào sau đây là phản ứng thế?
\({C_2}{H_6}{\rm{ }} + {\rm{ }}C{l_2} \to {\rm{ }}{C_2}{H_5}Cl{\rm{ }} + {\rm{ }}HCl\)
Đáp án A
Phát biểu nào sau đây sai?
CH2OH(CHOH)4C+1HO + 2AgNO3 + 3NH3 → CH2OH(CHOH)4C+3OONH4 + 2Ag + NH4NO3
Glucozo thể hiện tính khử
Cho dung dịch hỗn hợp FeCl2 và CrCl3 tác dụng với dung dịch NaOH dư, thu được kết tủa X. Nung X trong không khí đến khối lượng không đổi, thu được chất rắn Y. Thành phần của Y
FeCl2;CrCl3 → Fe(OH)2 → Fe2O3 (nung ngoài không khí có oxi)
( Cr(OH)3 tan trong NaOH )
Khi thủy phân một triglixerit X, thu được các axit béo gồm axit oleic, axit panmitic, axit strearic. Thể tích khí O2 (đktc) cần để đốt cháy hoàn toàn 8,6 gam X là
Vì khi thủy phân một triglixerit X ta thu được các axit béo là axit oleic
(C17H33COOH), axit panmitic
(C15H31COOH), axit stearic
(C17H35COOH)
⇒ Công thức của X:(C17H33COO)(C15H31COOC17H35COO)C3H5.
nên X có CTPT là: C55H104O6 + 78 O2 → 55 CO2 + 52 H2O
nX = 0,01 mol ⇒ số mol O2 = 0,78 mol ⇒ V=17,472 lít
Hòa tan hoàn toàn 11,2 gam một kim loại R bằng dung dịch H2SO4, thu được khí SO2. Cho toàn bộ lượng khí này hấp thụ hết vào 400 ml dung dịch NaOH 1M, thu được dung dịch chứa 33,4 gam chất tan. Mặt khác, hòa tan hoàn toàn 19,6 gam kim loại R vào 160 ml dung dịch HCl 2M thu được dung dịch X. Cho X tác dụng với dung dịch AgNO3 dư, thu được m gam kết tủa. Giá trị của m là
TH1: chất tan gồm Na2SO3 và NaHSO3 .
Đặt nNa2SO3 = x; nNaHSO3 = y.
Bảo toàn nguyên tố Natri:
nNaOH = 2nN2SO3 + nNaHSO3 ⇒ 2x + y = 0,4 mol.
m chất tan = 126x + 104y = 33,4(g)
⇒ giải hệ có: x = 0,1 mol; y = 0,2 mol.
Bảo toàn nguyên tố Lưu huỳnh: nSO2 = 0,2 + 0,1 = 0,3 mol.
Đặt hóa trị của R là n.
Bảo toàn electron: n × nR = 2nSO2
⇒ nR = 0,6 ÷ n ⇒ MR = 11,2 ÷ (0,6 ÷ n) = 56n : 3
⇒ n = 3 và M = 56 g/mol
⇒ R là Sắt (Fe).
Xét thí nghiệm 2:
nFe = 0,14 mol; nHCl = 0,32 mol
⇒ X chứa 0,14 mol FeCl2 và 0,04 mol HCl.
Bảo toàn nguyên tố Clo:
nAgCl = nHCl = 0,32 mol
Lại có: 3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
Fe2+ + Ag+ → Fe3+ + Ag↓.
Kết tủa gồm 0,32 mol AgCl và 0,11 mol Ag
⇒ m = 57,8(g)
⇒ chọn A.
TH2: chất tan gồm NaOH dư và Na2CO3 ⇒ loại
Dung dịch axit acrylic không phản ứng được với chất nào sau đây?
Axit acrylic là CH2=CH-COOH
2CH2=CH-COOH + Na2CO3 → 2CH2=CH-COONa + CO2 + H2O
CH2=CH-COOH + Mg(NO3)2 → không phản ứng
CH2=CH-COOH + Br2 → Br-CH2-CH(Br)-COOH
CH2=CH-COOH + NaOH → CH2=CH-COONa + H2O
Phát biểu nào sau đây là đúng?
A. Sai vì thành phần chính của supephotphat kép là Ca(H2PO4)2
B. Sai vì Supephotphat đơn gồm 2 muối Ca(H2PO4)2 và CaSO4
D. Sai vì phân lân cung cấp Photpho cho cây trồng
Điện phân dung dịch gồm 0,2 mol NaCl và x mol Cu(NO3)2 (điện cực trơ, màng ngăn xốp) sau một thời gian thu được dung dịch X có khối lượng giảm 21,5 gam so với dung dịch ban đầu. Cho thanh sắt vào X đến khi các phản ứng xảy ra hoàn toàn, khối lượng thanh sắt giảm 2,6 gam và có khí NO thoát ra (sản phẩm khử duy nhất của N+5 ) Giá trị của x là
n Cl = 0,2 mol → nCl2 = 0,1 mol
2 H2O → 4 H+ + O2 + 4 e
n O2 = 0,05 mol → n H+ = 0,2 mol = n HNO3
Fe + 4 HNO3 → Fe(NO3)3 + 2 H2O + NO
0,05 → 0,2 → 0,05
Fe + 2 Fe(NO3)3 → 3 Fe(NO3)2
0,025 →0,05
→ m Fe= 56 . ( 0,025 + 0,05 ) = 4,2 gam > 2,6 gam
→ có phản ứng của Fe với muối Cu2+
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
→ m tăng của phản ứng = 4,2 – 2,6 = 1,6 g
→ nCu(NO3)2 = 1,6 : (64 – 56 ) = 0,2 mol (tăng theo thực tế chia cho tăng theo 1 mol)
Tổng số mol Cu(NO3)2 = 0,2 + 0,2 = 0,4 mol
Cho 13,2 gam hợp chất hữu cơ X (có công thức \({C_2}{H_{10}}{O_3}{N_2})\) tác dụng với 300 ml dung dịch NaOH 1M. Cô cạn dung dịch sau phản ứng, thu được phần rắn chỉ chứa các hợp chất vô cơ có khối lượng m gam và phần hơi chứa 2 khí đều làm quì tím ẩm chuyển màu xanh. Giá trị m là
Vì sau phản ứng tạo 2 khí làm xanh giấy quỳ
⇒ CTPT của X là (CH3NH3)(NH4)CO3
Ta có n(CH3NH3)(NH4)CO3 = 0,12 mol < nNaOH = 0,3 mol
⇒ NaOH dư = 0,3 – 0,12×2 = 0,06 mol.
+ Chất rắn gồm 0,12 mol Na CO và 0,06 mol NaOH dư.
⇒ m = 15,12 gam
Cho hình vẽ mô tả thí nghiệm điều chế khí Z từ dung dịch X và chất rắn Y:
Hình vẽ bên minh họa cho phản ứng nào sau đây?
Khí Z thu được bằng đẩy nước nên khí Z không tan hoặc tan ít trong nước → loại A và D
Khí Z tạo từ phản ứng của dd X với rắn Y nên loại C vì C không chứa chất rắn tham gia phản ứng
Cho các phản ứng xảy ra trong các điều kiện thích hợp:
\(\begin{array}{l}
\left( a \right){\rm{ }}C{H_3}COO{C_2}{H_5}{\rm{ }} + {\rm{ }}NaOH{\rm{ }} \to {\rm{ }}\left( b \right){\rm{ }}HCOOCH = C{H_2}{\rm{ }} + {\rm{ }}NaOH{\rm{ }} \to \\
\left( c \right){\rm{ }}{C_6}{H_5}COOC{H_3}{\rm{ }} + {\rm{ }}NaOH{\rm{ }} \to {\rm{ }}\left( d \right){\rm{ }}{C_6}{H_5}COOH{\rm{ }} + {\rm{ }}NaOH{\rm{ }} \to \\
\left( e \right){\rm{ }}C{H_3}OOCCH = C{H_2}{\rm{ }} + {\rm{ }}NaOH{\rm{ }} \to {\rm{ }}\left( g \right){\rm{ }}{C_6}{H_5}COOCH = C{H_2}{\rm{ }} + {\rm{ }}NaOH{\rm{ }} \to
\end{array}\)
Số phản ứng thu được sản phẩm có ancol là
Phản ứng thỏa mãn là (a), (c) và (e)
Hòa tan hoàn toàn hỗn hợp X gồm \(BaO,{\rm{ }}N{H_4}HC{O_3},{\rm{ }}NaHC{O_3}\) (có tỷ lệ mol lần lượt là 5 : 4 : 2) vào nước dư, đun nóng. Đến khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chứa
Giả sử có 5 mol BaO → nNH4HCO3 = 4 mol
nNaHCO3 = 2 mol
BaO + H2O → Ba(OH)2
→ nOH- = 5.2 = 10 mol
Phản ứng xảy ra vừa đủ → nCO32- = 6 mol
Mặt khác Ba2+ + CO32- → BaCO3 → CO32- dư
Dung dịch cuối cùng chỉ chứa Na+ và CO32- hay Na2CO3
Cho m gam hỗn hợp Fe và Cu (Fe chiếm 36% về khối lượng) tác dụng với dung dịch chứa 0,7 mol HNO3. Sau khi các phản ứng hoàn toàn, thu được 0,68m gam chất rắn X, dung dịch Y (không chứa muối amoni) và 0,3 mol hỗn hợp khí Z gồm NO2 và NO. Phần trăm thể tích của NO2 trong Z có giá trị gần nhất với giá trị nào sau đây?
Hỗn hợp ban đầu chứa 0,36m gam Fe và 0,64 gam Cu
Dễ thấy
mCu ban đầu = 0,64m < 0,68 = mX → X còn chứa Fe dư → HNO3 hết
Đặt nNO2 = x, nNO = y → nZ = x + y = 0,3 mol
nHNO3 = 2nNO2 + 4NO = 0,7 = 2x + 4y
Giải hệ ta có:
x = 0,25 mol
y = 0,05 mol
%mNO2 = 0,25.46 : (0,25.46 + 0,05.30) : 100% = 88,46%
Cho các phát biểu sau:
(a) Dùng dung dịch nước brom có thể phân biệt được anilin và glixerol.
(b) Các amino axit đều có tính chất lưỡng tính.
(c) Dung dịch etylamin có thể làm quỳ tím ẩm chuyển màu xanh.
(d) Amilopectin và xenlulozơ đều có cấu trúc mạch phân nhánh.
(e) Etylen glicol hòa tan được \(Cu{\left( {OH} \right)_2}\) ở điều kiện thường.
Số nhận định đúng là:
(a) đúng
(b) đúng
(c) đúng
(d) sai vì xenlulozo có cấu trúc không phân nhánh
(e) đúng
Cho axit salixylic (axit o-hiđroxibenzoic) phản ứng với metanol có axit sunfuric xúc tác thu được metyl salixylat \(\left( {{C_8}{H_8}{O_3}} \right)\) dùng làm thuốc xoa bóp giảm đau. Khối lượng KOH tối đa phản ứng vừa hết với 15,2 gam metyl salixylat là
Axit salixylic :
o-HO-C6H4COOH + CH3OH → HO-C6H4COOCH3
→ nKOH = 2nmetyl salixylat = 0,2 mol
→mKOH = 11,2g
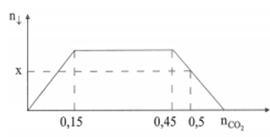
Cho CO2 từ từ vào dung dịch hỗn hợp gồm Ca(OH)2 và KOH. Số mol kết tủa sinh ra phụ thuộc vào số mol CO2 được biểu diễn theo đồ thị sau (số liệu tính theo đơn vị mol)
Giá trị của x là
Đáp án D
Nhận thấy đồ thị có các giai đoạn:
+ Giai đoạn kết tủa tăng dần do Ca(OH)2 tác dụng với CO2 tạo kết tủa CaCO3.
+ Giai đoạn kết tủa không đổi do CO2 tác dụng với KOH.
+ Giai đoạn kết tủa giảm dần do CO2 tác dụng với CaCO3 và hòa tan kết tủa này (tạo Ca(HCO3)2).
nCa(OH)2 = nCaCO3 = 0,15 mol
Lúc CO2 đạt 0,5 mol thì kết tủa đã bị hòa tan mất 0,05 mol (do từ 0,45 mol đã bắt đầu hòa tan kết tủa).
→ x = 0,15 - 0,05 = 0,1 mol
Cho từ từ từng giọt dung dịch chứa b mol HCl vào dung dịch chứa a mol Na2CO3 thu được V lít CO2 . Ngược lại, cho từ từ từng giọt của dung dịch chứa a mol Na2CO3 vào dung dịch chứa b mol HCl thu được 3V lít CO2 (các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất). Tỉ lệ a : b bằng
Do 2 thí nghiệm thu được lượng khí CO2 khác nhau nên cả 2 thí nghiệm H+ đều phản ứng hết.
Xét thí nghiệm 1: cho từ từ b mol HCl và dd a mol Na2CO3 → xảy ra pư theo thứ tự
HCl + Na2CO3 → NaCl + NaHCO3
HCl + NaHCO3 → NaCl + CO2 + H2O
→ nCO2 = nHCl – nNa2CO3 = (b –a) mol
Xét thí nghiệm 2: cho từ từ a mol Na2CO3 vào b mol HCl → chỉ xảy ra pư
Na2CO3 + 2HCl → NaCl + CO2 + H2O
→ nCO2 = 1/2 nHCl = 0,5b (mol)
Theo đề ta có: VCO2(TN2) = 2VCO2(TN1)
→ 0,5b = 2. (b –a)
→ 2a = 1,5b
→ a = 0,75b
Cho 3,6 gam axit cacboxylic no, đơn chức X tác dụng hoàn toàn với 500 ml dung dịch gồm KOH 0,12M và NaOH 0,12M. Cô cạn dung dịch thu được 8,28 gam hỗn hợp chất rắn khan. Công thức của X là
nKOH = 0,06 mol; nNaOH = 0,06 mol
Bảo toàn khối lượng: mX + mNaOH + mKOH = mrắn khan + mH2O
→ mH2O = 1,08 gam → nH2O = 0,06 mol
Vì X là axit đơn chức → nX = nNaOH, KOH = nH2O = 0,06 mol
→ MX = 3,6 / 0,06 = 60
→ X là CH3COOH
Đáp án cần chọn là: B
Cho m gam hỗn hợp bột X gồm \(F{e_x}{O_y},\) CuO và Cu (x, y nguyên dương) vào 600ml dung dịch HCl 1,5M, thu được dung dịch Y (không chứa HCl) và còn lại 9,6 gam kim loại không tan. Cho Y tác dụng với lượng dư dung dịch AgNO3 thu được 156,15 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây?
Do kim loại còn dư ⇒ không có muối Fe3+
⇒ Y chứa FeCl2 và CuCl2 .
Bảo toàn nguyên tố Clo:
nAgCl = nHCl = 0,9 mol
⇒ mAgCl = 129,15(g) < 156,15(g).
⇒ kết tủa chứa Ag ⇒ nAg = (156,15 - 129,15) ÷ 108 = 0,25 mol = nFeCl2
⇒ nCuCl2 = (0,9 - 0,25 × 2) ÷ 2 = 0,2 mol
Bảo toàn nguyên tố Hidro và Oxi:
nO/X = nH2O = n ÷ 2 = 0,45 mol.
Bảo toàn nguyên tố Fe và Cu:
m = 0,25 × 56 + 0,2 × 64 + 0,45 × 16 + 9,6 = 43,6(g)
Cho 0,5 mol hỗn hợp X gồm hai este đơn chức tác dụng vừa đủ với 350 ml dung dịch KOH 2M, thu được chất hữu cơ Y (no, đơn chức, mạch hở, có tham gia phản ứng tráng gương) và 75,4 gam hỗn hợp muối. Đốt cháy hoàn toàn Y cần vừa đủ 16,8 lít khí O2 (đktc). Khối lượng của 0,5 mol X là
Vì X gồm 2 este đơn chức phản ứng vừa đủ với KOH mà nKOH = 0,7 mol > nX = 0,5 mol
⟹ X chứa một este của phenol
Gọi este của phenol là A và este còn lại trong X là B thì ta có hệ phương trình:
\(\left\{ \begin{array}{l}{n_{hh}} = {n_A} + {n_B} = 0,5\\{n_{K{\rm{O}}H}} = 2{n_A} + {n_B} = 0,7\end{array} \right. \to \left\{ \begin{array}{l}{n_A} = 0,2\\{n_B} = 0,3\end{array} \right.\)
Vì X + KOH → Y có tham gia phản ứng tráng gương → B tạo ra anđehit Y → nY = nB = 0,3 mol
Y là anđehit no, đơn chức, mạch hở nên Y có CTPT là CnH2nO: 0,3 mol
\({C_n}{H_{2n}}O + \frac{{3n - 1}}{2}{O_2}\xrightarrow{{{t^o}}}nC{O_2} + n{H_2}O\)
0,3 → 0,15(3n-1) mol
→ nO2 = 0,75 = 0,15.(3n - 1) ⟹ n = 2 ⟹ Y là C2H4O ⟹ mY = 0,3.44 = 13,2 gam
Xét phản ứng: A + 2KOH → muối + H2O
0,2 0,4 0,2 mol
B + KOH → muối + Y
BTKL: mX + mKOH = mmuối + mY + mH2O → mX = 75,4 + 13,2 + 0,2.18 - 0,7.56 = 53 gam
Cho dãy chất: \[Fe{\left( {N{O_3}} \right)_2},{\rm{ }}Cu{\left( {N{O_3}} \right)_2},{\rm{ }}Fe,{\rm{ }}Al,{\rm{ }}ZnC{l_2},{\rm{ }}BaC{l_2}.\] Số chất trong dãy đều tác dụng được với dung dịch AgNO3 và dung dịch NaOH là
Các chất tác dụng với AgNO3 và NaOH là Fe(NO3)2, Al và ZnCl2.
Cho hai peptit mạch hở X \(\left( {{C_x}{H_y}{O_z}{N_6}} \right)\) và Y \(\left( {{C_n}{H_m}{O_6}{N_t}} \right)\) đều được tạo bởi các amino axit no chứa 1 nhóm –NH2 và 1 nhóm –COOH. Cho 32,76 gam hỗn hợp E gồm X và Y phản ứng vừa đủ với 480 ml dung dịch NaOH 1M. Mặt khác, đốt cháy hoàn toàn 32,76 gam E thu được 54,12 gamCO2 , m1 gam H2O và m2 gam N2. Giá trị của m1 là
Quy E về C2H3NO, CH2 và H2O
⇒ nC2H3NO = nNaOH = 0,48 mol.
Bảo toàn nguyên tố Cacbon:
nCH2 = nCO2 – 2nC2H3NO = 0,27 mol.
⇒ nH2O = (32,76 – 0,48 × 57 – 0,27 × 14) ÷ 18 = 0,09 mol.
Bảo toàn nguyên tố Hidro: m = 18 × (0,48 × 1,5 + 0,27 + 0,09) = 19,44(g)
⇒ chọn D.
Đốt cháy hoàn toàn a mol triglixerit X, thu được x mol CO2 và y mol H2O với \(x = y + 5a.\) Mặt khác hiđro hóa hoàn toàn 1 kg X thu được chất hữu cơ Y. Cho toàn bộ Y tác dụng vừa đủ với dung dịch NaOH, thu được muối natri stearat duy nhất và m gam glixerol. Giá trị của m gần nhất với giá trị nào sau đây?
Với HCHC chứa C, H và O (nếu có) thì:
nCO2 – nH2O = (k – 1).nHCHC (Với k là độ bất bão hòa của HCHC)
⇒ Áp dụng: k = 6 = 3πC=C + 3πC=O
X + 3H2 → Y → C17H35COONa duy nhất
⇒ Y là (C17H35COO)3C3H5
⇒ MY = 890 g/mol ⇒ MX = 890 – 3 × 2 = 884 g/mol.
nGlyxerol = nX = 1000 ÷ 884 mol
⇒ m = 104,07 (g) ⇒ Chọn B
Đốt cháy hoàn toàn 14,4 gam hỗn hợp M gồm hai axit cacboxylic đơn chức X, Y và một este đơn chức Z, thu được 0,6 mol CO2 và 0,4 mol H2O . Mặt khác, cho 18 gam hỗn hợp M trên tác dụng hết với 150 gam dung dịch NaOH 10%. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch N. Cô cạn toàn bộ dung dịch N, thu được m gam chất rắn khan; \(C{H_3}OH\) và 138,24 gam H2O . Giá trị của m là
mM = mC + mH + mO
⇒ mO = 14,4 - 0,6 × 12 - 0,4 × 2 = 6,4(g)
⇒ nO = 0,4 mol.
Do X, Y và Z đơn chức ⇒ đều chứa 2 [O] ⇒ nM = nO ÷ 2 = 0,2 mol.
⇒ 18 gam M ứng với 0,25 mol M
Đốt cho 0,75 mol CO2 và 0,5 mol H2O.
mH2O/NaOH = 150 × (1 - 0,1) = 135(g)
⇒ mH2O sinh ra = 138,24 - 135 = 3,24(g).
⇒ ∑nX, Y = 3,24 ÷ 18 = 0,18 mol
⇒ nCH3OH = nZ = 0,25 - 0,18 = 0,07 mol.
Bảo toàn khối lượng:
m = 18 + 150 - 138,24 - 0,07 × 32 = 27,52(g)
⇒ chọn B.
X là axit cacboxylic đơn chức; Y là este 3 chức (X, Y đều mạch hở). Đun nóng 25,8 gam hỗn hợp E gồm X và Y bằng dung dịch KOH vừa đủ, thu được hỗn hợp Z gồm 3 muối có khối lượng 35,3 gam và glixerol. Cho Z tác dụng với dung dịch \({H_2}S{O_4}\) loãng, thu được sản phẩm hữu cơ gồm \(C{H_3}COOH,{\rm{ }}{C_2}{H_5}COOH\) và X. Mặt khác, đốt cháy hoàn toàn 25,8 gam E thu được 26,88 lít CO2 (đktc) và 16,2 gam H2O . Công thức của X là
nC = nCO2 = 1,2 mol
nH = 2nH2O = 1,8 mol.
Mặt khác:
mE = mC + mH + mO
⇒ mO = 25,8 - 1,2 × 12 - 1,8 = 9,6(g)
⇒ nO = 0,6 mol ⇒ nCOO = 0,6 ÷ 2 = 0,3 mol.
Đặt nX = x; nY = y.
nCOO = x + 3y = 0,3 mol
Tăng giảm khối lượng: X (?COOH) → (?COOK)
Y ((?COO)3C3H5 )→ 3(?COOK)
⇒ (39 - 1)x + (39 × 3 - 41)y = 35,3 - 25,8.
Giải hệ có: x = 0,15 mol; y = 0,05 mol
Với HCHC chứa C, H và O (nếu có) thì:
nCO2 - nH2O = (k - 1).nHCHC (với k là độ bất bão hòa của HCHC).
Áp dụng: gọi a và b là độ bất bão hòa của X và Y (a ≥ 1; b ≥ 3).
1,2 - 0,9 = 0,15.(a - 1) + 0,05.(b - 1)
⇒ a = 2 và b = 4.
⇒ X là axit không no, chứa 1π và Y chứa 1 gốc X.
⇒ M = (35,3 - 0,05 × 98 - 0,05 × 112) ÷ 0,2 = 124
⇒ Muối là C3H5COOK
⇒ X là C3H5COOH ⇒ chọn C.
Hòa tan hoàn toàn 7,44 gam hỗn hợp gồm \(Mg,{\rm{ }}MgO,{\rm{ }}Fe,{\rm{ }}F{e_2}{O_3}\) vào dung dịch chứa 0,4 mol HCl và 0,05 mol NaNO3, sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X chứa 22,47 gam muối và 0,448 lít (đktc) hỗn hợp khí gồm \(NO,{\rm{ }}{N_2}\) có tỷ khối so với H2 bằng 14,5. Cho dung dịch NaOH dư vào X thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi, thu được 9,6 gam chất rắn. Nếu cho X tác dụng với dung dịch AgNO3 (dư) thì thu được m gam kết tủa. Biết chất tan trong X chỉ chứa hỗn hợp các muối. Giá trị của m là
Đáp án A
Hòa tan hết 7,44 gam hỗn hợp rắn vào 0,4 mol HCl và 0,05 mol NaNO3 thu được 22,47 gam muối và 0,02 mol hỗn hợp khí gồm NO và N2.
Giải được số mol NO và N2 đều là 0,01 mol.
Do X chứa muối nên HCl phản ứng hết.
BTKL:
mH2O = 7,44 + 0,4.36,5 + 0,05.85 - 33,47 - 0,02.29 = 3,24 → nH2O = 0,18
Cho NaOH dư vào X thu được kết tủa Y, nung Y trong không khí thu được rắn chứa MgO và Fe2O3 có khối lượng 9,6 gam.
Lượng O để oxi hóa hỗn hợp ban đầu lên tối đa là:
nNH4+ = (0,4 - 0,18.2) : 4 = 0,01 mol
Cho AgNO3 dư tác dụng với dung dịch X ta thu được kết tủa gồm AgCl 0,4 mol (bảo toàn C) và Ag.
Bảo toàn e:
nO = (9,6 - 7,44) : 16 = 0,135 mol
nAg = 0,135.2 - 0,01.8 - 0,013 - 0,01.10 = 0,06 mol
m = 63,88 gam
Cho 6,84 gam hỗn hợp Mg và Al có tỉ lệ mol tương ứng là 5: 4 tác dụng với lượng dư dung dịch HNO3 loãng, thu được dung dịch X và 0,896 lít (đktc) hỗn hợp hai khí không màu, không hóa nâu trong không khí, có tỉ khối so với H2 bằng 18. Số mol HNO3 bị khử trong quá trình trên là
nMg = 0,15 mol; nAl = 0,12 mol
Hai khí thu được là N2, N2O
Đặt nN2 = x; nN2O = y
⇒ nkhi = x+y = 0,04 mol; mkhí = 28x+44y = 0,04.18.2
Giải hệ cho x - y = 0,02 mol
Bảo toàn electron:
2nMg + 3nAl = 10nN2 + 8nNH4+
⇒ nNH4+ = 0,0375 mol
nHNO3 bi khu = 2nN2 + 2nN2O + nNH4+ = 0,1375 mol bị khử
Cho 38,55 gam hỗn hợp X gồm Mg, Al, ZnO và \(Fe{\left( {N{O_3}} \right)_2}\) tan hoàn toàn trong dung dịch chứa 0,725 mol H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 96,55 gam muối sunfat trung hòa và 3,92 lít (đktc) khí Z gồm hai khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 9. Phần trăm khối lượng Al trong X có giá trị gần nhất với giá trị nào sau đây?
Khí hóa nâu ngoài không khí là NO. MNO = 30 > 18 → Khí còn lại có phân tử khối < 18 → Khí còn lại là H2.
\(\left\{ \begin{array}{l}
{n_{NO}} + {n_{{H_2}}} = 0,175mol\\
30{n_{NO}} + 2{n_{{H_2}}} = 3,15gam
\end{array} \right. \to \left\{ \begin{array}{l}
{n_{NO}} = 0,1mol\\
{n_{{H_2}}} = 0,075mol
\end{array} \right.\)
BTKL: mX + mH2SO4 = m muối + m khí + mH2O tạo thành
→ 38,55 + 98.0,725 = 96,55 + 3,15 + 18.nH2O
→ nH2O tạo thành = 0,55 mol
Còn nH2O tạo thành + nH2 = 0,55 + 0,075 = 0,625 mol < nH2SO4
Chứng tỏ có sản phẩm nNH4+
nNH4+ = (0,725.2 - 0,625.2) : 4 = 0,05 mol
BTNT N: nFe(NO3)2 = 0,075 mol
BTNT.O: nZnO + 6nFe(NO3)2 = nNO + nH2O tạo thành
Đặt số mol của Mg, Al lần lượt là a, b
→ nZnO = 0,1 + 0,55 - 6.0,075 = 0,02 mol
→ 24a + 27b = 8,85
Vì có sản phẩm H2 tạo thành nên sau phản ứng Fe vẫn ở dạng Fe(II).
2a + 3b = 0,85
Suy ra a= 0,2 và b = 0,15 → %mAl = 10,51%
Gần với giá trị 11 nhất.
Vậy đáp án đúng là C
Cho X, Y là hai axit cacboxylic đơn chức, mạch hở, phân tử đều có chứa hai liên kết \(\pi ;{\rm{ }}Z\) là ancol hai chức có cùng số nguyên tử cacbon với X; T là este tạo bởi X, Y, Z. Đốt cháy hoàn toàn m gam hỗn hợp E gồm X, Y, Z và T cần vừa đủ 28,56 lít O2 (đktc), thu được 45,1 gam CO2 và 19,8 gam H2O. Mặt khác, m gam E tác dụng với tối đa 16 gam Br2 trong dung dịch. Nếu cho m gam E tác dụng hết với dung dịch NaOH (dư, đun nóng) thì thu được bao nhiêu gam muối?
nO2 = 1,275 mol; nCO2 = 1,025 mol; nH2O = 1,1 mol
BTNT “O”: nO(E) = 2nCO2 + nH2O – 2nO2 = 0,6 mol
Ta thấy nH2O > nCO2 → Ancol là ancol no, hai chức, mạch hở
Quy đổi hỗn hợp E thành:
CnH2n-2O2: 0,1 mol (= nBr2)
CmH2m+2O2: a mol
H2O: -b mol (→ n este = b mol)
BTNT “O”: nO = 2.0,1 + 2a – b = 0,6 (1)
BTNT “C”: 0,1n + am = 1,025 (2)
BTNT “H”: (n-1)0,1 + (m+1)a – b = 1,1 (3)
Giải (1) (2) (3) được: a = 0,225 và b = 0,05
Vậy E gồm
Este: 0,05/2 = 0,025
Ancol: 0,225 – 0,025 = 0,2
Axit: 0,1 – 0,025.2 = 0,05
Mặt khác ta có: 0,1n + 0,225m = 1,025 → 0,225m < 1,025 → m < 4,46
Mà ancol có số C bằng X nên suy ra: m ≥ 3 → 3 ≤ m < 4
+ m = 4 → n = 1,25 (loại)
+ m = 3 → n = 3,5 (nhận) => X là C3H4O2 và Z là C3H8O2
Gọi số C của Y là k, BTNT “C”: 0,025(3+k+3) + 0,2.3 + 0,05.3,5 = 1,025 → k = 4
→ Y là C4H6O2
→ nC3H4O2 = nC4H6O2 = 0,025 mol
\(E\left\{ \begin{gathered}
X:{C_3}{H_4}{O_2}:0,025 \hfill \\
Y:{C_4}{H_6}{O_2}:0,025 \hfill \\
Z:{C_3}{H_8}{O_{2:}}0,2 \hfill \\
T:{C_{10}}{H_{14}}{O_4}:0,025 \hfill \\
\end{gathered} \right. \to Muoi\left\{ \begin{gathered}
{C_3}{H_3}{O_2}Na:0,025 + 0,025 = 0,05 \hfill \\
{C_4}{H_5}{O_2}Na:0,025 + 0,025 = 0,05 \hfill \\
\end{gathered} \right.\)
→ m muối = 0,05.94 + 0,05.108 = 10,1 gam
Hòa tan hoàn toàn 1180m gam hỗn hợp H gồm \(Fe{S_2},{\rm{ }}FeS,{\rm{ }}F{e_x}{O_y},{\rm{ }}FeC{O_3}\) vào dung dịch chứa 2 mol HNO3. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X (không chứa muối amoni) và 549m gam hỗn hợp khí T gồm \(C{O_2},{\rm{ }}NO,{\rm{ }}N{O_2}.\) Dung dịch X tác dụng được với tối đa 20,16 gam Cu, thu được dung dịch Y (khối lượng chất tan trong Y nhiều hơn khối lượng chất tan trong X là 18,18 gam) và khí NO là sản phẩm khử duy nhất của N+5. Mặt khác, dung dịch X cũng phản ứng với tối đa 0,87 mol Ba(OH)2, thu được 90,4 gam kết tủa. Biết trong H oxi chiếm 24,407% về khối lượng. Phần trăm khối lượng NO2 trong T có giá trị gần nhất với giá trị nào sau đây?
Do X + Cu → sinh khí NO
⇒ X chứa H+ và NO3- ⇒ chỉ chứa Fe3+ .
Quy H về Fe, S, O và CO2
Đặt nH+ = x
4H+ + NO + 3e → NO + 2H2O
⇒ nNO = 0,25x mol, nH2O = 0,5x mol.
m chất tan giảm = mCu2+ - mNO - mH2O
⇒ 18,18 = 20,16 - 30.0,25x - 18.0,5x
⇒ x = 0,12 mol.
Fe3+ + e → Fe2+
⇒ bảo toàn electron: 2nCu = 3/4nH+ + nFe3+ ⇒ nFe3+ = 0,54 mol.
⇒ nSO42- = nBaSO4 = (90,4 - 0,54 × 107) ÷ 233 = 0,14 mol.
Bảo toàn điện tích trong X:
⇒ nNO3- = 1,46 mol
Bảo toàn nguyên tố Hidro: nH2O = 0,94 mol.
Bảo toàn khối lượng: 1180m + 2 × 63 = 549m + 0,94 × 18 + 134,32
⇒ m = 0,04.
Đặt nO/H = a; nCO2/H = b
⇒ mH = 1180 × 0,04 = 0,54 × 56 + 0,14 × 32 + 16a + 44b
n nguyên tố O = 1180 × 0,04 × 0,24407 ÷ 16 = 0,72 mol = a + 2b
⇒ giải hệ có: a = 0,56 mol; b = 0,08 mol.
Bảo toàn nguyên tố Oxi: n = 0,68 mol.
Bảo toàn nguyên tố Nitơ: n = 0,54 mol
⇒ n = 0,68 - 0,54 = 0,14 mol.
%mNO2/T = 0,14 × 46 ÷ (549 × 0,04) × 100% = 29,33%
Peptit X và peptit Y đều mạch hở cấu tạo từ α-amino axit no, mạch hở, có 1 nhóm COOH. Z là trieste của glixerol và 2 axit thuộc dãy đồng đẳng của axit acrylic. Đốt cháy hoàn toàn 0,32 mol hỗn hợp E (gồm X, Y, Z có tỉ lệ mol tương ưng là 1 : 2 : 5), thu được 3,92 mol CO2, 2,92 mol H2O và 0,24 mol N2. Nếu cho 21,62 gam E tác dụng với dung dịch NaOH dư thì thu được m gam muối. Giá trị của m là
nX = 0,04 mol ; nY = 0,08 mol và nZ = 0,2 mol
Quy E thành C2H3ON ; CH2; NH với số mol lần lượt là x, y ,z mol và (CH2=CHCOO)3C3H5 : 0,2 mol ; H2O : 0,12 mol
Bảo toàn C có nCO2 = 2nC2H3ON + nCH2 + 12neste = 2x + y + 12.0,2 =3,92 (1)
Bảo toàn H có 2nH2O = 3nC2H3ON + 2nCH2 + nNH + 14neste + 2.0,12 => 2.2,92 = 3x + y + z + 0,2.14 + 0,24 (2)
Bảo toàn N có 2nN2 = nC2H3ON + nNH = x + z = 2.0,24 (3)
Giải (1) (2) và (3) được x = 0,36 mol; y = 0,8 mol và z = 0,12 mol
mE = 0,36.57 + 0,8.14 + 0,12.15 + 0,2.254 +0,12.18 =86,48
21,62 gam E + NaOH → muối+ C3H5(OH)3 +H2O
Có nE = 21,62 : 86,48 . 0,32 = 0,08 mol nên \(\left\{ \begin{gathered}{n_X} = 0,01\,mol \\{n_Y} = 0,02\,mol \\{n_Z} = 0,05\,mol \\\end{gathered} \right.\)
nNaOH = naa + 3nZ = nC2H3ON + 3nZ = 0,36.0,08 : 0,32 + 3.0,05 = 0,24 mol
nC3H5(OH)3 = nZ = 0,05 mol và nH2O = nH2O(E) = 0,12.0,08 : 0,32 = 0,03 mol
BTKL : mmuối = mE + mNaOH – mH2O – mC3H5(OH)3 = 21,62 + 0,24.40 – 0,03.18 – 0,05.92 = 26,08 gam
Đề thi liên quan
-
Đề thi thử THPT QG môn Hóa học năm 2018 - Trường THPT Nguyễn Du
-
40 câu hỏi
-
90 phút
-

.PNG)