Đề thi thử THPT QG môn Hóa học năm 2019 - Sở GDĐT Ninh Bình lần 1
Đề thi thử THPT QG môn Hóa học năm 2019 - Sở GDĐT Ninh Bình lần 1
-
Hocon247
-
40 câu hỏi
-
90 phút
-
24 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Cách bảo quản thực phẩm (thịt, cá,...) bằng cách nào sau đây được xem là an toàn?
Dùng nước đá và nước đá khô để bảo quản thực phẩm
Đáp án C
Khi cho dung dịch anbumin tác dụng với Cu(OH)2 thì thu được dung dịch màu:
Khi cho dung dịch anbumin tác dụng với Cu(OH)2 thì thu được dung dịch màu tím
Đáp án A
Kim loại nào sau đây có khối lượng riêng nhỏ nhất?
Li có khối lượng riêng nhỏ nhất
Đáp án D
Kim loại sắt không phản ứng được với dung dịch nào sau đây?
Chọn đáp án D.
Fe không xảy ra phản ứng với ZnCl2
Chất hữu cơ X là chất rắn, màu trắng, không tan trong nước, dạng nguyên chất hay gần nguyên chất, được chế thành sơi, tơ, giấy viết. Chất X là?
Chất hữu cơ X là chất rắn, màu trắng, không tan trong nước, dạng nguyên chất hay gần nguyên chất được chế thành sợi, tơ, giấy viết → Chất X là xenlulozo
Đáp án D
Kim loại nào sau đây được điều chế bằng phản ứng thủy luyện
Cu được điều chế bằng phản ứng thủy luyện
Đáp án C
Chất nào sau đây thuộc polisaccarit?
Tinh bột thuộc polisaccarit
Đáp án A
Chất bột X màu đỏ, được quét lên phía ngoài của vỏ bao diêm. Chất X là?
Chất bột X màu đỏ, được quét lên phía ngoài của vỏ bao diêm. Chất X là Photpho.
Đáp án B
Cho hình vẽ thiết bị chưng cất thường.
.png)
Vai trò của nhiệt kế trong khi chưng cất là
Phương pháp chưng cất dùng để tách các chất lỏng có nhiệt độ sôi khác nhau nhiều
Khi đun sôi 1 hh lỏng, chất nào có nhiệt độ sôi thấp sẽ chuyển thành hơi sớm hơn và nhiều hơn. Ta dùng nhiệt kế đo nhiệt độ sôi của chất đang chưng cất, phát hiện thời điểm thích hợp để thu chất
Metylamin phản ứng với dung dịch chất nào sau đây?
CH3NH2 pư được với CH3COOH
CH3NH2 + CH3COOH → CH3COONH3CH3
Đáp án C
Este nào sau đây là no, đơn chức, mạch hở?
CH3COOCH3 là este no, đơn chức, mạch hở
Đáp án C
Dung dịch chứa chất nào sau đây không làm đổi màu quỳ tím?
Axit aminoaxetic không làm đổi màu quỳ tím
Đáp án A
Thí nghiệm nào sau đây xảy ra ăn mòn điện hóa ?
A. Thanh thép đã được sơn phủ cách li và để trong không khí khô nên không xảy ra ăn mòn điện hóa.
B. Không xảy ra ăn mòn điện hóa vì chỉ xuất hiện 1 cặp oxi hóa khử Cu2+/Cu
C. Xảy ra ăn mòn điện hóa vì đảm bảo 3 yếu tố
+ xuất hiện 2 cặp oxi hóa khử khác nhau về bản chất là Fe2+/Fe và Cu2+/Cu
+ tiếp xúc trực tiếp với nhau
+ cùng được nhúng trong dung dịch chất điện li là H2SO4 loãng.
Loại tơ nào sau đây có nguồn gốc từ xenlulozơ?
Tơ visco có nguồn gốc từ xenlulozơ
Đáp án A
Chất nào sau đây có tính lưỡng tính?
Valin có tính lưỡng tính
Đáp án C
Cho các polime sau: polietilen, poli(vinyl clorua), cao su lưu hóa, nilon–6,6, amilopectin, xenlulozơ. Số polime có cấu trúc mạch không phân nhánh là
polietilen, poli(vinyl clorua), nilon–6,6, xenlulozơ.
Cho các chất sau: phenylamoni clorua, anilin, glyxin, ancol benzylic, metyl axetat. Số chất phản ứng được với dung dịch KOH là:
Chất phản ứng được với dung dịch KOH là: phenylamoni clorua, glyxin, metyl axetat.
Este X mạch hở có công thức phân tử C5H8O2. Khi đun nóng X với dung dịch NaOH, thu được muối của axit cacboxylic và ancol no. Số đồng phân của X thõa mãn là:
Có 5 đồng phân thõa mãn:
CH2=CH-COO-CH2-CH3
CH2=CH-CH2-COO-CH3
CH3-CH=CH-COO-CH3 (Cis và Trans)
CH2=C(CH3)-COO-CH3
Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch?
Phản ứng xảy ra trong dung dịch các chất điện ly là phản ứng giữa các ion.
Phản ứng trao đổi ion trong dung dịch các chất điện ly xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau:
- Chất kết tủa.
- Chất điện ly yếu
- Chất khí.
Đáp án C
Este X mạch hở có công thức phân tử C5H8O4. Xà phòng hóa hoàn toàn X bằng dung dịch NaOH, thu được hai chất hữu cơ Y, Z. Biết Y tác dụng với Cu(OH)2 tạo dung dịch màu xanh lam và Z có khả năng tráng bạc. Phát biểu nào sau đây sai?
Z có tráng bạc nên Z là HCOONa
→ X là (HCOO)2C3H6
Y hòa tan được Cu(OH)2 nên Y là HOCH2-CHOH-CH3
→ Phát biểu D sai
Thủy phân hoàn toàn đisaccarit A thu được hai mono saccarit X và Y. Hiđrô hóa X hoặc Y đều thu được chất hữu cơ Z. Vậy A và Z lần lượt là
Thủy phân hoàn toàn đisaccarit A thu được hai mono saccarit X và Y. Hiđrô hóa X hoặc Y đều thu được chất hữu cơ Z. Vậy A và Z lần lượt là Saccarozơ và sobitol.
Đáp án D
Cho 1 mol X tác dụng tối đa 1 mol Br2. Vậy X là chất nào sau đây?
A. 1 mol CH2=CH2 cộng tối đa được 1 mol Br2.
B. 1 mol CH2=CH-CH=CH2 cộng tối đa được 2 mol Br2
C. CH4 không phản ứng cộng được với Br2
D. CH≡CH phản ứng cộng tối đa được 2 mol Br2
Đáp án A
Cho các phát biểu sau:
(a) Dầu mỡ sau khi sử dụng, có thể tái chế thành nhiên liệu.
(b) Muối mononatri của axit glutamic được dùng làm bột ngọt (mì chính).
(c) Amilopectin, tơ tằm, lông cừu là polime thiên nhiên.
(d) Chất độn amiăng làm tăng tính chịu nhiệt của chất dẻo.
(e) Khi cho giấm ăn (hoặc chanh) vào sữa bò hoặc sữa đậu nành thì thấy có kết tủa xuất hiện.
(g) Thành phần chính của khi biogas là metan.
Số phát biểu đúng là
Tất cả các phát biểu trên đều đúng
Đáp án B
Cho 2,52 gam kim loại M tác dụng với dung dịch H2SO4 loãng, vừa đủ, sau phản ứng thu được 6,84 gam muối sunfat trung hòa. Kim loại M là
nSO42- = (6,84 - 2,52)/96 = 0,045 mol
Kim loại M hóa trị x. Bảo toàn electron:
2,52x/M = 0,045.2 → M = 28x
→ x = 2 và M = 56: M là Fe
Thủy phân hợp chất NH2-CH(CH3)-CONH-CH2-CONH-CH2-CH2-CONH-CH(C6H5)-CONH-CH(CH3)-COOH thì số α - amino axit thu được là
Chọn D.
Thuỷ phân peptit trên thu được NH2-CH(CH3)-COOH; NH2-CH(C6H5)-COOH; NH2-CH2-COOH
Thủy phân 68,4 gam saccarozơ trong môi trường axit với hiệu suất 92%, sau phản ứng thu được dung dịch chứa m gam glucozơ. Giá trị của m là
mC6H12O6 = 0,2 mol
mC6H12O6 = 0,2.92%.180 = 33,12 gam
Cho a gam hỗn hợp X gồm glyxin, alanin và valin phản ứng với 100 ml dung dịch HCl 1M thu được dung dịch Y. Để phản ứng hết với các chất trong dung dịch Y cần 380 ml dung dịch KOH 0,5M. Mặt khác đốt cháy hoàn toàn a gam hỗn hợp X rồi cho sản phẩm cháy vào bình đựng dung dịch Ba(OH)2 dư, sau phản ứng khối lượng dung dịch trong bình giảm 43,74 gam. Giá trị của a là
nHCl = 0,1 mol; nKOH = 0,19 mol
Đặt công thức chung của hỗn hợp X là CnH2n+1N2O
* X tác dụng với HCl sau đó tác dụng với KOH vừa đủ
nKOH = nHCl + nX → nX = nKOH – nHCl = 0,19 – 0,1 = 0,09 mol
* Đốt cháy X:
Dễ thấy: nX = (nH2O-nCO2)/0,5 (HS tự chứng minh bằng cách viết PTHH)
Đặt nCO2 = x mol và nH2O = y mol
→ (y – x)/0,5 = 0,09 (1)
m dd giảm = mBaCO3 – (mCO2 + mH2O) => 197x – (44x + 18y) = 43,74 (2)
Giải (1) và (2) thu được: x = 0,33 và y = 0,375
Thành phần các nguyên tố C, H, N, O trong hỗn hợp X là:
nC = nCO2 = 0,33 mol
nH = 2nH2O = 0,75 mol
nN = nX = 0,09 mol
nO = 2nX = 0,18 mol
→ a = mC + mH + mO + mN = 0,33.12 + 0,75 + 0,09.14 + 0,18.16 = 8,85 gam
Thủy phân hoàn toàn a mol triglixerit X trong dung dịch NaOH vừa đủ , thu được glixerol và m gam hỗn hợp muối. Đốt cháy hoàn toàn a mol X càn vừa đủ 7,75 mol O2 và thu được 5,5 mol CO2. Mặt khác, a mol X tác dụng tối đa với 0,2 mol Br2 trong dung dịch. Giá trị của m là
BTNT(O): 6nX + 2nO = 2nCO2 + nH2O → nH2O = 6a + 4,5
Độ không no của X là k = 3 + 0,2/a
nX = (nH2O - nCO2 )/(1-k)
→ a = (6a + 4,5 -5,5)/(1-3-0,2/a)
→ a = 0,1
BTKL: mX = mCO2 + mH2O - mO2 = 85,8
nC3H5(OH)3 = a = 0,3
BTKL: mX + mNaOH = m muối + mC3H5(Oh)3
→ m muối = 88,6 gam
Thực hiện các thí nghiệm sau:
(a) Cu vào dung dịch Fe2(SO4)3.
(b) Sục khí CO2 vào dung dịch Ca(OH)2.
(c) Sục hỗn hợp NO2 và O2 vào nước.
(d) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(e) Cho FeO vào dung dịch H2SO4 đặc, nóng.
(g) Cho Fe3O4 vào dung dịch HCl.
Số thí nghiệm có xảy ra phản ứng oxi hóa khử là
Số thí nghiệm xảy ra oxi hóa khử là: (a), (c), (d), (e).
Rót từ từ dung dịch HCl vào dung dịch hỗn hợp X chứa a mol K2CO3 và 1,25a mol KHCO3 ta có đồ thị như sau
.png)
Khi số mol HCl là x thì dung dịch chứa 97,02 gam chất tan. Giá trị của a là
Chọn đáp án B.
Tại vị trí nHCl = 2a trên đồ thị thu được 0,25x mol CO2 nên ta có các phương trình:
CO32- + H+ → HCO3-
a a a
HCO3- + H+ →CO2 + H2O
a a a
→ nCO2 = 0,25x = a → x = 4a, sau khi cho x = 4a mol HCl vào thì dung dịch chứa:
KCl = 3,25a, HCl = 0,75a
→ 3,25a × 74,5 + 0,75a × 36,5 = 97,02
→ a = 0,36
Cho các phát biểu sau:
(a) Thủy phân tripanmitin và etyl axetat đều thu được ancol.
(b) Mỡ động vật và dầu thực vật đều chứa nhiều chất béo.
(c) Hiđro hóa triolein thu được tripanmitin.
(d) Thủy phân vinyl fomat thu được hai sản phẩm đều có phản ứng tráng bạc.
(e) Ứng với công thức đơn giản nhất là CH2O có 3 chất hữu cơ đơn chức, mạch hở.
Số phát biểu đúng là
Các phát biểu đúng là: (a), (b), (d), (e)
Cho các bước tiến hành thí nghiệm tráng bạc của glucozơ
(1) Thêm 3 - 5 giọt glucozơ vào ống nghiệm.
(2) Nhỏ từ từ dung dịch NH3 cho đến khi kết tủa tan hết.
(3) Đun nóng nhẹ hỗn hợp ở 60 - 70°C trong vài phút.
(4) Cho 1 ml dung dịch AgNO3 1% vào ống nghiệm sạch.
Thứ tự tiến hành đúng là
Thứ tự đúng là 4, 2, 1, 3.
4,2: Tạo phức bạc
1,3: Thực hiện phản ứng tráng gương
Hỗn hợp X gồm Al, Fe2O3, Fe3O4, CuO trong đó oxi chiếm 25,39% khối lượng hỗn hợp. Cho m gam hỗn hợp X tác dụng với 8,96 lít CO (điều kiện tiêu chuẩn) sau một thời gian thu được chất rắn Y và hỗn hợp khí Z có tỉ khối so với hiđro là 19. Cho chất rắn Y tác dụng với dung dịch HNO3 loãng dư thu được dung dịch T và 7,168 lít NO (điều kiện tiêu chuẩn, sản phẩm khử duy nhất). Cô cạn dung dịch T thu được 3,456m gam muối khan. Giá trị của m gần với giá trị nào sau đây nhất?
Khí Z chứa nCO2 = 0,25 và nCO = 0,15
Trong X: nO = 0,2539m/16
→ Trong Y: nO = 0,2539m/16 - 0,25
nNO3- = 3nNO + 2nO = 0,46 + 0,2538m/8
m muối = (m - 0,2538m) + 62.(0,46 + 0,2538m/8) = 3,456m
→ m = 38,39 gam
Đốt cháy hoàn toàn 0,6 mol hỗn hợp E chứa ancol X, este đơn chức Y và andehit Z (X, Y, Z đều no , mạch hở và có cùng số nguyên tử hydro) có tỉ lệ mol tương ứng 3 : 1 : 2 thu được 24,64 lít CO2 (đktc) và 21,6 gam nước. Mặt khác cho 0,6 mol hỗn hợp E trên tác dụng với dung dịch AgNO3 trong NH3 đun nóng thu được m gam Ag. Giá trị m là
nH2O = 1,2 → Số H = 2nH2O/nE = 4
Các chất có cùng số H nên E gồm:
X là CH3OH (3a mol); Y là HCOOCH3 ( amol); Z là CnH4Oz (2a mol)
→ nE = 3a + a + 2a = 0,6 → a = 0,1
nCO2 = 3a + 2a + 2na = 1,1 → n = 3
Z no, mach hở nên Z là OHC-CH2-CHO
nAg = 2nY + 4nZ = 1 mol
→ mAg = 108 gam
Cho hỗn hợp E gồm X (C6H16O4N2) và Y (C9H23O6N3, là muối của axit glutamic) tác dụng hoàn toàn với dung dịch KOH thu được 7,392 lít hỗn hợp hai amin no (kế tiếp trong dãy đồng đẳng, có tỷ khối so với H2 là 107/6) và dung dịch T. Cô cạn T, thu được m gam hỗn hợp G gồm ba muối khan trong đó có 2 muối có cùng số nguyên tử cacbon trong phân tử. Giá trị của m là
Mamin = 35,67 g/mol ⇒ 2 amin là CH3NH2 (x mol) và C2H5NH2 (y mol).
⇒ \(\left\{ {\begin{array}{*{20}{c}}{x + y = 0,33}\\{31x + 45y = 0,33 \times \dfrac{{107}}{3}}\end{array}} \right.\)
⇒ giải hệ có: x = 0,22 mol; y = 0,11 mol.
X là CH3COOH3NCH2COOH3NC2H5 và Y là CH3NH3OOC(CH2)2CH(H3NOOCCH3)COOH3NCH3.
⇒ nX = nY = 0,11 mol ⇒ G gồm GluK2 (0,11 mol); GlyK (0,11 mol) và CH3COOK (0,22 mol) ||⇒ m = 58,52 gam
Điện phân dung dịch X chứa Cu(NO3)2 và NaCl với điện cực trơ thấy thể tích khí thoát ra ở cả 2 điện cực (V lít) và thời gian điện phân (t giây) phụ thuộc nhau như trên đồ thị.
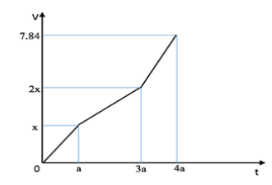
Nếu điện phân dung dịch trong thời gian 2,5a giây rồi cho dung dịch sau điện phân tác dụng với lượng Fe dư (NO là sản phẩm khử duy nhất của N+5) thì lượng Fe tối đa đã phản ứng là
– Tại t = a (s): V tăng yếu lại ⇒ Cl– bị điện phân hết.
Xem V lít ⇌ V mol ⇒ nCl2 = x mol ⇒ ne = 2x mol.
– Tại t = 3a (s): ne = 3 × 2x = 6x mol; V tăng mạnh lên.
⇒ Cu2+ bị điện phân hết ⇒ nCu2+ = 6x ÷ 2 = 3x mol.
– Tại t = 4a (s): ne = 4 × 2x = 8x mol.
⇒ \(\left\{ {\begin{array}{*{20}{c}}{{n_{{O_2}}} = \dfrac{{8x - 2x}}{4} = 1,5x}\\{{n_{{H_2}}} = \dfrac{{8x - 6x}}{2} = x}\end{array}} \right.\)
⇒ 1,5x + x + x = 0,35 ⇒ x = 0,1 mol
– Tại t = 2,5a (s): ne = 2,5 × 2 × 0,1 = 0,5 mol.
⇒ nCu2+ pứ = 0,25 mol ⇒ nCu2+ dư = 0,05 mol.
nH+ = 0,5 – 0,1 × 2 = 0,3 mol
Fe phản ứng tối đa nên Fe chỉ lên +2.
⇒ BTe: 2nFe = 3/4nH+ + 2nCu2+ dư ⇒ mFe = 9,1 gam
Đốt cháy hoàn toàn m gam hỗn hợp A gồm 3 este X, Y, Z (đều mạch hở và chỉ chứa chức este, Z chiếm phần trăm khối lượng lớn nhất trong P) thu được lượng CO2 lớn hơn H2O là 0,25 mol. Mặt khác m gam P phản ứng vừa đủ với dung dịch NaOH thu được 22,2 gam 2 ancol hơn kém nhau 1 nguyên tử cacbon và hỗn hợp T gồm 2 muối. Đốt cháy hoàn toàn T cần vừa đủ 0,275 mol O2 thu được CO2, 0,35 mol Na2CO3 và 0,2 mol H2O. Phần trăm khối lượng của Z trong A là
Bảo toàn nguyên tố Natri: nCOONa = nNaOH = 0,35 × 2 = 0,7 mol.
Bảo toàn nguyên tố Oxi: nCO2 = 0,35 mol
Dễ thấy trong muối thì:
nC = 0,7 mol = nNa ⇒ T gồm HCOONa (x mol) và (COONa)2 (y mol).
Bảo toàn nguyên tố Hidro: nHCOONa = 0,2 × 2 = 0,4 mol.
⇒ n(COONa)2 = (0,7 – 0,4) ÷ 2 = 0,15 mol
Bảo toàn khối lượng:
mT = 47,3 gam
Bảo toàn khối lượng: mA = 41,5 gam.
Xét phản ứng đốt A, đặt nCO2 = a; nH2O = b ⇒ a – b = 0,25.
mA = mC + mH + mO = 12a + 2b + 0,7 × 2 × 16 = 41,5 gam ||⇒ giải hệ có:
a = 1,4 mol; b = 1,15 mol
Bảo toàn nguyên tố Cacbon:
nC/ancol = 0,7 mol = nO/ancol ⇒ số C = số nhóm OH ⇒ 2 ancol no, mạch hở.
Tương tự: nH/ancol = 2,6 mol ⇒ nancol = 2,6 ÷ 2 – 0,7 = 0,6 mol.
⇒ Ctb = 1,3 ⇒ 2 ancol là CH3OH (0,5 mol) và C2H4(OH)2 (0,1 mol).
Ghép chất ⇒ A gồm (HCOO)2C2H4 (0,1 mol), HCOOCH3 (0,2 mol) và (COOCH3)2 (0,15 mol) ⇒ Z là (COOCH3)2 (%mZ = 42,65%)
Cho X và Y là hai axit cacboxylic đơn chức (trong đó có một axit có một liên kết đôi C=C, MX < MY), Z là este đơn chức, T là este 2 chức (các chất đều mạch hở, phân tử không có nhóm chức nào khác, không có khả năng tráng bạc). Cho 38,5 gam hỗn hợp E gồm X, Y, Z, T tác dụng vừa đủ với 470 ml dung dịch NaOH 1M được m gam hỗn hợp 2 muối và 13,9 gam hỗn hợp 2 ancol no, mạch hở có cùng số nguyên tử C trong phân tử. Đốt cháy hoàn toàn m gam hỗn hợp muối cần vừa đủ 27,776 lít O2 thu được Na2CO3 và 56,91 gam hỗn hợp gồm CO2 và H2O. Phần trăm theo khối lượng của T trong E gần nhất với giá trị nào sau đây?
nNaOH = nCOO = 0,47 mol → nO(muối) = 2nCOO = 0,94 mol
BTNT "Na": nNa2CO3 = 0,5nNaOH = 0,235 mol
- Xét phản ứng đốt muối:
+ mCO2 + mH2O = 44x + 18y = 56,91 (1)
+ BTNT "O": nO(muối) + 2nO2 = 2nCO2 + nH2O → 0,94 + 2.1,24 = 2x + y (2)
Giải (1) và (2) được x = 1,005 và y = 0,705
BTKL: m muối = mNa2CO3 + mCO2 + mH2O - mO2 = 0,235.106 + 1,005.44 + 0,705.18 - 1,24.32 = 42,14 (g)
Do sau phản ứng thủy phân thu được 2 muối (muối natri của X và Y) nên các este cũng được tạo thành từ gốc axit của X và Y => Muối có dạng: RCOONa
→ n muối = nNaOH = 0,47 mol
→ M muối = 42,14 : 0,47 = 89,66 → R = 22,66
→ Muối nhỏ hơn là CH3COONa (vì các chất không có phản ứng tráng bạc nên không chứa muối HCOONa)
Giả sử muối gồm:
CH3COONa (a mol)
CnH2n-1COONa (b mol)
a + b = 0,47
2a + b(n+1) = nCO2 + nNa2CO3 = 1,24 (BTNT "C")
1,5a + b(n-0,5) = nH2O = 0,705
Giải hệ trên được a = 0,17; b = 0,3 và n = 2 (CH2=CH-COONa)
- Xét phản ứng thủy phân E:
BTKL: mE + mNaOH = m muối + m ancol + mH2O → 38,5 + 0,47.40 = 42,14 + 13,9 + mH2O
→ mH2O = 1,26 gam → nH2O = 0,07 mol
Do các axit đơn chức nên ta có → nX,Y = nH2O = 0,07 mol
Mà nNaOH = nX,Y + nZ + 2nT → nZ + 2nT = 0,47 - 0,07 = 0,4 mol
- Xét hỗn hợp ancol gồm 1 ancol đơn chức CnH2n+2O (u) và 1 ancol hai chức CnH2n+2O2 (v):
nZ + 2nT = 0,4 → u + 2v = 0,4
Ta có: 0,5u + v < u + v < u + 2v => 0,2 < u + v < 0,4 → 13,9/0,4 < M ancol < 13,9/0,2
→ 34,75 < M ancol < 69,5
TH1: C3H8O (u) và C3H8O2 (v)
Ta có: u+2v = 0,4 và 60u + 76v = 13,9 → nghiệm âm (loại)
TH2: C2H6O (u) và C2H6O2 (v)
Ta có: u+2v = 0,4 và 46u + 62v = 13,9 => u = 0,1; v = 0,15
Như vậy suy ra thành phần của E
→ %mT = (0,15.158/38,5).100% = 61,56% gần nhất với 61%
Đáp án D
Hòa tan hoàn toàn 8,6 gam hỗn hợp Al, Mg, Fe, Zn vào 100 gam dung dịch gồm KNO3 1M và H2SO4 2M, thu được dung dịch X chứa 43,25 gam muối trung hòa (không chứa Fe3+) và hỗn hợp khí Y (trong đó H2 chiếm 4% khối lượng Y). Cho một lượng KOH vào X, thu được dung dịch chỉ chứa một chất tan và kết tủa Z (không có khí thoát ra). Nung Z trong không khí đến khối lượng không đổi được 12,6 gam chất rắn. Nồng độ phần trăm của FeSO4 trong X gần giá trị nào nhất sau đây?
m muối = mAl,Mg,Fe,Zn + mK+ + mSO42- → 43,25 = 8,6 + 39x + 96.2x → x = 0,15 mol
Đặt mY = m (gam) → mH2 = 0,04m gam → nH2 = 0,02m (mol)
BTNT "H": nH2O = nH2SO4 - nH2 = 0,3 - 0,02m (mol)
BTKL: mKL + mKNO3 + mH2SO4 = m muối + mY + mH2O
→ 8,6 + 0,15.101 + 0,3.98 = 43,25 + m + 18(0,3 - 0,02m) → m = 7,03125 gam
→ m dd sau pư = mKL + m(dd KNO3+H2SO4) - m khí = 8,6 + 100 - 7,03125 = 101,56875 gam
- Đặt nAl3+ = a; nMg2+ = b; nFe2+ = c; nZn2+ = d (mol)
BTĐT cho dd X: 3nAl3+ + 2nMg2+ + 2nFe2+ + 2nZn2+ + nK+ = 2nSO42-
3a + 2b + 2c + 2d + 0,15 = 2.0,3 => 3a + 2b + 2c + 2d = 0,45 (*)
- Xét hỗn hợp oxit sau khi nung kết tủa: Al2O3 (0,5a), MgO (b), Fe2O3 (0,5c), ZnO (d)
nO(oxit) = m oxit - mKL = 12,6 - 8,6 = 4 gam → nO(oxit) = 0,25 mol
→ 3.0,5a + b + 3.0,5c + d = 0,25 (**)
Lấy 2(**) - (*) được c = 0,05
→ C%FeSO4 = (0,05.152)/ 101,56875.100% = 7,48% gần nhất với 7,5%
Thực hiện thí nghiệm theo thứ tự:
+ Cho vài giọt phenolphtalein vào 3 ống nghiệm chứa nước được đánh số thứ tự.
+ Cho vào ống thứ nhất 1 mẩu Na nhỏ.
+ Cho vào ống thứ hai 1 mẩu Mg.
+ Cho vào ống thứ ba một mẩu Al.
Để yên các ống nghiệm một thời gian rồi lần lượt đun nóng. Phát biểu nào sau đây đúng?
Sau khi đung nóng có 2 ống nghiệm chuyển sang màu hồng laf ống 1 và ống 2
Ống 1: Na tan trong H2O ngay ở điều kiện thường
Na + H2O → NaOH + H2
Ống 2: Mg tan trong H2O khi đun nóng
Mg + H2O → Mg(OH)2 + H2
tại ống 3, xảy ra phản ứng ở điều kiện thường nhưng nhanh chóng dừng lại do tạo kết tủa keo. Không có gì khác xảy ra khi đun nóng.

