Đề thi thử THPT QG môn Hóa học năm 2019 - Trường THPT Lý Thường Kiệt lân·
Đề thi thử THPT QG môn Hóa học năm 2019 - Trường THPT Lý Thường Kiệt lân·
-
Hocon247
-
40 câu hỏi
-
90 phút
-
25 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Hỗn hợp X gồm một axit cacboxylic đơn chức, một axit cacboxylic hai chức (hai axit đều mạch hở, có cùng số liên kết π) và hai ancol đơn chức là đồng đẳng liên tiếp. Đốt cháy hoàn toàn m gam X, thu được 0,21 mol CO2 và 0,24 mol H2O. Thực hiện phản ứng este hóa m gam X (giả sử hiệu suất các phản ứng đều bằng 100%), sản phẩm sau phản ứng chỉ có nước và 5,4 gam các este thuần chức. Phần trăm khối lượng của ancol có phân tử khối lớn trong X gần nhất với:
Tổng quát : COOH + OH → COO + H2O
Vì chỉ tạo este thuần chức →COOH phản ứng vừa đủ với OH
Gọi nCOOH = x = nOH = nCOO = nH2O
meste + mH2O = mC + mH + mO → 5,4 + 18x = 0,21.12 + 0,23.2 + 3x.16
→ x = 0,08 mol
Bảo toàn O : nO(X) + 2nO2 = 2nCO2 + nH2O
→ nO2 = 0,21 mol
→ mX = 6,84g
Do nH2O > nCO2 → 2 ancol no , đơn chức
Giả sử 2 axit đều có 2 pi
→ nH2O – nCO2 = nancol – naxit → naxit = 0,05 mol
Mà nCOOH = 0,08 → naxit 2 chức = 0,03 ; naxit đơn chức = 0,02
→ Số C trung bình = 1,6
Vì 2 axit có cùng số pi = 2 → axit đơn chức có ít nhất 3C
→ chứng tỏ ancol là CH3OH : x mol và C2H5OH : y mol
Số H trung bình = 3,7 → axit là HOOC-COOH
Axit đơn chức là CnH2n-2O2 : 0,02 mol (n > 2)
→ x + y = 0,08 = nancol
Ta có: nC = x + 2y + 0,02n + 0,03.2 = 0,21 → x + 2y + 0,02n = 0,15
→ y + 0,02n = 0,15 – 0,08 = 0,07
→ 0,02n < 0,07 => n < 3,5
→ n = 3 (TM) → x= 0,07 ; y = 0,01 mol
→ %mC2H5OH(X) = 6,73%
Hỗn hợp X gồm Al, Ca, Al4C3 và CaC2. Cho 15,15 gam X vào nước dư, chỉ thu được dung dịch Y và hỗn hợp khí Z (C2H2, CH4, H2). Đốt cháy hết Z, thu được 4,48 lít CO2 (đktc) và 9,45 gam H2O. Nhỏ từ từ 200ml dung dịch HCl 2M vào Y được m gam kết tủa. Giá trị của m là
Để ý (4Al + 3C = Al4C3) + 12H2O → 4Al(OH)3 + (3CH4 = 3C + 12H)
(Ca + 2C = CaC2) + 2H2O → Ca(OH)2 + (C2H2 = 2C + 2H)
→ quy đổi X gồm x mol Al + y mol Ca và 0,2 mol C khi tác dụng H2O
→ Z gồm 0,2 mol C + 1,05 mol H
→ 1,05 = 3x + 2y. Khối lượng 27x + 40y = 12,75
→ giải x = 0,25 mol Al và 0,15 mol Ca.
có 0,4 mol Cl đi về 0,15 mol CaCl2 và 0,1/3 mol AlCl3
→ còn bao nhiêu Al nữa ở hết trong tủa Al(OH)3
→ yêu cầu m = (0,25 – 0,1 ÷ 3) × 78 = 16,9 gam
Hỗn hợp X chứa 1 amin no mạch hở đơn chức, 1 ankan, 1 anken. Đốt cháy hoàn toàn 0,4 mol X cần dùng vừa đủ 1,03 mol O2. Sản phẩm cháy thu được có chứa 0,56 mol CO2 và 0,06 mol N2. Phần trăm khối lượng của anken có trong X gần nhất với
namin = 0,12 mol ; nX = 0,4 mol
Bảo toàn oxi: 2.nO2 = 2.nCO2 + nH2O
→ nH2O = 0,94 mol
TQ : CnH2n+3N ; CmH2m+2 ; CtH2t
→ nH2O − nCO2 = 1,5namin + nankan
→ nankan = 0,2 mol → nanken = 0,08 mol
Bảo toàn C : 0,12n + 0,2m + 0,08t = 0,56
→ n = m = 1 ; t = 3
→ CH5N ; CH4 ; C3H6
→ %mC3H6 = 32,6%
Hỗn hợp rắn X gồm FeS , FeS2 , FexOy , Fe. Hòa tan hết 29,2g X vào dung dịch chứa 1,65 mol HNO3 sau phản ứng thu được dung dịch Y và 38,7g hỗn hợp khí Z (NO và NO2) ( không có sản phẩm khử nào khác của NO3-). Cô cạn dung dịch Y thì thu được 77,98g hỗn hợp muối khan. Mặt khác, khi cho Ba(OH)2 dư vào dung dịch Y lấy kết tủa thu được đem nung trong không khí đến khối lượng không đổi thu được 83,92g chất rắn khan. Dung dịch Y hòa tan tối đa m gam Cu tạo khí NO duy nhất. Giá trị của m là
Y có thể hòa tan Cu tạo NO → Y có H+ , NO3- dư → Fe → Fe3+
Vì không có sản phẩm khử nào khác ngoài NO và NO2 → không có NH4+
→ H trong HNO3 chuyển thành H trong H2O
→ nH2O = ½ nHNO3 pứ
Bảo toàn khối lượng : mX + mHNO3 pứ = mmuối + mH2O + mNO+NO2
→ nHNO3 pứ = 1,62 mol ; nH2O = 0,81 mol
→ nHNO3 dư = 0,03 mol
Giả sử trong muối khan gồm x mol Fe2(SO4)3 và y mol Fe(NO3)3
→ mmuối = 400x + 242y = 77,98
→ Chất rắn sau nung gồm : (x + 0,5y) mol Fe2O3 và 3x mol BaSO4
→ mrắn = 160(x + 0,5y) + 233.3x = 83,92
→ x = 0,08 ; y = 0,19 mol
Dung dịch Y gồm : 0,35 mol Fe3+ ; 0,6 mol NO3- ; 0,03 mol H+ có thể phản ứng với Cu
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
2Fe3+ + Cu → Cu2+ + 2Fe2+
→ nCu pứ = 3/8nH+ + 1/2nFe3+ = 0,18625 mol
→ m = 11,92g
Tripeptit X và tetrapeptit Y đều mạch hở. Khi thủy phân hoàn hoàn hỗn hợp X và Y chỉ tạo ra một amino axit duy nhất có công thức H2NCnH2nCOOH. Đốt cháy 0,05 mol Y trong oxi dư, thu được N2 và 36,3 gam hỗn hợp gồm CO2, H2O. Đốt cháy 0,01 mol X trong oxi dư, cho sản phẩm vào dung dịch Ba(OH)2 dư, thu được m gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là
Gọi công thức của X : C3nH6n-1N3O4 và Y là: C4nH8n-2N3O4
Đốt cháy 0,05 mol Y sinh ra 0,05.4n mol CO2 và 0,05.(4n-1) mol H2O
→ 0,05.4n.44 + 0,05. (4n-1).18 = 36,3 → n= 3
Đốt cháy 0,01 mol X C9H17N3O4 sinh ra 0,09 mol CO2 → n↓ = 0,09 mol
→ m↓ = 0,09. 197 = 17,73 gam → Đáp án B.
Cho 6,06 gam hỗn hợp gồm K và Ba vào dung dịch chứa đồng thời các axit HCl 2M và H2SO4 1M thu được dung dịch X chứa m gam chất tan và 4,66 gam kết tủa. Khi cho 5,13 gam muối Al2(SO4)3 vào dung dịch X thì sau các phản ứng hoàn toàn thu được 3,11 gam kết tủa. Giá trị của m là:
Nhận xét: 5,13 gam muối Al2(SO4)3 ứng 0,015 mol
→ nếu đủ OH- thì sinh tối đa 0,015 × 2 × 78 = 2,34 gam tủa < 3,11 gam.
→ theo đó, trong X cần phải có dư Ba2+. Có nghĩa là H2SO4 đã nằm hết trong 4,66 gam kết tủa BaSO4.
→ có 0,02 mol H2SO4 → có 0,04 mol HCl (tỉ lệ nồng độ trong cùng một dung dịch)
→ dung dịch X gồm K+; Ba2+; 0,04 mol Cl- và OH-.
Trong X, ta quan tâm đến x mol Ba2+ và y mol OH-.
Nhận xét chút: Cl-; OH- sinh ra do (6,06 – 0,02 × 137 = 3,32 gam) Ba và K; nên không thế sinh quá 0,045 mol OH- được; đã thế muốn kết tủa rồi hòa tan Al3+ thì cần mol OH- > 0,09 mol.
→ 3,11 tủa này gồm x mol BaSO4 và y/3 mol Al(OH)3 → mtủa = 3,11 = 233x + 26y (1).
Lại để ý: nK+ = (y + 0,04 – 2x) nên → 39.(y + 0,04 – 2x) + 137x = 3,32 gam (2).
Giải hệ được x = 0,01 mol và y = 0,03 mol ||→ nK+ = 0,05 mol → m = 5,25 gam.
Chọn đáp án D
Tiến hành các thí nghiệm sau:
(a) Điện phân dung dịch AlCl3.
(b) Điện phân dung dịch CuSO4.
(c) Điện phân nóng chảy NaCl
(d) Cho luồng khí CO qua bột Al2O3 nung nóng.
(e) Cho AgNO3 dư vào dung dịch FeCl2.
(f) Nung nóng hỗn hợp chứa CuO, Ca và Fe(OH)3
(g) Cho luồng khí NH3 qua CuO nung nóng.
(h) Nung nóng hỗn hợp bột Cr và Al2O3.
Số thí nghiệm sau khi kết thúc phản ứng tạo sản phẩm có chứa kim loại là:
(b) Điện phân dung dịch CuSO4.
(c) Điện phân nóng chảy NaCl
(e) Cho AgNO3 dư vào dung dịch FeCl2.
(f) Nung nóng hỗn hợp chứa CuO, Ca và Fe(OH)3
(g) Cho luồng khí NH3 qua CuO nung nóng.
Hai kim loại thường được điều chế bằng cách điện phân muối clorua nóng chảy là
Hai kim loại thường được điều chế bằng cách điện phân muối clorua nóng chảy là Mg, Na.
Đáp án C
Cho dãy các chất: etilen, stiren, phenol, axit acrylic, etyl axetat, anilin. Số chất làm mất màu dung dịch brom ở điều kiện thường là
etilen, stiren, phenol, axit acrylic, anilin.
Trong phân tử isopren có bao nhiêu liên kết xích ma?
Trong phân tử isopren có 12 liên kết xích ma
Đáp án B
Chất nào sau đây không hòa tan Cu(OH)2 ở nhiệt độ thường
Tinh bột không hòa tan Cu(OH)2 ở nhiệt độ thường
Đáp án B
Dung dịch làm quỳ tím chuyển sang màu xanh là:
Dung dịch làm quỳ tím chuyển sang màu xanh là metylamin.
Đáp án D
Tiến hành thí nghiệm như hình vẽ bên :
.png)
Sau một thời gian thì ở ống nghiệm chứa dung dịch Cu(NO3)2 quan sát thấy :
Hiện tượng phản ứng: Zn + S → ZnS .
ZnS + H2SO4 → H2S + ZnSO4.
Khí H2S sỉnh ra dẫn qua dung dịch Cu(NO3)2 xảy ra phản ứng:
H2S + Cu(NO3)2 → CuS + HNO3.
Sau phản ứng sinh ra kết tủa CuS màu đen.
Chất nào sau đây không thể tạo ra C2H5OH bằng một phản ứng hóa học?
CH3COOH không thể tạo ra C2H5OH bằng một phản ứng hóa học
Đáp án B
Nguyên tử Y có số e là 15 và số n là 16. Số khối là
Nguyên tử Y có số e là 15 và số n là 16. Số khối là 31
Đáp án A
Hỗn hợp X gồm 2 axit cacboxylic no, mạch hở X và Y (My < Mz). Đốt cháy hoàn toàn a mol X thu được a mol H2O. Mặt khác, a mol X td với lượng dư NaHCO3 thu được 1,6a mol. Thành phần % theo khối lượng Y trong X là:
Số nguyên tử H trong axit là số chẵn mà a mol X khi cháy tạo a mol H2O chứng tỏ trong các chất Y, Z mỗi phân tử chỉ có 2 nguyên tử H: Y là HCOOH; Z là HOOC-COOH
Ta có nZ = 1,6a - a = 0,6a; nY = 0,4a
→ %mY = (46.0,4a) : (46.0,4a + 90.0,6a) = 25,41%
Cho y gam kim loại M vào dung dịch Fe2(SO4)3, sau phản ứng khối lượng phần dung dịch tăng thêm y gam. Kim loại M là
Muốn cho khối lượng tăng y gam → chứng tỏ không sinh ra chất khí cũng không sinh ra chất kết tủa → chỉ có Cu thoả mãn:
Cu + 2Fe3+ → 2Fe2+ + Cu
Nhận thấy Ag không tham gia phản ứng với Fe3+ → loại D
Loại Ba vì sinh H2, BaSO4, Fe(OH)3 → khối lượng dung dịch giảm
Đáp án A.
Tơ nilon -6,6 thuộc loại:
Tơ nilon -6,6 thuộc loại tơ tổng hợp.
Đáp án D
Phát biểu nào sau đây sai?
Thạch cao sống có công thức là CaSO4.2H2O
Khi trời sấm chớp mưa rào, trong không trung xảy ra các phản ứng hóa học ở điều kiện nhiệt độ cao có tia lửa điện, tạo thành các sản phẩm theo nước mưa rơi xuống, cung cấp chất dinh dưỡng cho cây trồng có tác dụng như một loại phân bón nào dưới đây?
Khi có sấm chớp sẽ xảy ra phản ứng:
N2 + O2 → 2NO
Sau đó : 4NO + 3O2 + 2H2O → 4HNO3
→ theo nước mưa rơi xuống hòa với các ion trong đất tạo phân nitrat cung cấp cho cây trồng
Cho m gam Fe phản ứng hoàn toàn với dung dịch HNO3 loãng (dư), thu được 4,48 lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của m là
N+5 + 3e → N+2
0,6 ← 0,2
Fe0 → Fe+3 + 3e
0,2 ← 0,6
→ mFe = 0,2.56 = 11,2 gam
Đáp án A
Chất nào sau đây thuộc loại đisaccarit?
Saccarozơ thuộc loại đisaccarit
Đáp án A
Cho các phát biểu sau:
- Glixerol, glucozơ, alanin là những hợp chất đa chứa.
- Amino axit, amin là những hợp chất có nhóm -NH2.
- Đốt cháy este no thu được số mol CO2 bằng số mol H2O.
- PE, PVC được dùng làm chất dẻo.
Số phát biểu đúng là:
- PE, PVC được dùng làm chất dẻo.
Cho hỗn hợp X gồm Fe, Cu, Fe2O3 và CuO vào 70 ml dung dịch HCl 1M, thu được dung dịch Y và hỗn hợp kim loại Z. Cho Y tác dụng hết với KOH dư, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi được m gam chất rắn. Giá trị của m là
Còn kim loại → đồng dư
Trong dung dịch có Fe2+ x mol ;Cu2+ y mol ; Cl-: 0,07 mol
Bảo toàn điện tích x+y = 0,035
m chất rắn = mFe2O3 + mCuO = x/2 *160 +y*80 =(x+y)*80 = 2,8
Cho các chất: Na2O, CO2, NO2, Cl2, CuO, CrO3, CO, NaCl. Số chất tác dụng với dung dịch NaOH loãng, dư ở điều kiện thường là
Na2O, CO2, NO2, Cl2, CrO3
Công thức phân tử của triolein là
Công thức phân tử của triolein là C57H104O6.
Đáp án B
Trường hợp không xảy ra phản ứng hóa học là
FeCl2 + H2S → FeS + 2HCl.
Đáp án B
Hiđrat hóa anken X (chất khí ở điều kiện thường) thu được ancol Y. Cho a mol Y phản ứng với Na dư, thu được 0,5a mol H2. Z là đồng phân cùng nhóm chức của Y và liên hệ với Y theo sơ đồ: Z → T → Y (mỗi mũi tên là một phản ứng). Tên thay thế của X, Z lần lượt là
Tên thay thế của X, Z lần lượt là but-2-en, butan-1-ol.
Đáp án B
Tiến hành phản ứng nhiệt nhôm hỗn hợp rắn X gồm Al, FeO và Fe2O3 ( trong điều kiện không có không khí) thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau.
+ Cho phần một vào dung dịch NaOH dư, thu được 0,45 mol H2 và còn m gam chất rắn không tan.
+ Cho phần hai vào dung dịch HNO3 dư, thu được 0,7 mol NO ( sản phẩm khử duy nhất).
Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
Các phản ứng xảy ra hoàn toàn. Hỗn hợp rắn Y + NaOH thấy có H2 thoát ra → Al dư sau phản ứng nhiệt nhôm
Vậy hỗn hợp Y gồm Al2O3, Fe và Al dư
Phần 1: Bảo toàn e → nAl dư = 2/3nH2 = 2/3. 0,45 = 0,3 (mol)
Phần 2: Bảo toàn e: 3nFe + 3nAl dư = 3nNO → nFe = (3.0,7 – 3.0,3)/3 = 0,4 (mol)
→ m = mFe = 0,4. 56 = 22,4 (g)
Thủy phân hoàn toàn y gam este đơn chức, mạch hở X bằng dung dịch NaOH, thu được z gam muối. Biết X có tỉ khối hơi so với metan bằng 6,25 và y < z. Số đồng phân cấu tạo của X là
Số đồng phân cấu tạo của X là 3
Đáp án B
Hỗn hợp X gồm hai chất hữu cơ no, đơn chức, mạch hở phản ứng vừa đủ với a mol KOH, thu được hai muối và b mol ancol (a > b). Hỗn hợp X gồm
Hỗn hợp X gồm hai chất hữu cơ no, đơn chức, mạch hở phản ứng vừa đủ với a mol KOH, thu được hai muối và b mol ancol (a > b). Hỗn hợp X gồm axit và este.
Đáp án A
Hòa tan 3,82 gam hỗn hợp X gồm NaH2PO4, Na2HPO4 và Na3PO4 vào nước dư thu được dung dịch Y. Trung hòa hoàn toàn Y cần 50 ml dung dịch KOH 1M, thu được dung dịch Z. Khối lượng kết tủa thu được khi cho Z tác dụng hết với dung dịch AgNO3 dư là
Gọi số mol NaH2PO4, Na2HPO4 và Na3PO4 lần lượt là x, y, z mol
→ 120x+ 142y + 164z= 3,82 (*1)
Trung hòa Y bằng dung dịch KOH:
H2PO4-+ 2OH- → PO43-+ 2H2O (1)
x 2x x mol
HPO42-+ OH- → PO43-+ H2O (2)
y y y mol
Theo PT (1) và (2) ta có nOH-= 2x+ y= 0,05 mol (*2)
Nhân cả 2 vế của (*2) với 22 ta có 44x + 22y= 1,1 gam (*3)
Công theo vế của (*1) với (*3|) ta có: 164x +164y + 164 z= 1,1+ 3,82=4,92
→ x + y +z= 0,03 mol
Tổng số mol PO43- có trong dung dịch Z là x+ y+z (mol)
3Ag++ PO43- → Ag3PO4 ↓ (3)
Theo PT (3) ta có nAg3PO4= nPO4(3-)= x+ y+z= 0,03 mol
→ mAg3PO4= 0,03.419= 12,57 gam
Cho các phương trình phản ứng:
(1) KMnO4 + HCl đặc →
(2) Hg + S →
(3) F2 + H2O →
(4) NH4Cl + NaNO2 →
(5) Ca + H2O →
(6) H2S + O2 dư →
(7) SO2 + dung dịch Br2 →
(8) Mg + dung dịch HCl →
Trong các phản ứng trên, số phản ứng tạo đơn chất là
(1) KMnO4 + HCl đặc →
(3) F2 + H2O →
(4) NH4Cl + NaNO2 →
(5) Ca + H2O →
(8) Mg + dung dịch HCl →
Tiến hành các thí nghiệm sau:
(a) Cho dung dịch AgNO3 vào dung dịch HBr.
(b) Cho Al2O3 vào dung dịch NaOH loãng dư.
(c) Cho Cu vào dung dịch H2SO4 đặc, nóng dư.
(d) Cho Ba(OH)2 vào dung dịch NaHCO3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là
(a) Cho dung dịch AgNO3 vào dung dịch HBr.
(d) Cho Ba(OH)2 vào dung dịch NaHCO3.
Cho các chất X, Y, Z, T thỏa mãn bảng sau :
X, Y, Z, T lần lượt là CH3COOH, HCOOCH3 , glucozơ, phenol.
Đáp án B
Nhỏ từ từ dung dịch Ba(OH)2 0,2M vào ống nghiệm chứa dung dịch Al2(SO4)3. Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo thể tích dung dịch Ba(OH)2 như sau:
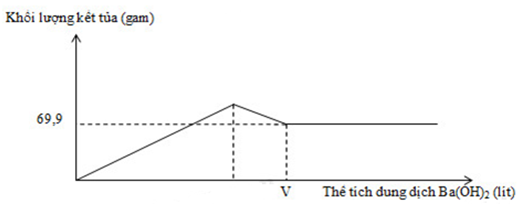
Giá trị của V gần nhất với giá trị nào sau đây?
Giải thích các quá trình biến thiên trong đồ thị:
Đoạn 1: Đi lên, do sự tạo thành BaSO4 và Al(OH)3
Đoạn 2: Đi xuống, do sự hòa tan kết tủa Al(OH)3
Đoạn 3: Đi ngang, do BaSO4 không tan.
Từ đồ thị ta thấy giá trị m = 69,9 gam không đổi khi thể tích Ba(OH)2 thay đổi
→ m↓ = mBaSO4 = 69,9 (gam) → nBaSO4 = 69,9 : 233 = 0,3 (mol)
nAl2(SO4)3 = 1/3 nBaSO4 = 0,1 (mol)
→ nAl3+ = 2nAl2(SO4)3 = 2. 0,1 = 0,2 (mol)
Theo công thức tính nhanh, xuất hiện kết tủa, sau đó kết tủa tan: nOH- = 4nAl3+ - n↓
→ 0,4V = 4.0,2 – 0
→ V = 2 (lít)
Gần nhất với 2,1 lít
Cho hỗn hợp X gồm 0,5 mol C2H5OH và 0,7 mol C3H7OH dẫn qua H2SO4 đặc nóng thu được m gam hỗn hợp Y gồm các ete và anken. Cho Y vào dung dịch brom dư thì thấy có 1 mol Br2 đã tham gia phản ứng. Giá trị của m là:
Ta có: Ancol → Anken + H2O
2 Ancol → Ete + H2O
Ta có: nBr2 = n anken = nH2O (tạo anken) = 1 mol
→ n ancol (tạo anken) = 1 mol → n ancol (tạo ete) = n ancol bđ - n ancol (tạo anken) = (0,5 + 0,7) - 1 = 0,2 mol
→ nH2O (tạo ete) = 0,5.n ancol (tạo ete) = 0,1 mol
BTKL → m ancol = mete + anken + mH2O
→ 0,5.46 + 0,7.60 = mete + anken + 18(1 + 0,1)
→ mete + anken = 45,2 gam
Cho các phát biểu sau:
- Các chất C2H5OH, CH3OH, C2H6, CH3CHO đều tạo ra trực tiếp CH3COOH bằng một phản ứng.
- Anilin, phenol, toluen đều tác dụng với dung dịch brom.
- Anđehit fomic, axetilen, glucozơ đều tham gia phản ứng với dung dịch AgNO3/NH3.
- Các peptit đều tham gia phản ứng với Cu(OH)2.
- Tất cả các dung dịch amin bậc I làm quỳ tím ngả thành màu xanh.
Số phát biểu đúng là:
Anđehit fomic, axetilen, glucozơ đều tham gia phản ứng với dung dịch AgNO3/NH3.
Cho các phát biểu sau:
(a) Để xử lí thủy ngân rơi vãi, người ta có thể dùng bột lưu huỳnh.
(b) Khi thoát vào khí quyển, freon phá hủy tầng ozon.
(c) Trong khí quyển, nồng độ CO2 vượt quá tiêu chuẩn cho phép gây ra hiệu ứng nhà kính.
(d) Trong khí quyển, nồng độ NO2 và SO2 vượt quá tiêu chuẩn cho phép gây ra hiện tượng mưa axit.
(e) Có thể dùng phèn chua để sát trùng, khử độc.
(f) Muối K2SO4 được dùng làm phân bón cho cây trồng.
(g) Điều chế phân bón amophot từ amoniac và axit photphoric.
Trong các phát biểu trên, số phát biểu đúng là
(a) Để xử lí thủy ngân rơi vãi, người ta có thể dùng bột lưu huỳnh.
(b) Khi thoát vào khí quyển, freon phá hủy tầng ozon.
(c) Trong khí quyển, nồng độ CO2 vượt quá tiêu chuẩn cho phép gây ra hiệu ứng nhà kính.
(d) Trong khí quyển, nồng độ NO2 và SO2 vượt quá tiêu chuẩn cho phép gây ra hiện tượng mưa axit.
(f) Muối K2SO4 được dùng làm phân bón cho cây trồng.
(g) Điều chế phân bón amophot từ amoniac và axit photphoric.
Hỗn hợp X gồm 3 chất hữu cơ có cùng số mol, đều đơn chức (chứa 3 loại nhóm chức khác nhau), mạch hở và có công thức phân tử là CH2O2, C2H4O2, C3H2O. Số mol AgNO3 phản ứng tối đa với 0,3 mol X trong dung dịch NH3 là
Để X tác dụng với nhiều AgNO3/NH3 nhất thì ta lựa chọn các cấu tạo của X gồm:
HCOOH: 0,1 mol
HCOOCH3: 0,1 mol
CH≡C-CHO: 0,1 mol
→ nAgNO3 = 0,1.2 + 0,1.2 + 0,1.3 = 0,7

