Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Đào Duy Từ
Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Đào Duy Từ
-
Hocon247
-
40 câu hỏi
-
90 phút
-
29 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Cho dãy các chất: metan, etin, eten, etanol, etanoic, propenoic, benzen, alanin, phenol, triolein. Số chất trong dãy làm mất màu dung dịch brom là
Số chất trong dãy làm mất màu dung dịch brom là 5
Có bốn kim loại Na, Al, Fe, Cu. Thứ tự tính khử giảm dần là
Thứ tự tính khử giảm dần là Na, Al, Fe, Cu
Có bao nhiêu hợp chất đơn chức có công thức phân tử C3H6O2 mà không phải là este?
Có 1 hợp chất đơn chức có công thức phân tử C3H6O2 mà không phải là este
Có ba lọ đựng riêng biệt ba dung dịch: lysin, valin, axit glutamic. Có thể nhận biết ba dung dịch bằng
Có thể nhận biết ba dung dịch bằng quỳ tím
Xà phòng hóa hoàn toàn 7,4 gam HCOOC2H5 bằng một lượng dung dịch KOH vừa đủ. Cô cạn dung dịch sau phản ứng, thu được m gam muối khan. Giá trị của m là
Giá trị của m là 8,4
Đốt cháy hoàn toàn hỗn hợp X gồm các chất có công thức phân tử CH2O, CH2O2, C2H2O2 đều có cấu tạo mạch hở và có số mol bằng nhau thu được CO2, H2O. Hấp thụ hết sản phẩm cháy bằng nước vôi trong dư, sau phản ứng thấy khối lượng dung dịch giảm 17,0 gam so với khối lượng nước vôi trong ban đầu. Cho lượng hỗn hợp X như trên tác dụng với lượng dư dung dịch AgNO3 trong NH3 thì thu được tối đa m gam Ag. Giá trị của m là:
Đáp án D
Vì 3 chất có số mol bằng nhau nên xem hh chỉ chứa 1 chất là \({C_{\frac{4}{3}}}{H_2}{O_{\frac{5}{3}}}:a\left( {mol} \right)\)
Ta có: mDung dịch giảm = mCaCO3 – mCO2 – mH2O.
Û 17 = ×100 – ×44 – 18a ⇔ a = 0,3.
⇒ nHCHO = nHCOOH = n(CHO)2 = 0,3÷3 = 0,1 mol.
⇒ ∑nAg = 0,1×(4 + 2 + 4) = 1 mol ⇒ mAg = 108 gam
Hỗn hợp M gồm một peptit X và một peptit Y (mỗi peptit được cấu tạo từ một loại amino axit, tổng số nhóm -CO-NH- trong hai phân tử X và Y là 5) với tỉ lệ số mol nX : nY = 1:3. Khi thủy phân hoàn toàn m gam M thu được 81 gam glyxin và 42,72 gam alanin. m có giá trị là
Đáp án C
biến đổi M về 1 peptit mạch dài: 1X + 3Y → 1Z + 3H2O.
Lại có: thủy phân Z cho 1,08 mol Gly + 0,48 mol Ala. Tỉ lệ ngly ÷ nala = 9 ÷ 4.
∑liên kết peptit = 5 nên tối đa α-amino axit cần để tạo Z là 1 × (1 + 1) + 3 × (4 + 1) = 17.
||→ tạo 1 mol Z là từ 9 mol Gly + 4Ala – 12H2O (nếu 18 + 6 thì > 17 rồi).
Kết hợp lại: 1X + 3Y → 9Gly + 4Ala – 9H2O ||→ nH2O = 1,08 mol
||→ BTKL có mM = mX + mY = 81 + 42,72 – 1,08 × 18 = 104,28 gam.
Cho các phát biểu sau:
(a) Các kim loại Na, K, và Al đều phản ứng mạnh với nước;
(b) Dung dịch muối Fe(NO3)2 tác dụng được với dung dịch HCl;
(c) P cháy trong Cl2 có thể tạo thành PCl3 và PCl5;
(d) Than chì được dùng làm điện cực, chế tạo chất bôi trơn, làm bút chì đen;
(e) Hỗn hợp Al và NaOH (tỉ lệ số mol tương ứng 1 : 1) tan hoàn toàn trong nước dư;
(g) Người ta không dùng CO2 để dập tắt đám cháy magie hoặc nhôm.
Số phát biểu đúng là
Số phát biểu đúng là 5
Sục từ từ khí CO2 đến dư vào dung dịch chứa Ca(OH)2 và NaAlO2 (hay Na[Al(OH)4]). Khối lượng kết tủa thu sau phản ứng được biểu diễn trên đồ thị như hình vẽ:
Giá trị của m và x lần lượt là
Đáp án A
Đặt số mol Ca(OH)2 = a và nNaAlO2 = b ta có phản ứng:
Ca(OH)2 + CO2 → CaCO3↓ + H2O.
NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
Sau khi CO2 dư vào ⇒ CaCO3 + CO2 + H2 → Ca(HCO3)2
nAl(OH)3 = 27,3 ÷ 78 = b = 0,35 mol.
⇒ nCa(OH)2 = 0,74 – 0,35 = 0,39 mol.
⇒ m = 0,39×100 + 27,3 = 66,3 gam Và x = 0,39 + 0,35 + 0,39 = 1,13 mol
Cho các phát biểu sau:
(1) Ở người, nồng độ glucozơ trong máu được giữ ổn định ở mức 0,1%.
(2) Oxi hóa hoàn toàn glucozơ bằng hiđro (xúc tác Ni, to) thu được sobitol.
(3) Tơ xenlulozơ axetat thuộc loại tơ tổng hợp.
(4) Thủy phân este đơn chức trong môi trường bazơ luôn cho sản phẩm là muối và ancol.
(5) Số nguyên tử N có trong phân tử đipeptit Glu–Lys là 2.
(6)Tất cả các peptit đều có phản ứng màu biure.
Số phát biểu đúng là
Số phát biểu đúng là 2
Điện phân 200 ml dung dịch gồm CuSO4 1,0 M và NaCl a M (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) với cường độ dòng điện không đổi 2A trong thời gian 14475 giây. Dung dịch thu được có khối lượng giảm 14,75 gam so với dung dịch ban đầu. Giá trị của a là
Đáp án D
∑ne trao đổi = 0,3 mol < 2nCu2+.
⇒ Cu chưa bị điện phân hết và khí thoát ra là Cl2 và có thể có cả O2.
Nếu chỉ có khí Cl2 ⇒ Quy đổi mDung dịch giảm = mCuCl2 = 0,15×135 = 20,25 ≠ 14,75 ⇒ Loại.
+ Vậy có cả O2 thoát ra ⇒ mDung dịch giảm = mCuCl2 + mCuO.
+ Đặt số mol 2 chất lần lượt là a và b ta có:
a + b = 0,15 mol (PT bảo toàn Cu).
135a + 80b = 14,75 (PT theo m dung dịch giảm).
+ Giải hệ ⇒ a = nCuCl2 = 0,05 mol ⇒ nNaCl = 0,05×2 = 0,1 mol.
⇒ CM NaCl = 0,1/0,2 = 0,5M
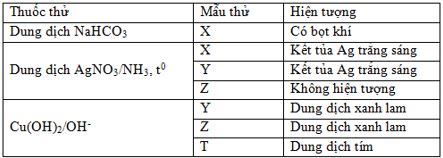
Kết quả thí nghiệm của các chất X, Y, Z, T (dạng dung dịch) với thuốc thử được ghi ở bảng sau:
Các chất X, Y, Z, T lần lượt là
Các chất X, Y, Z, T lần lượt là axit fomic, glucozơ, glixerol, Lys-Val-Ala.
Thời gian trước đây, theo kinh nghiệm thâm canh lúa nước, sau mỗi vụ mùa vụ, nhà nông thường hay đốt đồng (đốt gốc rạ còn lại trên đồng lúa sau thu hoạch). Theo cách thức canh tác đó, việc đồng giúp
Theo cách thức canh tác đó, việc đồng giúp cung cấp thêm cho cánh đồng ở mùa vụ sau một lượng kali dưới dạng K2CO3.
Hòa tan hoàn toàn m gam hỗn hợp X gồm Mg , Fe, FeCO3, Cu(NO3)2 vào dung dịch chứa NaNO3 0,045 mol và H2SO4, thu được dung dịch Y chỉ chứa các muối trung hòa có khối lượng là 62,605 gam (không chứa ion Fe3+) và 3,808 lít (đktc) hỗn hợp khí Z (trong đó có 0,02 mol H2). Tỉ khối của Z so với O2 bằng 19/17. Thêm tiếp dung dịch NaOH 1 M vào Y đến khi thu được lượng kết tủa lớn nhất là 31,72 gam thì vừa hết 865 ml. Mặt khác, thêm dung dịch BaCl2 vừa đủ vào dung dịch Y, lọc bỏ kết tủa được dung dịch G, sau đó cho thêm lượng dư AgNO3 vào G thu được 150,025 gam kết tủa. Giá trị của m là
Trong B đặt MgSO4; FeSO4, CuSO4 và (NH4)2SO4 lần lượt là a, b, c, d mol
Ta có nNa2SO4 trong B = 0,0225
⇒ 120a + 152b + 160c + 132d + 0,0225 × 142 = 62,605
nNaOH = 2a + 2b + 2c + 2d = 0,865
m↓ = 58a + 90b + 98c = 31,72
Sau phản ứng đó là Na2SO4 ⇒ nNa2SO4=0,4325+0,0225=0,455
nBaCl2=0,455nBaCl2=0,455 ⇒ Vừa đủ để tạo ra nBaSO4=0,455
Sau đó thêm tiếp AgNO3 dư ⇒ Tạo thêm nAgCl = 0,455 × 2 = 0,91 và nAg = nFe2+ = b
⇒ m↓ = 108b + 0,91 × 143,5 + 0,455 × 233 = 256,04
Giải hệ trên:
a = 0,2
b = 0,18
c = 0,04
d = 0,0125
Như trên đã có H2SO4=nNa2SO4 tổng = 0,455
Bảo toàn H:
2nH2SO4=8n(NH4)2SO4+2nH2+2nH2O⇒nH2O=0,385 mol
Bảo toàn khối lượng:
mA+mNaNO3+mH2SO4=mmuoi+mkhi+mH2O
⇒ mA = 27,2 gam
X, Y (MX < MY) là hai axit kế tiếp thuộc cùng dãy đồng đẳng axit fomic; Z là este hai chức tạo bởi X, Y và ancol T. Đốt cháy 25,04 gam hỗn hợp E chứa X, Y, Z, T (đều mạch hở) cần dùng 16,576 lít O2(đktc) thu được 14,4 gam nước. Mặt khác, đun nóng 12,52 gam E cần dùng 380 ml dung dịch NaOH 0,5M. Biết rằng ở điều kiện thường, ancol T không tác dụng được với Cu(OH)2. Phần trăm khối lượng của X có trong hỗn hợp E gần nhất với:
Đáp án D
Bảo toàn khối lượng khi đốt E ⇒ mCO2 = 34,32 gam ⇒ nCO2 = 0,78 mol < nH2O.
⇒ Ancol T thuộc loại no 2 chức mạch hở.
Ta có sơ đồ: \(\underbrace {\left\{ \begin{gathered} {C_n}{H_{2m}}{O_2}:a \hfill \\ {C_m}{H_{2m - 2}}{O_4}:b \hfill \\ {C_x}{H_{2x}}{O_2}:c \hfill \\ \end{gathered} \right.}_{25,04g}\,\,\, + \,\,\,\underbrace {{O_2}}_{0,74\left( {mol} \right)} \to \left\{ \begin{gathered} C{O_2}:0,78\left( {mol} \right) \hfill \\ {H_2}O:0,8\left( {mol} \right) \hfill \\ \end{gathered} \right.\)
+ PT bảo toàn oxi: 2a + 4b + 2c = 0,88 (1).
+ PT theo nH2O – nCO2: –b + c = 0,02 (2).
+ PT theo số mol NaOH pứ: a + 2b = 0,38 (3).
+ Giải hệ (1) (2) và (3) ta có: a = 0,3, b = 0,04 và c = 0,06 mol.
⇒ nHỗn hợp = 0,4 mol ⇒ CTrung bình = 1,95 ⇒ 2 Axit là HCOOH và CH3COOH.
⇒ Hỗn hợp ban đầu gồm: \(\left\{ \begin{gathered} {C_n}{H_{2m}}{O_2}:0,3 \hfill \\ {C_m}{H_{2m - 2}}{O_4}:0,04 \hfill \\ {C_x}{H_{2x}}{O_2}:0,06 \hfill \\ \end{gathered} \right.\)
⇒ PT theo khối lượng hỗn hợp:
0,3(14n+32) + 0,04.[12(x+3) + 2x+4 + 64)] + 0,06.(14x + 34) = 25,04.
Û 4,2n + 1,4x = 9,24 [Với 1 < n < 2 ⇒ 0,6 < x < 3,6].
+ Vì Ancol T không hòa tan Cu(OH)2 ⇒ T là HO–[CH2]3–OH với x = 3.
⇒ n = 1,2 ⇒ nHCOOH = 0,3×(1–0,2) = 0,24 mol ⇒ %mHCOOH = \(\frac{{0,24.46}}{{25,04}} = 44,01\) %
Đốt cháy hoàn toàn hỗn hợp X gồm 4 hợp chất hữu cơ: axit acrylic (CH2=CH–COOH), metyl metacrylat (CH2=C(CH3)–COOCH3), vinyl axetat (CH2=CH–OOCCH3) và đimetyl oxalat (CH3OOC–COOCH3) rồi dẫn toàn bộ sản phẩm cháy qua bình 1 chứa H2SO4 đặc, dư; bình 2 đựng dd Ba(OH)2 dư. Kết thúc thí nghiệm thấy bình 1 tăng m gam, bình 2 thu được 98,5 gam kết tủa. Giá trị của m là
Đáp án B
4 chất có trong X có CTPT lần lượt là:
C3H4O2, C5H8O2, C4H6O2 và C4H6O4.
+ Ta có nCO2↑ = nBaCO3 = 0,5 mol.
● Giả sử hỗn hợp chỉ chứa C3H4O2⇒ C3H4O2 → 3CO2 + 2H2O
⇒ nH2O = \(\frac{{0,5.2}}{3} = \frac{1}{3}\) ⇒ mH2O = 6 gam.
● Giả sử hỗn hợp chỉ chứa C5H8O2 ⇒ C5H8O2 → 5CO2 + 4H2O
⇒ nH2O = \(\frac{{0,5.4}}{5} = 0,4\) ⇒ mH2O = 7,2 gam.
⇒ 6 < mH2O < 7,2
X, Y là 2 axit cacboxylic đều mạch hở; Z là ancol no; T là este hai chức, mạch hở được tạo bởi X, Y, Z. Đun nóng 38,86 gam hỗn hợp E chứa X, Y, Z, T với 400 ml dung dịch NaOH 1M (vừa đủ), thu được ancol Z và hỗn hợp F gồm 2 muối có tỉ lệ mol 1:1. Dẫn toàn bộ Z qua bình đựng Na dư thấy khối lượng bình tăng 19,24 gam; đồng thời thu được 5,824 lít khí H2 (đktc). Đốt cháy hoàn toàn F cần dùng 0,7 mol O2, thu được CO2, Na2CO3 và 0,4 mol H2O. Phần trăm khối lượng của T trong hỗn hợp E là:
Đáp án A
► Dễ thấy Z là ancol 2 chức ⇒ nZ = nH2 = 0,26 mol. Bảo toàn khối lượng:
mZ = mbình tăng + mH2 = 19,24 + 0,26 × 2 = 19,76(g) ⇒ MZ = 19,76 ÷ 0,26 = 76 (C3H8O2).
● Do T mạch hở ⇒ X và Y là axit đơn chức ⇒ nmuối X = nmuối Y = nNaOH ÷ 2 = 0,2 mol.
Bảo toàn nguyên tố Natri: nNa2CO3 = 0,2 mol. Bảo toàn nguyên tố Oxi: nCO2 = 0,6 mol.
► Gọi số C trong gốc hidrocacbon của 2 muối là x và y (x ≠ y; x, y Î N).
||⇒ 0,2x + 0,2y = 0,2 + 0,6. Giải phương trình nghiệm nguyên: x = 0; y = 2.
⇒ 1 muối là HCOONa. Bảo toàn nguyên tố Hidro: Hmuối còn lại = 3 ⇒ CH2=CHCOONa.
● Bảo toàn khối lượng: mH2O = 2,7(g) ⇒ ∑nX,Y = nH2O = 0,15 mol ⇒ nT = 0,125 mol.
T là (HCOO)(C2H3COO)C3H6 ||► %mT = 0,125 × 158 ÷ 38,86 × 100% = 50,82%
Kim loại không phản ứng được với nước ở nhiệt độ thường là
Kim loại không phản ứng được với nước ở nhiệt độ thường là Be
Thủy ngân dễ bay hơi và rất độc. Nếu chẳng may nhiệt kế thủy ngân bị vỡ thì dùng chất nào trong các chất sau để khử độc thủy ngân là
ếu chẳng may nhiệt kế thủy ngân bị vỡ thì dùng bột lưu huỳnh trong các chất sau để khử độc thủy ngân
Trong phân tử chất nào sau đây chứa nguyên tố nitơ ?
Metylamin chứa nguyên tố nitơ
Dãy gồm các chất đều không tham gia phản ứng tráng bạc là
Dãy gồm các chất đều không tham gia phản ứng tráng bạc là saccarozô, tinh bột, xenlulozô.
Dung dịch Ala-Gly phản ứng được với dung dịch nào sau đây?
Dung dịch Ala-Gly phản ứng được với dung dịch HCl
Trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố Fe (Z = 26) thuộc nhóm
Trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố Fe (Z = 26) thuộc nhóm VIIIB
Saccarozơ và glucozơ đều có phản ứng
Saccarozơ và glucozơ đều có phản ứng với Cu(OH)2 ở nhiệt độ thường, tạo thành dung dịch màu xanh lam.
Trong bảng tuần hoàn các nguyên tố hóa học, kim loại kiềm thổ thuộc nhóm?
Trong bảng tuần hoàn các nguyên tố hóa học, kim loại kiềm thổ thuộc nhóm IIA
Chất nào sau đây thuộc loại đisaccarit?
Chất thuộc loại đisaccarit là Saccarozơ
Dung dịch nào sau đây phản ứng được với dung dịch CaCl2 ?
Dung dịch Na2CO3 phản ứng được với dung dịch CaCl2
Thạch cao nung được dùng để nặn tượng, đúc khuôn và bó bột khi gãy xương. Công thức của thạch cao nung là
Thạch cao nung được dùng để nặn tượng, đúc khuôn và bó bột khi gãy xương. Công thức của thạch cao nung là CaSO4.H2O.
Ở nhiệt độ cao, khí CO khử được oxit nào sau đây ?
Ở nhiệt độ cao, khí CO khử được oxit Fe2O3
Tiến hành bốn thí nghiệm sau:
- Thí nghiệm 1: Nhúng thanh Fe vào dung dịch FeCl3;
- Thí nghiệm 2: Nhúng thanh Fe vào dung dịch CuSO4;
- Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3;
- Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl. Số trường hợp xuất hiện ăn mòn điện hoá là
Số trường hợp xuất hiện ăn mòn điện hoá là 2
Thành phần chính của quặng boxit là
Thành phần chính của quặng boxit là Al2O3.2H2O
Ở điều kiện thường, kim loại có độ cứng lớn nhất là
Ở điều kiện thường, kim loại có độ cứng lớn nhất là Cr
Chất nào sau đây không tham gia phản ứng trùng hợp?
CH3 – CH3 không tham gia phản ứng trùng hợp
Trong các hợp chất, nguyên tố nhôm có số oxi hóa là
Trong các hợp chất, nguyên tố nhôm có số oxi hóa là +3
Phản ứng nào sau đây không tạo ra muối sắt (III)?
Phản ứng không tạo ra muối sắt (III): Fe tác dụng với dung dịch HCl
Cho 24,4 gam hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau phản ứng thu được 39,4 gam kết tủa. Lọc tách kết tủa, cô cạn dung dịch thu được m gam muối clorua. m có giá trị là
nBaCl2=nBaCO3=0,2(mol)
Áp dụng định luật bảo toàn khối lượng: m hh + mbaCl2 =mkết tủa + m
Þ m = 24,4 + 0,2 . 208 – 39,4 = 26,6 gam
Đáp án C
Cho các chất sau: glucozơ, axetilen, saccarozơ, anđehit axetic, but-2-in, etyl fomat. Số chất khi tác dụng với dung dịch AgNO3 (NH3, to) cho kết tủa là
Số chất khi tác dụng với dung dịch AgNO3 (NH3, to) cho kết tủa là 5
Cho dãy các chất: Al2O3, KOH, Al(OH)3, CaO. Số chất trong dãy tác dụng với H2O là
Số chất trong dãy tác dụng với H2O là 1
Nhúng giấy quỳ tím vào dung dịch metylamin, màu quỳ tím chuyển thành ?
Nhúng giấy quỳ tím vào dung dịch metylamin, màu quỳ tím chuyển thành xanh
Gốc glucozơ và gốc fructozơ trong phân tử saccarozơ liên kết với nhau qua nguyên tử?
Gốc glucozơ và gốc fructozơ trong phân tử saccarozơ liên kết với nhau qua nguyên tử oxi

.JPG)