Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Hà Huy Tập
Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Hà Huy Tập
-
Hocon247
-
40 câu hỏi
-
90 phút
-
71 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Cho từng chất : Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc, nóng. Số phản ứng hóa học thuộc loại phản ứng oxi hoá - khử?
Số phản ứng hóa học thuộc loại phản ứng oxi hoá - khử là 7
Nung m gam hỗn hợp X gồm Fe, Fe(NO3)2, Fe(NO3)3 và FeCO3 trong bình kín (không có không khí). Sau khi các phản ứng xảy ra hoàn toàn, thu được chất rắn Y và khí Z có tỉ khối so với H2 là 22,5 (giả sử khí NO2 sinh ra không tham gia phản ứng nào khác). Cho Y tan hoàn toàn trong dung dịch kiềm 0,01 mol KNO3 và 0,15 mol H2SO4 (loãng), thu được dung dịch chỉ chứa 21,23 gam muối trung hòa của kim loại và hỗn hợp 2 khí có tỉ khối so với H2 là 8 (trong đó có một khí hóa nâu trong không khí). Giá trị của m là
Khi nung X: \(\left\{ \begin{gathered} {\text{2NO}}_3^ - {\text{ }}\xrightarrow{{{{\text{t}}^0}}}{\text{ 2N}}{{\text{O}}_{\text{2}}}{\text{ + }}\frac{1}{2}{{\text{O}}_{\text{2}}}{\text{ + O}}_{{\text{oxit}}}^{2 - } \hfill \\ {\text{x x x/4 x/2}} \hfill \\ {\text{CO}}_3^{2 - }{\text{ }}\xrightarrow{{{{\text{t}}^0}}}{\text{ C}}{{\text{O}}_{\text{2}}}{\text{ + O}}_{{\text{oxit}}}^{2 - } \hfill \\ {\text{x x x }} \hfill \\ \end{gathered} \right.{\text{ }}\)
Giả sử hỗn hợp khí Z gồm có NO2 (46) và CO2 (44), lượng khí O2 sinh ra (x/4 mol) phản ứng hết với Fe và FeO.
- Dùng quy tắc được chéo tính nhanh được \({{\text{n}}_{{\text{N}}{{\text{O}}_{\text{2}}}}}{\text{ = }}{{\text{n}}_{{\text{C}}{{\text{O}}_{\text{2}}}}}{\text{ = x (mol)}}\)
\(\underbrace {({\text{X}})\left\{ \begin{gathered} {\text{Fe}} \hfill \\ {\text{Fe(N}}{{\text{O}}_{\text{3}}}{{\text{)}}_{\text{2}}} \hfill \\ {\text{Fe(N}}{{\text{O}}_{\text{3}}}{{\text{)}}_{\text{3}}} \hfill \\ {\text{FeC}}{{\text{O}}_{\text{3}}}{\text{ }} \hfill \\ \end{gathered} \right.}_{{\text{m gam}}}{\text{ }}\xrightarrow{{{{\text{t}}^0}}}\left| \begin{gathered} ({\text{Z}})\left\{ \begin{gathered} {\text{C}}{{\text{O}}_{\text{2}}}{\text{ (x)}} \hfill \\ {\text{N}}{{\text{O}}_{\text{2}}}{\text{ (x) }} \hfill \\ \end{gathered} \right. \hfill \\ ({\text{Y}})\left\{ \begin{gathered} {\text{Fe}}{\text{, F}}{{\text{e}}^{2 + }}{\text{, F}}{{\text{e}}^{3 + }} \hfill \\ {{\text{O}}^{2 - }}{\text{ (2}}{\text{.}}\frac{{\text{x}}}{4}{\text{ + }}\frac{{\text{x}}}{2}{\text{ + x = 2x) }} \hfill \\ \end{gathered} \right.{\text{ + }}\left\{ \begin{gathered} {{\text{K}}^{\text{ + }}}{\text{ (0}}{\text{,01)}} \hfill \\ {\text{NO}}_3^ - {\text{ (0}}{\text{,01)}} \hfill \\ {{\text{H}}^ + }{\text{ (0}}{\text{,3)}} \hfill \\ {\text{SO}}_4^{2 - }{\text{ (0}}{\text{,15) }} \hfill \\ \end{gathered} \right.{\text{ }}\xrightarrow{{(2)}}\underbrace {\left\{ \begin{gathered} {{\text{K}}^{\text{ + }}}{\text{ (0}}{\text{,01)}} \hfill \\ {\text{SO}}_4^{2 - }{\text{ (0}}{\text{,15)}} \hfill \\ {\text{F}}{{\text{e}}^{{\text{n + }}}}{\text{ }} \hfill \\ \end{gathered} \right.}_{21,23{\text{ gam}}}{\text{ + hh T}}\left\{ \begin{gathered} {\text{NO (0}}{\text{,01)}} \hfill \\ {{\text{H}}_{\text{2}}}{\text{ (0}}{\text{,01) }} \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} \right.{\text{ }}\)
(MT = 16 ⇒ trong T có H2 ⇒ \({\text{NO}}_3^ - \) hết, \({{\text{n}}_{{\text{NO}}}}{\text{ = }}{{\text{n}}_{{\text{NO}}_3^ - }}{\text{ = 0}}{\text{,01}}\).
Dùng quy tắc đường chéo cho hỗn hợp T ta được \({{\text{n}}_{{\text{NO}}}}{\text{ = }}{{\text{n}}_{{{\text{H}}_2}}}{\text{ = 0}}{\text{,01}}\)
Nhận xét: \({\text{m = }}{{\text{m}}_{{\text{Fe}}}}{\text{ + }}{{\text{m}}_{{\text{NO}}_3^ - }}{\text{ + }}{{\text{m}}_{{\text{CO}}_3^{2 - }}}{\text{ }}\)
* Tính mFe = 21,32 – (0,01.39) – (0,15.96) = 6,44 (g) (nFe = 0,115)
Số mol ion H+ tham gia phản ứng (2): \({\text{m = }}{{\text{m}}_{{\text{Fe}}}}{\text{ + }}{{\text{m}}_{{\text{NO}}_3^ - }}{\text{ + }}{{\text{m}}_{{\text{CO}}_3^{2 - }}}{\text{ }}\)
( kiểm tra lại, nếu Fe chuyển hết thành Fe3+ thì mol O2- cần là (0,115.3):2 = 0,1725 > 0,12 ⇒ O2 hết (phù hợp với giả sử trên)
⇒ m = 6,44 + (0,06.62) + (0,06.60) = 13,76 (g)
⇒ Chọn D.
Cho m gam Mg vào dung dịch X gồm 0,03 mol Zn(NO3)2 và 0,05 mol Cu(NO3)2, sau một thời gian thu được 5,25 gam kim loại và dung dịch Y. Cho dung dịch NaOH vào dung dịch Y, khối lượng kết tủa lớn nhất thu được là
\({\text{Mg + }}\left\{ \begin{gathered} {\text{Z}}{{\text{n}}^{2 + }}{\text{ (0}}{\text{,03)}} \hfill \\ {\text{C}}{{\text{u}}^{2 + }}{\text{ (0}}{\text{,05)}} \hfill \\ {\text{NO}}_3^ - {\text{ (0}}{\text{,16)}} \hfill \\ \end{gathered} \right.{\text{ }}\xrightarrow{{(1)}}{\text{ 5}}{\text{,25 gam KL + }}\left\{ \begin{gathered} {{\text{M}}^{{\text{n + }}}}{\text{ }} \hfill \\ {\text{NO}}_3^ - {\text{ (0}}{\text{,16)}} \hfill \\ \end{gathered} \right.{\text{ + NaOH }}\xrightarrow{{(2)}}{\text{ 6}}{\text{,67 (gam)}} \downarrow \left\{ \begin{gathered} {{\text{M}}^{{\text{n + }}}}{\text{ }} \hfill \\ {\text{O}}{{\text{H}}^ - }{\text{ (0}}{\text{,16)}} \hfill \\ \end{gathered} \right.{\text{ }}\)
- Trong giai đoạn (2): có sự thay thế ion:
\(\begin{gathered} {\text{NO}}_3^ - {\text{ }}\xrightarrow{{}}{\text{ O}}{{\text{H}}^ - } \hfill \\ {\text{0}}{\text{,16 mol }} \to {\text{ 0}}{\text{,16 mol}} \hfill \\ \end{gathered} \)
- Khối lượng kim loại trong kết tủa: \({{\text{m}}_{{{\text{M}}^{{\text{n + }}}}}}{\text{ = 6}}{\text{,67 - (0}}{\text{,16}} \times {\text{17) = 3}}{\text{,95 gam}}\)
- Bảo toàn khối lượng kim loại trong giai đoạn (1): m + (0,03.65) + (0,05,64) = 5,25 + 3,95 →m = 4,05 (gam)
⇒ Chọn A.
Cho m gam hỗn hợp X gồm Fe, Fe3O4 và Fe(NO3)2 tan hết trong 320 ml dung dịch KHSO4 1M. Sau phản ứng, thu được dung dịch Y chứa 59,04 gam muối trung hòa và 896 ml NO (sản phẩm khử duy nhất của N+5, ở đktc). Y phản ứng vừa đủ với 0,44 mol NaOH. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe(NO3)2 trong X có giá trị gần nhất với giá trị nào sau đây?
giải
Gọi số mol Fe, Fe3O4, Fe(NO3)2 lần lượt là a, b, c
Theo BTKL: \(m = 59,04 + \underbrace {0,04\,\,.\,\,30}_{NO} + \underbrace {0,16\,.\,18}_{{H_2}O} - \underbrace {0,32\,\,.\,\,136}_{KHS{O_4}} = 19,6\,\,gam\)
Bảo toàn nguyên tố N: \({n_{NO_3^ - \,co{n}}} = {n_{NO_3^ - \,\,ban\,\,{\text{d}}a{u}}} - {n_{NO}} = 2c - 0,04\)
Bảo toàn điện tích cho dung dịch cuối cùng \(\underbrace {0,44}_{N{a^ + }} + \underbrace {0,32}_{{K^ + }} = \underbrace {2c - 0,04}_{NO_3^ - } + \underbrace {2\,\,.\,\,0,32}_{SO_4^{2 - }}\,\, \to c = 0,08\)
\(\to \% {m_{Fe{{(N{O_3})}_2}}} = \frac{{0,08\,\,.\,\,180}}{{19,6}}.100\% = 73,47\% \)
Hỗn hợp X gồm 3 este đơn chức, tạo thành từ cùng một ancol Y với 3 axit cacboxylic (phân tử chỉ có nhóm -COOH); trong đó, có hai axit no là đồng đẳng kế tiếp nhau và một axit không no (có đồng phân hình học, chứa một liên kết đôi C=C trong phân tử). Thủy phân hoàn toàn 5,88 gam X bằng dung dịch NaOH, thu được hỗn hợp muối và m gam ancol Y. Cho m gam Y vào bình đựng Na dư, sau phản ứng thu được 896 ml khí (đktc) và khối lượng bình tăng 2,48 gam. Mặt khác, nếu đốt cháy hoàn toàn 5,88 gam X thì thu được CO2 và 3,96 gam H2O. Phần trăm khối lượng của este không no trong X là:
-vì este đơn chức nên ancol cũng đơn chức, xác định được công thức của ancol là CH3OH
-ta có số mol của ancol = số mol este= 0,08 nên suy ra khối lượng của oxi là 2,56g
- ta tính được mC = 2,88 , số mol CO2 là =0,24
- tính số nguyên tử C trung bình = 3 ,biện luận tìm ctpt của este không no
Theo đề este không no, có đồng phân hình học nên công thức C3H5COOCH3 , có số mol là 0,02
- từ đó tính ra kết quả
Đốt cháy hoàn toàn 14,24 gam hỗn hợp X chứa 2 este đều no, đơn chức, mạch hở thu được CO2 và H2O có tổng khối lượng là 34,72 gam. Mặt khác đun nóng 14,24 gam X với dung dịch NaOH vừa đủ, thu được hỗn hợp Y chứa 2 ancol kế tiếp và hỗn hợp Z chứa 2 muối của 2 axit cacboxylic kế tiếp, trong đó có a gam muối A và b gam muối B (MA < MB). Tỉ lệ gần nhất của a : b
Khi đốt X chứa 2 este no, đơn chức, mạch hở thì ta luôn có: \({n_{C{O_2}}} = {n_{{H_2}O}} = 0,56\;mol\)
\(\xrightarrow{{BTKL}}{n_{{O_2}}} = \frac{{{m_{C{O_2} + {H_2}O}} - {m_X}}}{{32}} = 0,64\;mol\xrightarrow{{BT:\;O}}{n_X} = \frac{{2{n_{C{O_2}}} + {n_{{H_2}O}} - 2{n_{{O_2}}}}}{2} = 0,2\;mol\)
- Ta có: \({C_X} = \frac{{0,56}}{{0,2}} = 2,8\). Vì khi cho X tác dụng với NaOH thu được 2 ancol kế tiếp và 2 muối của 2 axit cacboxylic kế tiếp nên 2 este trong X lần lượt là\(\left\{ \begin{gathered} HCOOC{H_3}:x\;mol \hfill \\ C{H_3}COO{C_2}{H_5}:y\;mol \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered} x + y = 0,2 \hfill \\ 2x + 4y = 0,56 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered} x = 0,12 \hfill \\ y = 0,08 \hfill \\ \end{gathered} \right.\)
- Hỗn hợp muối Z gồm HCOONa (A): 0,12 mol và CH3COONa (B): 0,08 mol → a : b = 1,243
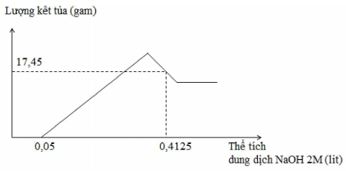
Hòa tan hoàn toàn m gam hỗn hợp Al và Mg trong V ml dung dịch HNO3 2,5 M. Kết thúc phản ứng thu được dung dịch X ( không chứa muối amoni) và 0,084 mol hỗn hợp khí gồm N2 và N2O có tỉ khối so với oxi là 31 : 24 . Cho từ từ dung dịch NaOH 2M vào dung dịch X thì lượng kết tủa biến thiên theo đồ thị hình vẽ dưới đây:
Giá trị của m và V lần lượt là:
Đặt mol Al = x(mol), mol Mg = y mol
Từ tỉ khối hơi dễ dàng tính được mol 2 khí : n N2 = 0,014 mol, n N2O = 0,07 mol
- Bte : 3x + 2y = 0,014 .10 + 0,07 .8 = 0,7 = n OH- khi kết tủa max => khi cho NaOH vào thì
- m kết tủa max= m kim loại + m OH- = m + 0,7.17= m +11,9 (1)
Nhin đồ thị => n HNO3 dư = 0,05 .2= 0,1 mol
n HNO3 = 2,5V = n HNO3 pu + n HNO3 dư = (0,7+ 0,014.4 + 0,07.2)+ 0,1=> V= 387,2ml
Chất hữu cơ X có công thức phân tử C2H8N2O3. Cho 3,24 gam X tác dụng với 500 ml
dung dịch KOH 0,1M. Sau khi kết thúc phản ứng thu được chất hữu cơ Y đơn chức và dung dịch Z. Cô cạn Z thu được khối lượng chất rắn ?
C2H8N2O3 (X) tác dụng với dung dịch KOH thu được chất hữu cơ Y đơn chức, chứng tỏ X là muối amoni tạo bởi NH3 hoặc amin đơn chức.Như vậy, gốc axit trong X có 1 nguyên tử N và 3 nguyên tử O, đó là NO3. Suy ra công thức cấu tạo của X là C2H5NH3NO3 (etylamoni nitrat) hoặc (CH3)2NH2NO3 (đimetylamoni nitrat).Theo bảo toàn nguyên tố gốc NO3và bảo toàn nguyên tố K, ta có :
Số mol của KNO3 =số mol của C2H5NH3NO3 (etylamoni nitrat) hoặc (CH3)2NH2NO3 = 0,03
Suy ra số mol KOH dư là 0,02
Tử đó tính được khối lượng chất rắn là 4,15
Trong các kim loại sau, kim loại nào dẫn điện kém nhất?
Fe dẫn điện kém nhất
Thành phần chính của quặng boxit là
Thành phần chính của quặng boxit là
Chất X là một khí rất độc, có trong thành phần của khí than khô (khoảng 25%). Xác định chất X?
X là CO
Lên men ancol etylic (xúc tác men giấm), thu được chất X dùng để làm giấm ăn. Tên gọi của X là gì?
X là axit axetic
Kim loại nào sau đây không phản ứng với dung dịch H2SO4 loãng?
Cu không phản ứng với dung dịch H2SO4 loãng
Ngày nay, việc sử dụng khí gas đã mang lại sự tiện lợi cho cuộc sống con người. Một loại gas dùng để đun nấu có thành phần chính là khí butan được hóa lỏng ở áp suất cao trong bình chứa. Số nguyên tử cacbon trong phân tử butan là
Số nguyên tử cacbon trong phân tử butan là 4 (C4H10)
Chất nào sau đây là chất lỏng ở điều kiện thường?
Triolein là chất lỏng ở điều kiện thường
Công thức của crom(III) hiđroxit là gì?
Công thức của crom(III) hiđroxit là Cr(OH)3
Một mẫu khí thải công nghiệp có chứa các khí:\(C{O_2},S{O_2},N{O_2},{H_2}S\). Để loại bỏ các khí đó một cách hiệu quả nhất, có thể dùng dung dịch nào sau đây?
Để loại bỏ các khí đó một cách hiệu quả nhất, có thể dùng dung dịch Ca(OH)2
Thủy phân chất X bằng dung dịch thu được hai chất Y và Z đều có phản ứng tráng bạc, Z tác dụng được với Na sinh ra khí . Xác định chất X?
X là \(HC{\text{OO}} - C{H_2}CHO\)
Cho sơ đồ chuyển hoá giữa các hợp chất của crom:
\(Cr{\left( {OH} \right)_3}\xrightarrow{{ + KOH}}X\xrightarrow{{ + \left( {C{l_2} + KOH} \right)}}Y\xrightarrow{{ + {H_2}S{O_4}}}Z\xrightarrow{{ + \left( {FeS{O_4} + {H_2}S{O_4}} \right)}}T\)
Các chất X, Y, Z , T theo thứ tự là :
Các chất X, Y, Z , T theo thứ tự là :\(KCr{O_2};{K_2}Cr{O_4};{K_2}Cr{O_7};C{r_2}{\left( {S{O_4}} \right)_3}\)
Hợp chất hữu cơ X tác dụng được với dung dịch NaOH và dung dịch brom nhưng không tác dụng với dung dịch NaHCO3 Chất X là chất nào trong các chất sau?
Chất X là phenol
Cho các chất sau: fructozơ, glucozơ, etyl axetat, Val-Gly-Ala. Số chất phản ứng với Cu(OH)2 trong môi trường kiềm, tạo dung dịch màu xanh lam là
Số chất phản ứng với Cu(OH)2 trong môi trường kiềm, tạo dung dịch màu xanh lam là 2
Phát biểu nào sau đây sai?
Phát biểu sai: Cho Cu(OH)2 vào dung dịch lòng trắng trứng thấy xuất hiện màu vàng.
Cho các phản ứng xảy ra theo sơ đồ sau :
\(\begin{gathered} {X_1} + {H_2}O\xrightarrow[{co\,mang\,ngan}]{{dien\,phan}}{X_2} + {X_3} \uparrow + {H_2} \uparrow \hfill \\ {X_2} + {X_4} \to BaC{O_3}_ \downarrow + {K_2}C{O_3} + {H_2}O \hfill \\ \end{gathered} \)
Chất X2, X4 lần lượt là
Chất X2, X4 lần lượt là \(KOH,Ba{\left( {HC{O_3}} \right)_2}\)
Xenlulozơ trinitrat được điều chế từ xenlulozơ và axit nitric đặc. Để điều chế được 29,7 kg xenlulozơ trinitrat, cần dùng dung dịch chứa m kg axit nitric (hiệu suất phản ứng đạt 90% tính theo axit nitric). Giá trị của m là
Phương trình:
[C6H7O2(OH)3]n + 3nHNO3(đặc) → [C6H7O2(ONO2)3]n + 3nH2O
nHNO3 = 3n[C6H7O2(ONO2)3]n = 3. 29.7/297= 0,3 mol
Do hiệu suất chỉ đạt 90% nên mHNO3=0,3 .63/0.9 =21kg
Cho các phát biểu sau:
(a) Thủy phân vinyl axetat bằng NaOH đun nóng, thu được natri axetat và fomanđehit.
(b) Polietilen được điều chế bằng phản ứng trùng hợp etilen.
(c) Ở điều kiện thường, anilin là chất lỏng.
(d) Xenlulozơ thuộc loại polisaccarit.
(e) Thủy phân hoàn toàn anbumin thu được hỗn hợp \(\alpha - amino{\text{ }}axit.\)
(g) Tripanmitin tham gia phản ứng cộng \({{\text{H}}_2}{\text{ }}\left( {Ni,{\text{ }}{t^0}} \right).\)
Số phát biểu đúng là
Số phát biểu đúng là 4
Ancol etylic được điều chế bằng cách lên men tinh bột theo sơ đồ:
(C6H10O5)n → C6H12O6 → C2H5OH.
Để điều chế 10 lít rượu etylic 46° cần m kg gạo (chứa 75% tinh bột, còn lại là tạp chất trơ). Biết hiệu suất của cả quá trình là 80% và khối lượng riêng của ancol etylic nguyên chất là 0,8g/ml. Giá trị của m là:
VC2H5OH = 10.46/100 = 4,6 lít
mC2H5OH = D.V = 0,8.4,6 = 3,68 kg
(C6H10O5)n →nC6H12O6 → 2nC2H5OH
162n 92n
x 3,68
x = (3,68.162)/92 = 6,48 kg
Khối lượng tinh bột thực tế cần dùng là: 6,48.(100/80) = 8,1 kg
Khối lượng gạo cần dùng là: 8,1.(100/75) = 10,8 kg
Hỗn hợp X gồm vinyl axetat, metyl axetat, etyl fomat. Đốt cháy 3,08 gam X thu được 2,16 gam H2O. Thành phần % về khối lượng vinyl axetat trong X là?
Vinyl axetat C4H6O2 (a mol)
Metyl axetat và etyl fomat có cùng công thức C3H6O2 (b mol)
mX = 86a + 74b = 3,08
n = 3a + 3b = 0,12
=> a = 0,01 và b = 0,03
=> %nC4H6O2 = 25% và %mC4H6O2 = 27,92%
Đáp án A
Cho Mg tác dụng với dung dịch chứa 1,2 mol HNO3, thu được dung dịch X và m gam hỗn hợp khí. Thêm 500 ml dung dịch NaOH 2M vào X, thu được dung dịch Y, kết tủa và 1,12 lít khí Z (đktc). Lọc bỏ kết tủa, cô cạn Y thu được chất rắn T. Nung T đến khối lượng không đổi, thu được 67,55 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
Chọn đáp án B
+ Vì nHỗn hợp este = 0,055 mol mà nKOH pứ vừa đủ = 0,065 > 0,055 ⇒ Có este đa chức.
+ Nhưng vì ancol đơn chức + axit không phân nhánh ⇒ Có este 2 chức.
+ Đặt nEste đơn chức = a và nEste 2 chức = b ta có hệ.
\(\left\{ \begin{gathered} a + b = 0,055 \hfill \\ a + 2b = 0,065 \hfill \\ \end{gathered} \right. \Leftrightarrow \left\{ \begin{gathered} a = 0,045 \hfill \\ b = 0,01 \hfill \\ \end{gathered} \right.\)
Đốt 0,1 mol X cần 0,5 mol O2 ⇒ Đốt 0,055 mol X cần 0,275 mol.
⇒ Đốt 0,055 mol Y cần nO2 = 0,275 + \(\frac{{0,045}}{2}\) = 0,2975 mol.
Ta có nO/Y = 2nKOH = 0,065×2 = 0,13 mol.
+ Khi đốt Y tạo ra nCO2 = a mol và nH2O = b mol.
⇒ Bảo toàn oxi có: 2a + b = 0,13 + 2nO2 = 0,725 (1)
Ta có: nCO2 – nH2O = nEste no 2 chức = a – b = 0,01 (2)
+ Giải hệ (1) và (2) ta có nCO2 = 0,245 và nH2O = 0,235 mol.
⇒ mY = mC + mH + mO = 0,245×12 + 0,235×2 + 0,13×16 = 5,49.
⇒ Bảo toàn khối lượng ta có: mMuối = 5,49 + 0,065×56 – 3,41 = 5,72 gam.
+ Gọi 2 muối có dạng: \(\left\{ \begin{gathered} RCOOK:0,045 \hfill \\ R'{\left( {COOK} \right)_2}:0,01 \hfill \\ \end{gathered} \right.\)
⇒ 0,045×(R+83) + 0,01×(R'+166) = 5,72 ![]() 9R + 2R' = 65
9R + 2R' = 65
+ Giải phương trình nghiệm nguyên ⇒ R = 1 và R' = 28
⇒ Muối có phân tử khối lớn hơn là (C2H4)(COOK)2
%m(C2H4)(COOK)2 = \(\frac{{0,0,1.194}}{{5,72}}\) × 100 ≈ 33,92% ⇒ Chọn B
Trong tự nhiên, canxi sunfat tồn tại dưới dạng muối ngậm nước (CaSO4.2H2O) được gọi là gì?
Trong tự nhiên, canxi sunfat tồn tại dưới dạng muối ngậm nước (CaSO4.2H2O) được gọi là thạch cao sống.
Dung dịch chứa chất nào sau đây có màu da cam?
Dung dịch Na2Cr2O7 có màu da cam
Chất nào sau đây bị thủy phân trong dung dịch KOH, đun nóng?
Etyl axetat bị thủy phân trong dung dịch KOH, đun nóng
Các số oxi hoá phổ biến của crom trong các hợp chất là?
Các số oxi hoá phổ biến của crom trong các hợp chất là +2, +3, +6.
Cho vài giọt nước brom vào dung dịch anilin, lắc nhẹ. Hiện tượng quan sát được là
Cho vài giọt nước brom vào dung dịch anilin, lắc nhẹ. Hiện tượng quan sát được là kết tủa màu trắng
Hòa tan hoàn toàn 1,15 gam kim loại X vào nước, thu được dung dịch Y. Để trung hòa Y cần vừa đủ 50 gam dung dịch HCl 3,65%. Kim loại X là gì?
nOH- = nH+ = nHCl = ( 50.3,65%):(100%. 36,5) = 0,05 (mol)
X + nH2O → X(OH)n + nH2↑
=> MX = 1,15 : 0,05n = 23n
Vậy n = 1 => MX = 23 => Na
Đáp án C
Polime được sử dụng làm chất dẻo là gì?
Polime được sử dụng làm chất dẻo là Poli(metyl metacrylat).
Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là gì?
Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là có kết tủa keo trắng, sau đó kết tủa tan
Saccarozơ và glucozơ đều thuộc loại
Saccarozơ và glucozơ đều thuộc loại cacbohiđrat
Dẫn khí CO dư qua hỗn hợp bột gồm MgO, CuO, Al2O3 và Fe3O4, nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Số oxit kim loại có trong Y là
Số oxit kim loại có trong Y là 2
Cho dãy các chất sau: phenylfomat, fructozơ, natri axetat, etylamin, trilinolein. Số chất bị thuỷ phân trong môi trường axit là gì?
Chất bị thuỷ phân trong môi trường axit là phenyl fomat, trilinolein.
Đề thi liên quan
-
Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Hà Huy Tập
-
40 câu hỏi
-
90 phút
-