Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Lê Hồng Phong
Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Lê Hồng Phong
-
Hocon247
-
40 câu hỏi
-
90 phút
-
61 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
X là este của amino axit, Y là peptit mạch hở. Cho m gam hỗn hợp M gồm X và Y tác dụng vừa đủ với dung dịch chứa 0,7 mol NaOH, đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, thu được 13,8 gam một ancol đơn chức Z và hỗn hợp T chứa muối của glyxin, alanin, valin (trong đó có 0,5 mol muối của glyxin). Đốt cháy hoàn toàn T trong O2, thu được Na2CO3, N2, H2O và 1,45 mol CO2. Cho toàn bộ lượng Z trên tác dụng hết với Na, sinh ra 0,15 mol H2. Phần trăm khối lượng của Y trong M gần nhất với
\({n_Z} = 2{n_{{H_2}}} = 0,3{\text{ mol}} \Rightarrow {M_Z} = \frac{{13,8}}{{0,3}} = 46 \Rightarrow Z:{C_2}{H_5}OH\)
T chứa AlaNa (a mol), ValNa (b mol) và GlyNa (0,5 mol)
\(\Rightarrow \left\{ \begin{gathered} {n_{NaOH}} = a + b + 0,5 = 0,7{\text{ mol}} \hfill \\ {{\text{n}}_{N{a_2}C{O_3}}} = \frac{{{n_{NaOH}}}}{2} = 0,35{\text{ mol}}\xrightarrow[{}]{{BTNT{\text{ C}}}}{n_C} = 3a + 5b + 2.0,5 = 1,45 + 0,35 \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered} a = 0,1 \hfill \\ b = 0,1 \hfill \\ \end{gathered} \right.\)
· Dễ thấy a = b <nZ => X là H2NCH2COOC2H5 (0,3 mol)
=> Y chứa các mắt xích Gly (0,5 – 0,3 = 0,2 mol), Val (0,1 mol), Ala (0,1 mol)
=> Y có dạng (AlaValGly2)k
\(\% {m_Y} = \frac{{302k.\frac{{0,1}}{k}}}{{302k.\frac{{0,1}}{k} + 103.0,3}}.100\% = 49,43\% \)
Gần nhất với giá trị 48%
=> Chọn đáp án D.
Chất nào sau đây là hợp chất tạp chức?
H2NCH2COOH là hợp chất tạp chức
Thành phần chính của thuốc nổ không khói là xenlulozơ trinitrat. Công thức của Xenlulozơ trinitrat là gì?
Thành phần chính của thuốc nổ không khói là xenlulozơ trinitrat. Công thức của Xenlulozơ trinitrat là gì? [C6H7O2(ONO2)3]n .
Để chứng minh tính chất lưỡng tính của Glyxin, ta cho Glyxin tác dụng với
Để chứng minh tính chất lưỡng tính của Glyxin, ta cho Glyxin tác dụng với HCl, NaOH.
Dãy nào sau đây chứa các ion không cùng tồn tại đồng thời trong một dung dịch?
Ag+, Al3+, PO43-, Cl-. không cùng tồn tại đồng thời trong một dung dịch
Chất E được dùng làm dung môi pha chế dược phẩm, dùng thay xăng làm nhiên liệu cho động cơ đốt trong. Việt Nam đã tiến hành pha E vào xăng truyền thống với tỉ lệ 5% để được xăng E5. Chất E là
E là Etanol
Cho dãy các chất sau: H2NCH2COOH , C6H5NH3Cl , C2H5NH2 , CH3COOC2H5. Số chất trong dãy phản ứng với dung dịch NaOH ?
Số chất trong dãy phản ứng với dung dịch NaOH là 3
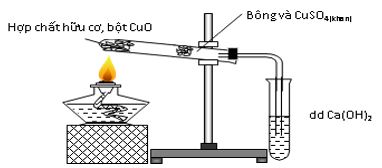
Cho hình vẽ mô tả qúa trình xác định C và H trong hợp chất hữu cơ.
Hãy cho biết vai trò của CuSO4 (khan) và sự biến đổi của nó trong thí nghiệm.
Xác định H và màu CuSO4 từ màu trắng sang màu xanh.
Cho các chất: saccarozơ, glucozơ, fructozơ, etyl fomat, axit fomic và anđehit axetic. Trong các chất trên, số chất vừa có khả năng tham gia phản ứng tráng bạc vừa có khả năng phản ứng với Cu(OH)2 ở điều kiện thường ?
số chất vừa có khả năng tham gia phản ứng tráng bạc vừa có khả năng phản ứng với Cu(OH)2 ở điều kiện thường là 4
Tiến hành thí nghiệm với các chất X, Y, Z, T. Kết quả được ghi ở bảng sau:
Các chất X,Y,Z,T lần lượt là Saccarozơ, triolein, lysin, anilin
Cho các phát biểu sau:
(1) Các este đơn chức bị thủy phân trong môi trường kiềm đều tạo ra muối và ancol.
(2) Fructozo có phản ứng tráng bạc, chứng tỏ phân tử fructozo có nhóm chức CHO.
(3) Trong peptit mạch hở tạo bởi n gốc α-aminoaxit có n-1 liên kết peptit.
(4) Các polime sử dụng làm tơ đều tổng hợp từ phản ứng trùng ngưng.
Số câu phát biểu đúng là
Số câu phát biểu đúng là 1
Chất hữu cơ X mạch hở có công thức phân tử C8H12O4 và thỏa sơ đồ các phản ứng sau
Khẳng định nào sau đây đúng?
Từ Z có thể điều chế T theo sơ đồ: Z → hidrocacbon A → T.
Cho các phát biểu sau:
(1). Hỗn hợp Fe3O4 + Cu (tỉ lệ mol 1:1) có thể tan hết trong dung dịch HCl dư.
(2). Sục khí CO2 tới dư vào dung dịch nước vôi trong thu được kết tủa.
(3). Cho kim loại Fe vào dung dịch CuCl2 xảy ra hiện tượng ăn mòn hóa học.
(4). Hỗn hợp Ba và Al (có tỉ lệ mol 1:2) có thể tan hoàn toàn trong nước.
(5). Cho kim loại Mg dư vào dung dịch FeCl3 sau phản ứng thu được dung dịch chứa 2 muối tan.
(6). Cho khí H2 dư qua hỗn hợp bột Fe2O3 và CuO nung nóng, thu được Fe và Cu.
Số phát biểu đúng là
Số phát biểu đúng là 4
Thực hiện các thí nghiệm sau:
(a) Nung NH4NO3 rắn.
(b) Cho Mg tác dụng với dung dịch HNO3 loãng, dư.
(c) Cho dung dịch Fe(NO3)2 vào dung dịch HCl loãng.
(d) Cho từ từ HCl vào dung dịch Na2CO3.
(e) Cho urê vào dung dịch NaOH.
(f) Cho dung dịch KHSO4 vào dung dịch NaHCO3.
Số thí nghiệm chắc chắn sinh ra chất khí là
Số thí nghiệm chắc chắn sinh ra chất khí là 4
Số chất hữu cơ mạch hở, đơn chức hầu như không tan trong nước có công thức phân tử C2H4O2 là
Đáp án C
chú ý "hầu như không tan trong nước" là ngôn ngữ quyết định ở đây.
C2H4O2 có các đồng phân: HO-CH2-CHO (1); CH3COOH (2); HCOOCH3 (3).
nhưng chính cái trên loại đi (1); (2) vì dễ tan trong nước (OH, -COOH có liên kết công hóa trị)
Để thu được kim loại Cu từ dung dịch CuSO4theo phương pháp thuỷ luyện, có thể dùng kim loại nào sau đây?
Để thu được kim loại Cu từ dung dịch CuSO4theo phương pháp thuỷ luyện, có thể dùng Fe
Ancol X có số nguyên tử cacbon bằng số nguyên tử oxi. Chất X không thể là
Ancol X có số nguyên tử cacbon bằng số nguyên tử oxi. Chất X không thể là Ancol etylic
Kim loại nhôm không bị oxi hóa trong không khí ở nhiệt độ thường do nhôm
Kim loại nhôm không bị oxi hóa trong không khí ở nhiệt độ thường do nhôm tác dụng với oxi của không khí tạo lớp màng oxit bên bảo vệ.
Nhận định nào đúng?
Hiđro hóa hoàn toàn glucozơ (xt Ni, to) tạo ra sorbitol.
Chất vừa tác dụng được với dung dịch NaOH, vừa tác dụng được với dung dịch Br2/CCl4 là
Chất vừa tác dụng được với dung dịch NaOH, vừa tác dụng được với dung dịch Br2/CCl4 là CH2=CHCOOH.
Khí chủ yếu gây mưa axit là?
Khí chủ yếu gây mưa axit là SO2 và NO2
Khối lượng mol (g/mol) của este có mùi chuối chín là?
Khối lượng mol (g/mol) của este có mùi chuối chín là 130
Có thể phân biệt 3 dung dịch: NaOH, HCl, H2SO4 (loãng) bằng một thuốc thử là
Có thể phân biệt 3 dung dịch: NaOH, HCl, H2SO4 (loãng) bằng một thuốc thử là BaCO3
Nhỏ từ từ từng giọt đến hết 25,0 ml dung dịch HCl 1,2M vào 100ml dung dịch chứa K2CO3 0,2M và KHCO3 0,2M, sau phản ứng thu được số mol CO2 là
Đáp án D
Nhỏ từ từ từng giọt HCl nên quá trình xảy ra lần lượt theo thứ tự:
H+ + CO32– → HCO3– || sau đó: H+ + HCO3– → CO2↑ + H2O.
Thay số mol các chất vào ||→ nCO2 = 0,010 mol.
Nhỏ từ từ từng giọt đến hết 25,0 ml dung dịch HCl 1,2M vào 100ml dung dịch chứa K2CO3 0,2M và KHCO3 0,2M, sau phản ứng thu được số mol CO2 là
Đáp án D
Nhỏ từ từ từng giọt HCl nên quá trình xảy ra lần lượt theo thứ tự:
H+ + CO32– → HCO3– || sau đó: H+ + HCO3– → CO2↑ + H2O.
Thay số mol các chất vào ||→ nCO2 = 0,010 mol.
Cho tất cả các đồng phân cấu tạo, đơn chức, mạch hở, có công thức phân tử C2H4O2 lần lượt tác dụng với: dung dịch KOH; dung dịch KHCO3; dung dịch AgNO3/NH3, to; Ba. Số phản ứng hóa học xảy ra là
Đáp án A
C2H4O2 có 2 đồng phân đơn chức, mạch hở ứng với các TH và phản ứng sau:
♦1 CH3COOH (axit): CH3COOH + KOH → CH3COOK + H2O (1);
CH3COOH + KHCO3 → CH3COOK + CO2↑ + H2O (2); CH3COOH + Ba → (CH3COO)2Ba + H2 (3).
♦2: HCOOCH3 (este): HCOOCH3 + KOH → HCOOK + CH3OH (4);
HCOOCH3 + AgNO3/NH3 → Ag↓ + H3C-O-COONH4 + NH4NO3 (5).
► Thật chú ý: HOCH2CHO là tạp chức ancol, anđehit nên tránh đếm thừa, sai so với yêu cầu nhé.
Glucozơ không phản ứng được với chất nào sau đây?
Glucozơ không phản ứng được với CH3CHO.
Dung dịch chất A không làm quỳ tím đổi màu; dung dịch chất B làm quỳ tím hóa xanh. Trộn hai dung dịch trên thu được kết tủa. Hai chất A và B tương ứng là
Dung dịch chất A không làm quỳ tím đổi màu; dung dịch chất B làm quỳ tím hóa xanh. Trộn hai dung dịch trên thu được kết tủa. Hai chất A và B tương ứng là Ca(NO3)2 và K2CO3.
Thủy phân hoàn toàn 24,48 gam hỗn hợp X gồm glucozơ và saccarozơ trong môi trường axit thu được hỗn hợp Y. Trung hoàn axit trong Y bằng dung dịch NaOH vừa đủ rồi sau đó thêm lượng dư dung dịch AgNO3/NH3 vào và đun nóng, thu được x gam Ag. Mặt khác, đốt cháy 12,24 gam X cần dùng 0,42 mol O2. Các phản ứng xảy ra hoàn toàn, x là
Đáp án B
tỉ lệ tương quan: đốt 24,48 gam X cần dùng 0,84 mol O2.
► glucozơ và saccarozơ là cacbohiđrat, tức dạng Cn(H2O)m
||→ đốt chúng thì O2 cần đốt là dùng để đốt C mà thôi ||→ ∑nC trong X = 0,84 mol.
Gọi nglucozơ = x mol; nsaccarozơ = y mol thì 180x + 324y = 24,48 gam
và theo trên 6x + 12y = ∑nC = 0,84 mol ||→ giải hệ: x = 0,1 mol và y = 0,02 mol.
Thủy phân hoàn toàn nên Y chứa 0,12 mol glucozơ và 0,02 mol fructozơ.
Tuy nhiên cả hai đều + AgNO3/NH3 → Ag theo tỉ lệ 1glu tạo 2Ag, 1fruc tạo 2Ag.
||→ ∑nkết tủa Ag thu được = (0,12 + 0,02) × 2 = 0,28 mol ||→ x = 30,24 gam.
Đun nóng 14,64 gam este E có công thức phân tử C7H6O2 cần dùng 80 gam dung dịch NaOH 12%. Cô cạn dung dịch được x gam muối khan. Giá trị của x là
Đáp án A
phản ứng 0,12 mol este E cần 0,24 mol NaOH ||→ tỉ lệ 1 ÷ 2 chứng tỏ E là este của phenol.
CTPT C7H6O2 thì ứng duy nhất hợp chất là HCOOC6H5.
Phản ứng: HCOOC6H5 + 2NaOH → HCOONa + C6H5ONa + H2O.
||→ muối gồm 0,12 mol HCOONa và 0,12 mol C6H5ONa ||→ x = 22,08 gam.
Có thể dùng chất NaOH khan để làm khô các chất khí
Đáp án C
Yêu cầu làm khô giữ nước và đương nhiên không được giữa luôn các khí cần làm khô.
• NaOH + NO2 → NaNO3 + NaNO2 + H2O.
• NaOH + Cl2 → NaCl + NaClO + H2O.
• NaOH + CO2 → NaCO3 + NaHCO3 + H2O.
3 phương trình phản ứng trên xảy ra loại đi đáp án A, B, D
Hai chất có cùng khối lượng mol là
Hai chất có cùng khối lượng mol là fructozơ và glucozơ.
Tripanmitin là hợp chất hữu cơ thuộc loại
Tripanmitin là hợp chất hữu cơ thuộc loại đa chức
Hòa tan hết x gam kim loại R cần dùng 136 gam dung dịch HNO3 31,5%. Sau khi kết thúc phản ứng chỉ thu được dung dịch A và 0,12 mol khí NO. Cô cạn dung dịch A thu được (2,5x + 8,49) gam muối khan. Kim loại R là
Đáp án D
NO không nói spk duy nhất, đáp án có Mg, Ca, Zn ||→ "mùi" của NH4NO3.
có nHNO3 = 0,68 mol = 4nNO + 10nNH4NO3 (theo bảo toàn electron mở rộng).
||→ đúng là có muối amoni và nNH4NO3 = 0,02 mol.
♦ bảo toàn nguyên tố N có ∑nNO3– trong muối kim loại = 0,52 mol
||→ mmuối = x + 0,52 × 62 + 0,02 × 80 = 2,5x + 8,49 ||→ giải x = 16,9 gam.
chia tỉ lệ: x ÷ ∑nNO3– trong muối kim loại = 16,9 ÷ 0,52 = 65 ÷ 2
số 65 và số 2 cho ta biết đó là kim loại Zn (hóa trị 2, M = 65) ||
Cho lượng dư dung dịch H2SO4 loãng tác dụng với Fe3O4 đến phản ứng hoàn toàn thu được dung dịch D. Cho dung dịch D tác dụng với các chất: Cu, KOH, Br2, AgNO3, K2Cr2O7, MgSO4, Ca(NO3)2, Al. Số chất phản ứng được là
Đáp án C
chú ý H2SO4 dùng dư nên dung dịch D gồm: H2SO4 + FeSO4 + Fe2(SO4)3.
• (1) Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4 ||→ ok.!
• (2) 2KOH + H2SO4 → K2SO4 + H2O ||→ ok.! (KOH cũng tạo kết tủa với Fe2+ và Fe3+ nữa nhé.!).
• (3) dãy I2/I– < Fe3+/Fe2+ < Br2/Br– ||→ có phản ứng Br2 + Fe2+ → Fe3+ + Br– ||→ ok.!
• (4) AgNO3 cung cấp NO3–; dung dịch sẵn Fe2+ + H+ ||→ phản ứng oxi hóa khử → ok.!
• (5) K2Cr2O7/H2SO4 chất oxi hóa mạnh, Fe2+ là chất khử → phản ứng oxi hóa khử:
K2Cr2O7 + FeSO4 + H2SO4 → K2SO4 + Cr2(SO4)3 + Fe2(SO4)3 + H2O ||→ ok.!
• (6) Ca(NO3)2 tương tự AgNO3 cung cấp ion NO3– cho cặp Fe2+ và H+ ||→ ok.!
• (7) Al phản ứng được với cả 3 chất trong dung dịch D (theo dãy điện hóa) ||→ ok.!
Chỉ mỗi TH MgSO4 là không có phản ứng xảy ra mà thôi. Đếm + đọc yêu cầu → chọn C
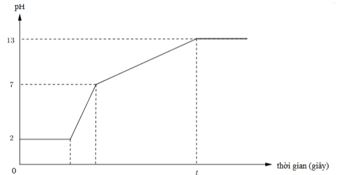
Dưới đây là đồ thị biểu diễn mối quan hệ giữa thời gian điện phân và pH của dung dịch khi điện phân 400ml (xem thể tích không đổi) dung dịch gồm KCl, HCl và CuCl2 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện bằng I = 1,93A
Giá trị của t trên đồ thị là
Đáp án A
đọc đồ thị:
• đoạn thằng y = 2 ứng với quá trình điện phân CuCl2 → Cu + Cl2, pH của dung dịch không đổi.
và từ pH = 2 → CM (HCl) = 0,01 mol → có 0,004 mol HCl trong dung dịch ban đầu.
• đoạn thằng tiếp theo (2 → 7) là quá trình điện phân HCl → H2 + Cl2, nồng độ H+ giảm dần nên pH từ 2 → 7.
tại pH = 7 là ứng với thời điểm mà HCl điện phân hết, bắt đầu quá trình tiếp theo, dung dịch lúc này chỉ còn KCl.
• tiếp đó là quá quá trình: KCl + H2O → KOH + H2 + Cl2; pH = 13 → CM (KOH) = 0,1 M
||→ có 0,04 mol KOH → ứng với 0,04 mol KCl. sau quá trình này, chỉ có H2O bị điện phân,
pH ổn đinh = 13 và không đổi (trừ khi nước bị điện phân nhiều và tính sự thay đổi của H2O).
Tóm lại, ứng tại thời điểm t, ∑nCl2 ra bên anot = 0,008 + 0,004 ÷ 2 + 0,04 ÷ 2 = 0,03 mol.
||→ ne trao đổi = 0,06 mol ||→ t = Ans × 96500 ÷ 1,93 = 3000 giây.
Dãy có lực bazơ tăng dần theo thứ tự dãy là dãy
Dãy có lực bazơ tăng dần theo thứ tự dãy là dãy anilin, amoniac, metylamin.
Este no, đơn chức, mạch hở có công thức tổng quát là
Este no, đơn chức, mạch hở có công thức tổng quát là CnH2nO2
Đề thi liên quan
-
Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Lê Hồng Phong
-
40 câu hỏi
-
90 phút
-

.JPG)