Đề thi thử THPT QG năm 2022 môn Hóa học - Trường THPT Huỳnh Thúc Kháng
Đề thi thử THPT QG năm 2022 môn Hóa học - Trường THPT Huỳnh Thúc Kháng
-
Hocon247
-
40 câu hỏi
-
90 phút
-
40 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Kim loại được dùng phổ biến để tạo trang sức, có tác dụng bảo vệ sức khỏe là
Đáp án B
Bạc là kim loại được dùng phổ biến để tạo trang sức, có tác dụng bảo vệ sức khỏe.
Xảy ra hiện tượng nào sau đây khi nhỏ từ từ dung dịch KOH đến dư vào ống nghiệm dung dịch .
Đáp án D
\(Al{{\left( OH \right)}_{3}}+NaOH\to NaAl{{O}_{2}}+2{{H}_{2}}O\)
PTHH: \(AlC{{l}_{3}}+3NaOH\to Al{{\left( OH \right)}_{3}}+3NaCl\)
Khi nấu canh cua thì thấy các mảng “riêu cua” nổi lên là do
Đáp án A
Trong thành phần của riêu cua chủ yếu là protein, khi đun nóng, protein sẽ bị đông tụ và tách ra khỏi dung dịch.
- Hiện tượng trứng rán cũng do protein bị đông tụ khi đun nóng.
- Nhiều protein tan được trong nước tạo thành dung dịch keo và bị đông tụ lại khi đun nóng. Sự đông tụ và kết tủa protein cũng xảy ra khi cho axit, bazơ hoặc một số muối vào dung dịch protein.
Hợp chất nào không tạo thành sau phản ứng kim loại tác dụng với axit nitric?
Đáp án B
Sản phẩm khử của axit nitric gồm: NO, N2O, NO2, N2, NH4NO3.
Quặng nào chứa hàm lượng sắt lớn nhất trong các quặng sau đây?
Đáp án A
Quặng manhetit chứa Fe3O4 với \(%Fe=\frac{56.3}{232}.100=72,4%\)
Quặng hematit đỏ chứa Fe2O3 với \(%Fe=\frac{56.2}{160}.100=70%\)
Quặng xiđrerit chứa FeCO3 với \(%Fe=\frac{56}{116}.100=48,3%\)
Quặng hematit đỏ chứa FeS2 \(%Fe=\frac{56}{120}.100=46,7%\)
\(\to \) Quặng manhetit có hàm lượng sắt lớn nhất.
Polime nào sau đây thuộc loại polime bán tổng hợp?
Đáp án A
- Polime thiên nhiên: tinh bột, tơ tằm.
- Polime tổng hợp: polietilen.
- Polime bán tổng hợp (nhân tạo): tơ visco.
Hòa tan xenlulozơ trong NaOH loãng (xúc tác CS2) thu được dung dịch keo rất nhớt gọi là tơ visco.
Phân loại polime:
- Polime thiên nhiên: xenlulozơ, tinh bột, tơ tằm, len…
- Polime tổng hợp: polietilen, poli(vinyl clorua), tơ nitron, nilon-6,6, nilon-6, nilon-7, tơ lapsan,…
- Polime bán tổng hợp (nhân tạo): tơ visco, tơ axetat, xenlulozơ trinitrat,…
Phản ứng nào sau đây glucozơ đóng vai trò là chất oxi hóa?
Đáp án C
Phản ứng tạo sobitol của glucozơ.
\({{C}_{6}}{{H}_{12}}{{O}_{6}}+{{H}_{2}}\to {{C}_{6}}{{H}_{14}}{{O}_{6}}\).
Glixerol không tham gia phản ứng nào sau đây?
Đáp án D
PTHH:
\(2{{C}_{3}}{{H}_{5}}{{\left( OH \right)}_{3}}+Cu{{\left( OH \right)}_{2}}\to {{\left( {{C}_{3}}{{H}_{5}}{{\left( OH \right)}_{2}}O \right)}_{2}}Cu+2{{H}_{2}}O\)
\(2{{C}_{3}}{{H}_{5}}{{\left( OH \right)}_{3}}+6Na\to 2{{C}_{3}}{{H}_{5}}{{\left( ONa \right)}_{3}}+3{{H}_{2}}\)
\({{C}_{3}}{{H}_{5}}{{\left( OH \right)}_{3}}+3HCl\to {{C}_{3}}{{H}_{5}}C{{l}_{3}}+3{{H}_{2}}O\)
Cho 12 gam hỗn hợp Fe và Cu tác dụng với HCl (dư) thể tích khí H2 sinh ra là 2,24 lít (đktc). Phần kim loại không tan có khối lượng là
Đáp án A
\({{n}_{{{H}_{2}}}}=0,1\) mol
Cu không phản ứng với HCl nên kim loại không tan chính là Cu.
Ta có:
\(\begin{align} & Fe\to \overset{+2}{\mathop{Fe}}\,+2e \\ & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,2 \\ \end{align}\) \(\begin{align} & 2\overset{+1}{\mathop{H}}\,+2e\to \overset{0}{\mathop{{{H}_{2}}}}\, \\ & \,\,\,\,\,\,\,\,\,\,\,0,2\,\,\,\,\,\,0,1 \\ \end{align}\)
BTe: \({{n}_{e\left( + \right)}}={{n}_{e\left( - \right)}}=0,1.2=0,2\)mol
Nên \({{n}_{Fe}}=\frac{0,2}{2}=0,1\) mol
\({{m}_{Fe}}=0,1.56=5,6\)(g)
Vậy \({{m}_{Cu}}={{m}_{hh}}-{{m}_{Fe}}=12-5,6=6,4\left( g \right)\)
Dẫn 2,24 lít khí CO2 (đktc) vào 100 ml dung dịch NaOH 1M. Sau phản ứng cô cạn dung dịch có các chất nào sau đây?
Đáp án B
Ta có: \(\frac{{{n}_{O{{H}^{-}}}}}{{{n}_{C{{O}_{2}}}}}=\frac{0,1}{0,1}=1\)
Nên sau phản ứng tạo 1 muối là NaHCO3.
Thuốc thử duy nhất có thể dùng để nhận biết 3 chất lỏng đựng trong 3 lọ mất nhãn: phenol, stiren, ancol benzylic là
Đáp án C
|
Phenol |
Stiren |
Ancol benzylic |
|
Mất màu dung dịch \(B{{r}_{2}}\), xuất hiện kết tủa trắng |
Mất màu dung dịch \(B{{r}_{2}}\) |
Không hiện tượng |
Khối lượng glucozơ cần dùng để điều chế 1 lít dung dịch ancol (rượu) etylic \({{40}^{0}}\) với hiệu suất 80% là bao nhiêu? (Biết khối lượng riêng của ancol nguyên chất là 0,8 g/ml)
Đáp án B
\({{C}_{6}}{{H}_{12}}{{O}_{6}}\xrightarrow{len\,men}2C{{O}_{2}}+2{{C}_{2}}{{H}_{5}}OH\)
\({{m}_{ruou}}={{V}_{nguyen\,chat}}.{{d}_{ruou}}={{V}_{ruou\left( {{40}^{0}} \right)}}.\frac{{{D}_{ruou}}}{100}.{{d}_{ruou}}=1.1000.\frac{40}{100}.0,8=320\)gam
\({{n}_{glucozo\left( phan\,ung \right)}}=\frac{1}{2}{{n}_{ancol}}=\frac{1}{2}.\frac{320}{46}=\frac{80}{23}\)mol
\({{n}_{glucozo\left( da\,dung \right)}}=\frac{{{n}_{glucozo\left( phan\,ung \right)}}.100}{H%}=\frac{100}{23}\)mol
\({{m}_{glucozo\left( da\,dung \right)}}=782,61\)gam
\({{D}_{ruou}}\): độ rượu.
\({{d}_{ruou}}\): khối lượng riêng của ancol nguyên chất.
Cho 7,5 garn H2NCH2COOH tác dụng vừa đủ với V ml dung dịch NaOH 0,5M. Giá trị của V là
Đáp án B
\({{H}_{2}}NC{{H}_{2}}COOH+NaOH\to {{H}_{2}}NC{{H}_{2}}COONa+{{H}_{2}}O\)
\({{n}_{NaOH}}={{n}_{a\min oaxit}}=0,1\)mol
\(\to {{V}_{_{NaOH}}}=200\)ml
Phương trình điện li nào sau đây đúng?
Đáp án B
A sai. \(NaCl\to N{{a}^{+}}+C{{l}^{-}}\)
C sai vì \({{C}_{2}}{{H}_{5}}OH\) không điện li.
Glucozơ và fructozơ đều có tính chất nào sau đây?
Đáp án A
B sai vì chỉ có glucozơ mới có nhóm chức \(-CH=O\) trong phân tử.
C sai vì trong dung dịch glucozơ và fructozơ tồn tại chủ yếu dạng mạch vòng.
D sai vì glucozơ và fructozơ đều không tham gia phản ứng thủy phân.
Hai kim loại X, Y và dung dịch muối tương ứng có các phản ứng hóa học theo sơ đồ sau: (1) \(X+2{{Y}^{3+}}\to {{X}^{2+}}+2{{Y}^{2+}}\) và (2) \(Y+{{X}^{2+}}\to {{Y}^{2+}}+X\). Kết luận nào sau đây đúng?
Đáp án C
Từ sơ đồ phản ứng hóa học, ta thấy thứ tự thế điện cực trong dãy điện hóa như sau:
\({{Y}^{2+}}\) \({{X}^{2+}}\) \({{Y}^{3+}}\)
Y X \({{Y}^{2+}}\)
Nên \({{Y}^{3+}}\) có tính oxi hóa mạnh hơn \({{X}^{2+}}\).
Chất nào trong các chất: dầu mè (1), mỡ bò (2), dầu nhớt (3), bơ (4), sữa chua (5) là lipit?
Đáp án C
Lipit gồm: đầu mỡ, mỡ bò, bơ.
Dầu nhớt thành phần chính là hiđrocacbon.
Sữa chua chứa nhiều axit lactic.
Cho các phát biểu sau:
(a) Đốt cháy hoàn toàn este no, đơn chức, mạch hở luôn thu được số mol CO2 bằng số mol H2O.
(b) Trong hợp chất hữu cơ nhất thiết phải có cacbon và hiđro.
(c) Những hợp chất hữu cơ có thành phần nguyên tố giống nhau, thành phần phân từ hơn kém nhau một hay nhiều nhóm CH2 là đồng đẳng của nhau.
(d) Dung dịch glucozơ bị khử bởi AgNO3 trong NH3 tạo ra Ag.
(e) Saccarazơ chỉ có cấu tạo mạch vòng.
Số phát biểu đúng là
Đáp án A
Những phát biểu đúng: (a), (e).
(b) sai vì hợp chất hữu cơ nhất thiết phải có cacbon, thường có hiđro. Ví dụ: CCl4.
(c) sai vì những chất hữu cơ đó phải có tính chất tương tự nhau thì mới là đồng đẳng của nhau.
(d) sai vì glucozơ bị AgNO3 oxi hóa.
Để tránh nhầm lẫn khái niệm đồng đẳng thì có thể xem xét ví dụ sau:
\(C{{H}_{2}}=CHCOOC{{H}_{3}}\) và \(HCOOCH=\text{ }C{{H}_{2}}\) có cũng thành phần nguyên tố, thành phần phân tử hơn kém nhau 1 nhóm CH2 nhưng chúng không phải là đồng đẳng của nhau vì: tính chất hóa học đặc trưng là phản ứng thủy phân của 2 chất trên là khác nhau.
Cụ thể, \(C{{H}_{2}}=CHCOOC{{H}_{3}}\) thủy phân trong NaOH sinh ra muối và ancol, còn \(HCOOCH=\text{ }C{{H}_{2}}\) thủy phân trong NaOH sinh ra muối và anđehit.
Cấu hình electron của ion \(F{{e}^{2+}}\) là
Đáp án C
Cấu hình electron của ion \(F{{e}^{2+}}:\left( Ar \right)3{{d}^{6}}\).
Cấu hình electron của ion \(Fe:\left( Ar \right)3{{d}^{6}}4{{s}^{2}}\).
Trộn 20 ml dung dịch AlCl3 1M với 30 ml dung dịch KOH 1M. Sau khi phản ứng kết thúc, khối lượng kết tủa thu được là
Đáp án B
\(\begin{align} & A{{l}^{3+}}+3O{{H}^{-}}\to Al{{\left( OH \right)}_{3}} \\ & 0,02\,\,\,\,\,0,03 \\ \end{align}\)
\(\to A{{l}^{3+}}\) dư
\({{n}_{Al{{\left( OH \right)}_{3}}}}=\frac{1}{3}{{n}_{O{{H}^{-}}}}=0,01\)mol
\({{m}_{Al{{\left( OH \right)}_{3}}}}=0,78\)gam
Để xà phòng hoá hoàn toàn 35,2 gam hỗn hợp hai este no, đơn chức, mạch hở là đồng phân của nhau cần vừa đủ 400 ml dung dịch KOH 1M. Biết cả hai este này đều không tham gia phản ứng tráng bạc. Công thức của hai este là
Đáp án D
\({{M}_{este}}=\frac{{{m}_{este}}}{{{n}_{este}}}=\frac{35,2}{0,4}=88\)
\(\to \) 2 este có công thức phân tử là \({{C}_{4}}{{H}_{8}}{{O}_{2}}\)
Vì cả 2 este đều không tham gia phản ứng tráng bạc nên 2 este là: C2H5COOCH3 và CH3COOC2H5
Phát biểu nào sau đây đúng?
Đáp án A
B sai vì phản ứng có thể sinh ra anđehit, xeton và nước.
C sai vì thủy phân chất béo thu được glixerol có công thức C3H5(OH)3 .
D sai vì phản ứng giữa axit và ancol (có mặt H2SO4 xúc tác) là phản ứng thuận nghịch.
Cho các dung dịch sau: Ba(HCO3)2 , NaOH, AlCl3, KHSO4 được đánh số ngẫu nhiên là X, Y, Z, T. Tiến hành các thí nghiệm sau:
Đáp án B
|
Hóa chất |
Ba(HCO3)2 |
KHSO4 |
NaOH |
AlCl3 |
|
Quỳ tím |
Xanh |
Đỏ |
Xanh |
Đỏ |
|
Dung dịch HCl |
CO2 |
Đồng nhất |
Đồng nhất |
Đồng nhất |
|
Dung dịch Ba(OH)2 |
BaCO3 |
BaSO4 |
Đồng nhất |
Al(OH)3, kết tủa tan. |
Cho \({{V}_{1}}\)ml dung dịch NaOH 0,4M vào \({{V}_{2}}\) ml dung dịch H2SO4 0,6M. Sau khi kết thúc phản ứng thu được dung dịch chỉ chứa một chất tan duy nhất. Tỉ lệ \({{V}_{1}}:{{V}_{2}}\) là
Đáp án D
Dung dịch chỉ chứa một chất tan duy nhất: Na2SO4 nên phản ứng trung hòa xảy ra vừa đủ.
\({{H}^{+}}+O{{H}^{-}}\to {{H}_{2}}O\)
\({{n}_{O{{H}^{-}}}}={{n}_{NaOH}}=0,4{{V}_{1}}\)
\({{n}_{{{H}^{+}}}}=2{{n}_{{{H}_{2}}S{{O}_{4}}}}=2.0,6{{V}_{2}}=1,2{{V}_{2}}\)
Vì \({{n}_{{{H}^{+}}}}={{n}_{O{{H}^{-}}}}\to 0,4{{V}_{1}}=1,2{{V}_{2}}\to {{V}_{1}}:{{V}_{2}}=3:1\)
Đun nóng hỗn hợp X gồm 0,1 mol etilen; 0,1 mol vinyl axetilen và 0,3 mol hiđro với xúc tác Ni một thời gian, thu được hỗn hợp Y có tỉ khối so với hiđro bằng 10,75. Cho toàn bộ Y vào dung dịch brom dư thấy có tối đa a mol brom phản ứng. Giá trị của a là
Đáp án A
BTKL: \({{m}_{X}}={{m}_{Y}}={{m}_{{{C}_{2}}{{H}_{4}}}}+{{m}_{{{C}_{4}}{{H}_{4}}}}+{{m}_{{{H}_{2}}}}=8,6\)gam
\(\to {{n}_{Y}}=\frac{8,6}{21,5}=0,4\) mol
nHiđrocacbon(Y) = nHiđrocacbon(X) = 0,2 mol
\({{n}_{{{H}_{2}}}}\)(dư) = nY - nHiđrocacbon(Y) = 0,2 mol
\({{n}_{{{H}_{2}}}}\)(phản ứng) = nX - \({{n}_{{{H}_{2}}}}\)(dư) = \(0,3-0,2=0,1\)mol
\({{n}_{\sigma \left( X \right)}}={{n}_{{{C}_{2}}{{H}_{4}}}}+3{{n}_{{{C}_{4}}{{H}_{4}}}}=0,4\)mol
\({{n}_{\pi \left( Y \right)}}={{n}_{\pi \left( X \right)}}-{{n}_{{{H}_{2}}\left( phan\,ung \right)}}=0,3\)mol.
\(\to a={{n}_{B{{r}_{2}}}}={{n}_{\delta \left( Y \right)}}=0,3\)mol
Trong bài tập hiđrocacbon về thực hiện phản ứng no hóa hiđrocacbon không no bằng \({{H}_{2}}\) và \(B{{r}_{2}}\) thì cần lưu ý: \({{n}_{\pi }}={{n}_{B{{r}_{2}}}}+{{n}_{{{H}_{2}}}}\)
Hấp thụ hoàn toàn 4,48 lít khí CO2 (ở đktc) vào 500ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra m gam kết tủa. Giá trị của m là
Đáp án D
\(\frac{{{n}_{O{{H}^{-}}}}}{{{n}_{C{{O}_{2}}}}}=\frac{{{n}_{NaOH}}+2{{n}_{Ba{{\left( OH \right)}_{2}}}}}{{{n}_{C{{O}_{2}}}}}=\frac{0,1.0,5+2.0,2.0,5}{0,2}=1,25\)
\(\to \)Tạo 2 muối:
\(\left\{ \begin{align} & HCO_{3}^{-}:a \\ & CO_{3}^{2-}:b \\ \end{align} \right.\)
\(C{{O}_{2}}+O{{H}^{-}}\to HCO_{3}^{-}\)
\(C{{O}_{2}}+2O{{H}^{-}}\to CO_{3}^{2-}\)
\( \to \left\{ \begin{array}{l} a + b = 0,2\left( {{n_{C{O_2}}}} \right)\\ a + 2b = 0,25\left( {{n_{O{H^ - }}}} \right) \end{array} \right. \to \left\{ \begin{array}{l} a = 0,15\\ b = 0,05 \end{array} \right.\)
\(\to {{n}_{BaC{{O}_{3}}}}={{n}_{B{{a}^{2+}}}}=0,1\)
\(\to {{m}_{BaC{{O}_{3}}}}=19,7\) gam
Đối với dạng bài này, có 2 điều cần lưu ý:
\(T-\frac{{{n}_{OH}}}{{{n}_{C{{O}_{2}}}}}\)
\(T\le 1\) tạo muối \(HCO_{3}^{-}\)
\(T\ge 2\) tạo muối\(CO_{3}^{2-}\)
Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: axetilen, axetanđehit, etanol, axit axetic. Nhiệt độ sôi của chúng được ghi lại trong bảng sau:
Đáp án B
Dựa vào nhiệt độ sôi: axetilen < axetanđehit < etanol < axit axetic.
Vậy X: axetanđehit, Y: etanol, Z: axetilen, T: axit axetic.
Những phát biểu đúng: (b); (d)
(a) sai vì axetilen chỉ tham gia phản ứng thế với AgNO3/NH3 , chứ không tham gia phản ứng tráng bạc.
(b) đúng vì đây là phản ứng giữa axit hữu cơ và bazơ.
(c) sai vì \(C{{H}_{3}}CHO+2,5{{O}_{2}}\to 2C{{O}_{2}}+2{{H}_{2}}O\) nên số mol CO2 bằng số mol H2O.
(d) đúng.
So sánh nhiệt độ sôi dựa vào liên kết hiđro:
\({{C}_{x}}{{H}_{y}}<ete<{{C}_{x}}{{H}_{y}}Cl<anehit<xeton<este<a\min <ancol<axit\)
Điện phân dung dịch chứa m gam hỗn hợp gồm KCl và CuSO4 bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi I = 5A, sau thời gian t giây ở anot thu được 2,24 lít (đktc) hỗn hợp khí X có tỉ khối so với He bằng 13,85. Nếu thời gian 2t giây, thể tích khí thoát ra ở anot gấp đôi thể tích khí thoát ra ở catot (đo cùng điều kiện). Các khí sinh ra không tan trong dung dịch và hiệu suất quá trình điện phân đạt 100%. Giá trị của m là
Đáp án C
Sau thời gian t giây:
Hỗn hợp khí ở anot gồm:
\(\left\{ \begin{array}{l} C{l_2}:a\\ {O_2}:b \end{array} \right. \to \left\{ \begin{array}{l} a + b = 0,1\\ 71a + 32b = 0,1.13,85.4 \end{array} \right. \to \left\{ \begin{array}{l} a = 0,06\\ b = 0,04 \end{array} \right.\)
Thứ tự điện phân:
\(C{{u}^{2+}}+2e\to Cu\)
\(\begin{align} & 2C{{l}^{-}}\to C{{l}_{2}}+2e \\ & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,06\,\,\,0,12 \\ \end{align}\)
\(\begin{align} & 2{{H}_{2}}O\to 4{{H}^{+}}+{{O}_{2}}+4e \\ & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,16\,\,\,\,\,0,04\,\,0,16 \\ \end{align}\)
\({{n}_{e}}=0,12+0,16=0,28\)
Sau thời gian 2t giây:
\({{n}_{e}}=2{{n}_{e\left( 1 \right)}}=0,56\)
Thứ tự điện phân:
\(C{{u}^{2+}}+2e\to Cu\)
\(\begin{align} & 2C{{l}^{-}}\to C{{l}_{2}}+2e \\ & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,06\,\,\,0,12 \\ \end{align}\)
\(2{{H}_{2}}O+2e\to 2O{{H}^{-}}+{{H}_{2}}\)
\(2{{H}_{2}}O\to 4{{H}^{+}}+{{O}_{2}}+4e\)
\({{n}_{e}}=2{{n}_{e\left( 1 \right)}}=0,56\to {{n}_{{{O}_{2}}}}=\frac{0,56-0,12}{4}=0,11\)
\({{n}_{\uparrow anot}}=2{{n}_{\uparrow canot}}\to {{n}_{{{H}_{2}}}}=\frac{0,06+0,11}{2}=0,085\)
\({{n}_{e}}=2{{n}_{e\left( 1 \right)}}=0,56\to {{n}_{Cu}}=\frac{0,56-2.0,085}{2}=0,195\)
\(\to \left\{ \begin{align} & CuS{{O}_{4}}:0,195\left( {{n}_{Cu}} \right) \\ & KCl:0,12\left( {{n}_{C{{l}^{-}}}} \right) \\ \end{align} \right.\to m=40,14\) gam
Hỗn hợp X chứa ba este mạch hở được tạo bởi các ancol no gồm hai este đơn chức và một este hai chức (trong đó có hai este có cùng số nguyên tử C và cùng số liên kết \(\pi \) \(C-C\)). Hidro hóa hoàn toàn 0,2 mol X cần dùng 0,24 mol H2 (xúc tác Ni, \({{t}^{0}}\)) thu được hỗn hợp Y. Đun nóng Y với dung dịch NaOH vừa đủ, thu được hỗn hợp Z gồm hai ancol và 23,08 gam hỗn hợp T gồm 2 muối của axit đơn chức. Đốt cháy hoàn toàn Z cần dùng 0,72 mol O2, thu được CO2 và 12,78 gam H2O. Phần trăm về khối lượng của este đơn chức có khối lượng phân tử lớn trong hỗn hợp X là
Đáp án C
Hỗn hợp T gồm 2 muối của axit đơn chức nên X chứa este 2 chức được tạo thành từ ancol 2 chức.
\( \to {n_X} = {n_{ancol}} = 0,2\)
\(0,2Z: \to \left\{ \begin{array}{l} {H_2}O:0,71\\ C{O_2}:{n_{C{O_2}}} = {n_{{H_2}O}} - {n_Z} = 0,51\left( {ancol\,\,no} \right) \end{array} \right.\)
BT O:
\({n_{O\left( Z \right)}} = 2{n_{C{O_2}}} + {n_{{H_2}O}} - 2{n_{{O_2}}} = 0,29\)
\( \to \left\{ \begin{array}{l} {n_{{C_n}{H_{2n + 2}}O}}:x\\ {n_{{C_m}{H_{2m + 2}}O}}:y \end{array} \right. \to \left\{ \begin{array}{l} x + y = 0,2\\ x + 2y = 0,29 \end{array} \right. \to \left\{ \begin{array}{l} x = 0,11\\ y = 0,09 \end{array} \right.\)
\(\begin{array}{l} \to n.0,11 + m.0,09 = 0,51 \to \left\{ \begin{array}{l} n = 3\\ m = 2 \end{array} \right. \to Z\left\{ \begin{array}{l} {C_3}{H_7}OH:0,11\\ {C_2}{H_4}{\left( {OH} \right)_2}:0,09 \end{array} \right.\\ {n_{NaOH}} = {n_{O\left( Z \right)}} = 0,29 \to {n_T} = {n_{NaOH}} = 0,29 \to \overline {{M_T}} = 79 \end{array}\)
Vậy trong T chứa muối HCOONa
\(\left\{ \begin{array}{l}
{n_{RCOONa}} = 0,12\\
{n_{HCOONa}} = 0,17
\end{array} \right. \to 0,12.\left( {R + 67} \right) + 0,17.68 = 23,08 \to R = 29\)
Lúc này trong Y gồm các este no, trong X các este không no được tạo thành từ axit không no (vì ancol no) nên A không thể được tạo thành từ este không no. Vậy 2 este B, C là 2 este cùng số nguyên tử cacbon và cùng số liên kết C - C
TH1: Este có 1 liên kết C - C.
\(\left\{ \begin{array}{l} {n_{RCOONa}} = 0,24\\ {n_{HCOONa}} = 0,05 \end{array} \right. \to 0,24.\left( {R + 67} \right) + 0,05.68 = 23,08 \to R = 15\) (loại vì este phải không no).
TH2: Este có 2 liên kết C - C .
\(\left\{ \begin{array}{l} {n_{RCOONa}} = 0,12\\ {n_{HCOONa}} = 0,17 \end{array} \right. \to 0,12.\left( {R + 67} \right) + 0,17.68 = 23,08 \to R = 29\)
Vậy hỗn hợp este ban đầu gồm
\( \to \left\{ \begin{array}{l} A:HCOO{C_3}{H_7}:0,17 - 0,09 = 0,08\\ B:CH \equiv C - COO{C_3}{H_7}:0,12 - 0,09 = 0,03\\ C:CH \equiv C - COO{C_2}{H_4}OOCH:0,09 \end{array} \right.\)
Nung 5,54 g hỗn hợp X gồm Fe3O4, CuO và Al đến phản ứng hoàn toàn được hỗn hợp rắn Y. Hòa tan hết Y trong dung dịch HCl dư thì lượng H2 sinh ra tối đa là 0,06 mol. Nếu cho Y vào dung dịch NaOH dư thì thấy còn 2,96 g chất rắn không tan. Phần trăm khối lượng của Al trong X là
Đáp án A
Trường hợp 1: Al hết, Y chứa Fe, Cu, Al2O3, có thể có Fe3O4, CuO.
\({{n}_{Fe}}={{n}_{{{H}_{2}}}}=0,06\to {{m}_{Fe}}=3,36\)
Y tác dụng với NaOH dư còn 2,96 gam rắn gồm Fe, Cu, có thể Fe3O4, CuO nhưng \({{m}_{Fe}}=3,36>2,96\) nên trường hợp này không đúng.
Trường hợp 2: Al dư, Y chứa Fe, Cu, Al2O3, Al dư.
Khí H2 sinh ra từ phản ứng Al, Fe với HCl nên:
\(2x+3y=0,06.2\left( 1 \right)\)
Ta có: \(56x+64z=2,96\left( 2 \right)\)
BT O: \({{n}_{A{{l}_{2}}{{O}_{3}}}}=\frac{4{{n}_{F{{e}_{3}}{{O}_{4}}}}+{{n}_{CuO}}}{3}=\frac{4.\frac{x}{3}+z}{3}\)
BTKL Y: \(56x+64z+102.\frac{4.\frac{x}{3}+z}{3}+27y=5,54\left( 3 \right)\)
Từ \(\left( 1 \right),\left( 2 \right),\left( 3 \right)\to \left\{ \begin{align} & x=0,03 \\ & y=0,02 \\ & z=0,02 \\ \end{align} \right.\)
\(\to {{n}_{A{{l}_{2}}{{O}_{3}}}}=0,02\)
BT Al: \({{n}_{Al\left( X \right)}}=2{{n}_{A{{l}_{2}}{{O}_{3}}}}+{{n}_{Al\left( Y \right)}}=0,06\)
\(\to %{{m}_{Al}}=29,24%\)
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho vào cốc thủy tinh chịu nhiệt khoảng 5 gam mỡ lợn và 10 ml dung dịch NaOH 40%.
Bước 2: Đun sôi nhẹ hỗn hợp, liên tục khuấy đều bằng đũa thủy tinh khoảng 30 phút và thỉnh thoảng thêm nước cất để giữ cho thể tích hỗn hợp không đổi. Để nguội hỗn hợp.
Bước 3: Rót thêm vào hỗn hợp 15 - 20 ml dung dịch NaCl bão hòa nóng, khuấy nhẹ. Để yên hỗn hợp.
Cho các phát biểu sau:
(a) Sau bước 3 thấy có lớp chất rắn màu trắng nổi lên là glixerol.
(b) Vai trò của dung dịch NaCl bão hòa ở bước 3 là để tách muối natri của axit béo ra khỏi hỗn hợp.
(c) Ở bước 2, nếu không thêm nước cất, hỗn hợp bị cạn khô thì phản ứng thủy phân không xảy ra.
(d) Ở bước 1, nếu thay mỡ lợn bằng dầu dừa thì hiện tượng thí nghiệm sau bước 3 vẫn xảy ra tương tự.
(e) Trong công nghiệp, phản ứng ở thí nghiệm trên được ứng dụng để sản xuất xà phòng và glixerol.
Số phát biểu đúng là
Đáp án D
Những phát biểu đúng: (b), (c), (d), (e).
(a) sai vì chất rắn màu trắng nổi lên là xà phòng.
(b) Muối natri của axit béo không tan trong NaCl bão hòa nên tách được muối ra khỏi hỗn hợp.
(d) đúng vì dầu dừa cũng là một loại chất béo.
Tiến hành thí nghiệm với bốn dung dịch muối X, Y, Z và T chứa trong các lọ riêng biệt, kết quả được ghi nhận ở bảng sau:
Đáp án C
Cho dung dịch Ba(OH)2 vào T thấy xuất hiện kết tủa và có bọt khí thoát ra → Loại đáp án A do Ba(OH)2 tác dụng với Fe(NO3)2 chỉ tạo kết tủa.
Cho dung dịch H2SO4 loãng vào X thấy xuất hiện kết tủa và có bọt khí thoát ra → Loại đáp án B. Loại đáp án D do chỉ có bọt khí thoát ra.
– Vậy chỉ có đáp án C thỏa mãn, các dung dịch X, Y, Z, T lần lượt là Ca(HCO3)2, Fe(NO3)2, (NH4)2SO4, (NH4)2CO3.
Cho các phát biểu sau:
(1) Anđehit vừa có tính oxi hóa vừa có tính khử.
(2) Phenol tham gia phản ứng thế brom khó hơn benzen.
(3) Amin bậc 2 có lực bazơ mạnh hơn amin bậc 1.
(4) Chỉ dùng dung dịch KMnO4 có thể phân biệt được toluen, benzen và stiren.
(5) Anilin có tính bazơ nên dung dịch anilin trong nước làm quỳ tím hóa xanh.
(6) Trong công nghiệp, chất béo được dùng để sản xuất glixerol và xà phòng.
(7) Đun nóng axit axetic với ancol isoamylic trong H2SO4 đặc thu được sản phẩm có mùi chuối chín.
Số phát biểu luôn đúng là
Đáp án đúng: D
Các phát biểu đúng là: (1), (4), (6), (7).
Có 3 dung dịch riêng biệt: H2SO4 1M; KNO3 1M; HNO3 1M được đánh số ngẫu nhiên là (1), (2), (3). Tiến hành các thí nghiệm sau:
Trộn 5 ml dung dịch (1) với 5 ml dung dịch (2), thêm bột Cu dư, thu được V1 lít khí NO.
Trộn 5 ml dung dịch (1) với 5 ml dung dịch (3), thêm bột Cu dư, thu được 2V1 lít khí NO.
Trộn 5 ml dung dịch (2) với 5 ml dung dịch (3), thêm bột Cu dư, thu được V2 lít khí NO.
Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm khử duy nhất, các thể tích khí đo ở cùng điều kiện.
So sánh nào sau đây đúng?
Đáp án C
Thí nghiệm 1: \((1)+(2)+Cu\,\to {{\text{V}}_{1}}\,l\acute{i}t\,NO\)
Thí nghiệm 2: \((1)+(3)+Cu\,\,\to 2{{V}_{1}}\,\text{l }\!\!\acute{\mathrm{i}}\!\!\text{ t NO}\)
Từ đó, dễ nhận thấy: Lượng H+ ở dung dịch (3) gấp đôi lượng H+ ở dung dịch (2).
Suy ra, (1) (2) (3) lần lượt là: KNO3, HNO3, H2SO4.
Xét phản ứng: \(3Cu+8{{H}^{+}}+2NO_{3}^{-}\to 3C{{u}^{2+}}+2NO+4{{H}_{2}}O\). Kết hợp dữ kiện ở thí nghiệm (1) và (3), dễ thấy: \({{V}_{2}}=3{{V}_{1}}\)
Từ chất X (C10H10O4, chỉ có một loại nhóm chức) tiến hành các phản ứng (theo đúng tỉ lệ mol):
(a) \(X+3NaOH\to Y+Z+T+{{H}_{2}}O\)
(b) \(2Y+{{H}_{2}}S{{O}_{4}}\to 2E+N{{a}_{2}}S{{O}_{4}}\)
(c) \(2E+{{C}_{2}}{{H}_{4}}{{\left( OH \right)}_{2}}\rightleftarrows F+2{{H}_{2}}O\)
Biết MY Z T sai?
Đáp án A
– X có \({{k}_{x}}=\frac{2C-H+2}{2}=\frac{2.10-10+2}{2}=6\), X chỉ chứa 1 loại nhóm chức và có khả năng tác dụng với NaOH → X chứa 2 nhóm -COO- (do trong X có 4 nguyên tử oxi).
– X tác dụng với NaOH theo tỉ lệ mol 1 : 3 đồng thời sau phản ứng thủy phân thu được H2O→ X có 1 nhóm -COO- gắn trực tiếp vào vòng benzen.
– Mặt khác, MY Z T
– MY Z T → Y: HCOONa; Z: CH3COONa; T: \(HO-C{{H}_{2}}-{{C}_{6}}{{H}_{4}}-ONa\); E: HCOOH.
– Ở phản ứng (c) sau phản ứng thu được 2 phân tử H2O nên F có CTCT thu gọn là (HCOO)2C2H4.
A. Sai. Các CTCT thỏa mãn X
\(\begin{align}
& \left( o,m,p- \right)HCOO-C{{H}_{2}}-{{C}_{6}}{{H}_{4}}-OOCC{{H}_{3}} \\
& \left( o,m,p- \right)C{{H}_{3}}COO-C{{H}_{2}}-{{C}_{6}}{{H}_{4}}-OOCH \\
\end{align}\)
→ X có 6 công thức cấu tạo thỏa mãn.
B. Đúng. F là (HCOO)2C2H4 → Có chứa 6 nguyên tử hiđro trong phân tử.
C. Đúng. Đun Z (CH3COONa) với vôi tôi xút, thu được khí CH4 (M = 16) → nhẹ hơn không khí.
D. Đúng. T có chứa nhóm –OH nên có khả năng tác dụng với Na giải phóng khí H2.
Tiến hành điện phân dung dịch chứa a mol CuSO4 và b mol NaCl bằng dòng điện một chiều có cường độ 2A (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước). Gọi V là tổng thể tích khí (đktc) thoát ra ở cả hai điện cực. Quá trình điện phân được mô tả theo đồ thị sau:
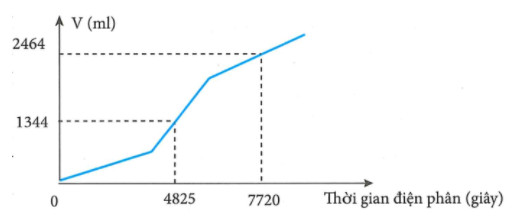
Tỉ lệ a : b là:
Đáp án đúng: B
Giai đoạn 1:
Catot: \(C{{u}^{2+}}+2e\to Cu\), Anot: \(2C{{l}^{-}}\to C{{l}_{2}}+2e\).
→ 2 mol e ứng với 1 mol khí sinh ra ở cả hai điện cực.
Giai đoạn 2: Có hai trường hợp xảy ra.
+ Trường hợp 1: \(C{{l}^{-}}\) bị điện phân hết trước Cu2+.
Catot: \(C{{u}^{2+}}+2e\to Cu\); Anot: \({{H}_{2}}O\to 2{{H}^{+}}+0,5{{O}_{2}}+2e\)
2 mol e ứng với 0,5 mol khí sinh ra ở cả hai điện cực.
+ Trường hợp 2: Cu2+ bị điện phân hết trước \(C{{l}^{-}}\).
Catot: \(2{{H}_{2}}O+2e\to 2O{{H}^{-}}+1{{H}_{2}}\); Anot: \(2C{{l}^{-}}\to 1C{{l}_{2}}+2e\)
2 mol e ứng với 2 mol khí sinh ra ở cả hai điện cực.
Nhìn vào đường gấp khúc của đồ thị, ta thấy đoạn hai dốc hơn đoạn một, do đó trường hợp xảy ra là trường hợp 2.
Số mol Cl2 thu được trong giai đoạn 1 là a. Gọi x là số mol Cl2 thu được từ khi Cu2+ bị điện phân hết cho đến thời điểm t1 = 4825s.
Ta có hệ:
\(\left\{ \begin{array}{l} {n_{e(1)}} = 2a + 2x = \frac{{2.4825}}{{96500}}\\ {n_{kh\mathop i\limits^ (1)}} = a + 2x = \frac{{1,344}}{{22,4}} \end{array} \right. \to \left\{ \begin{array}{l} a = 0,04\\ x = 0,01 \end{array} \right.\)
Giai đoạn 3: \({{H}_{2}}O\to {{H}_{2}}+0,5{{O}_{2}}\)
Gọi y là số mol Cl2 thu được trong giai đoạn 2, z là số mol H2O bị điện phân cho đến thời điểm \({{t}_{2}}=7720s.\)
Ta có hệ:
\(\left\{ \begin{array}{l} {n_{e(2)}} = 2.0,04 + 2y + 2z = \frac{{2.7720}}{{96500}}\\ {n_{kh\mathop i\limits^ (2)}} = 0,04 + 2y + 1,5z = \frac{{2,464}}{{22,4}} \end{array} \right. \to \left\{ \begin{array}{l} y = 0,02\\ z = 0,02 \end{array} \right.\)
\(b=2.0,04+2.0,02=0,12\to a:b=0,04:0,12=1:3\)
Dẫn 4,48 lít CO (đktc) đi qua m gam hỗn hợp oxit nung nóng gồm MgO, Al2O3, Fe2O3 và CuO. Sau một thời gian, thu được hỗn hợp rắn X và hỗn hợp khí Y có tỉ khối so với H2 là 20,4. Cho X tan hoàn toàn trong dung dịch HCl (loãng), thu được dung dịch Z chỉ chứa (2m – 4,36) gam muối và thoát ra 1,792 lít (đktc) khí H2. Cho Z tác dụng hoàn toàn với dung dịch AgNO3 dư, thu được (5m + 9,08) gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây?
Đáp án C
Xét phản ứng \(CO+O\to C{{O}_{2}}\), cứ bao nhiêu mol CO mất đi thì có bấy nhiêu mol \(C{{O}_{2}}\) tạo thành, như vậy số mol khí không đổi.
Gọi \(\left\{ \begin{array}{l}
{n_{\frac{{CO}}{Y}}} = x\\
{n_{C{O_2}}} = y
\end{array} \right. \to \left\{ \begin{array}{l}
x + y = 0,2\\
28x + 44y = 20,4.2.0,2
\end{array} \right. \to \left\{ \begin{array}{l}
x = 0,04\\
y = 0,16
\end{array} \right. \to {m_x} = m – 2,56\)
Sau khi phản ứng với AgNO3 dư, Fe có mức oxi hóa +3, không thay đổi so với hỗn hợp ban đầu, nên tổng số mol electron trao đổi của các chất oxi hóa phải bằng số mol electron trao đổi của các chất khử, cụ thể \(2{{n}_{CO}}={{n}_{Ag}}+2{{n}_{{{H}_{2}}}}\), trong đó CO là lượng đã phản ứng.
\(\to 0,16.2 = {n_{Ag}} + 0,08.2 \to {n_{Ag}} = 0,16 \to {n_{AgCl}} = \frac{{5m + 9,08 – 0,16.108}}{{143,5}}\)
Gọi \({{n}_{{}^{O}/{}_{X}}}=a\to {{n}_{HCl}}=2{{n}_{{}^{O}/{}_{X}}}+2{{n}_{{{H}_{2}}}}=2a+0,16\)
\(\to 2a+0,16=\frac{5m+9,08-0,16.108}{143,5}(1)\)
\({{n}_{{{H}_{2}}O}}={{n}_{\frac{O}{X}}}=a\to {{m}_{X}}+{{m}_{HCl}}={{m}_{Z}}+{{m}_{{{H}_{2}}}}+{{m}_{{{H}_{2}}O}}\)
\(\to m-2,56+36,5\left( 2a+0,16 \right)=2m-4,36+0,16+18a\,\,(2)\)
→ Từ (1) và (2)
\( \to \left\{ \begin{array}{l}
m = 36,08\\
a = 0,52
\end{array} \right.\)
Hỗn hợp X gồm một axit cacboxylic T (hai chức, mạch hở, có đồng phân hình học), hai ancol đơn chức cùng dãy đồng đẳng và một este hai chức tạo bởi T với hai ancol đó. Đốt cháy hoàn toàn a gam X, thu được 139,7 gam CO2. Mặt khác, đun nóng a gam X với 600 ml dung dịch KOH 2M, sau khi phản ứng xảy ra hoàn toàn, thêm tiếp 200 ml dung dịch HCl 1M để trung hòa vừa đủ lượng KOH dư, thu được dung dịch Y. Cô cạn Y, thu được m gam muối khan và 0,35 mol hỗn hợp hai ancol có phân tử khối trung bình nhỏ hơn 46. Giá trị của m gần nhất với giá trị nào sau đây?
Đáp án D
Theo bài ra ta có:
\({n_{ – COO – }} = 1,2 – 0,2 = 1\,mol\).
Vì T là axit cacboxylic hai chức, mạch hở, có đồng phân hình học nên \({C_T} \ge 4\)
Tiến hành quy đổi hỗn hợp X thành axit, ancol và H2O, ta được:
Theo BT.C: \(0,5{C_T} + 0,35\overline n = 3,175\)
Khi đó: \(m = \underbrace {{m_{{C_3}{H_4}{{(COOK)}_2}}}}_{206.0,5} + \underbrace {{m_{KCl}}}_{74,5.0,2} = 117,9(gam)\)
Cho 2 peptit X, Y (MX Y) và este Z (X, Y, Z đều mạch hở; X, Y đều được tạo từ Gly và Ala; Z có không quá 3 liên kết trong phân tử và được tạo từ phản ứng giữa axit cacboxylic và ancol). Đốt cháy hoàn toàn x mol X hoặc y mol Y hoặc z mol Z đều thu được hiệu số mol CO2 và H2O là 0,06 mol. Mặt khác, thủy phân hoàn toàn 42,34 gam hỗn hợp E gồm X (x mol), Y (y mol), Z (z mol) trong dung dịch KOH vừa đủ, cô cạn dung dịch sau phản ứng, thu được 1,86 gam ancol T và 72,32 gam hỗn hợp muối. Phần trăm khối lượng của Y trong E là
Đáp án A
Xét hai trường hợp
Trường hợp 1: Phân tử Z có 2 liên kết \(\pi \to {{n}_{z}}={{n}_{C{{O}_{2}}}}-{{n}_{{{H}_{2}}O}}=0,06\left( mol \right)\)
Ta có: \({{M}_{T}}=\frac{1,86}{0,06k}=\frac{31}{k}\to \) Không có ancol T thỏa mãn.
Trường hợp 2: Phân tử Z có 3 liên kết \(\pi \to {{n}_{z}}=\frac{{{n}_{C{{O}_{2}}}}-{{n}_{{{H}_{2}}O}}}{2}=0,03\left( mol \right)\)
Ta có: \({{M}_{T}}=\frac{1,86}{0,03k}=\frac{62}{k}\to \) T là C2H4(OH)2.
→ Z có dạng \({{C}_{m}}{{H}_{2m-1}}COO{{C}_{2}}{{H}_{4}}OOC{{C}_{n}}{{H}_{2n+1}}\)
Quy đổi hỗn hợp E
Dễ thấy CH2 không ảnh hưởng tới hiệu số mol CO2 và H2O, ta có hệ sau:
\(\left\{ \begin{array}{l}
{n_{C{O_2}(X,Y)}} – {n_{{H_2}O(X,Y)}} = 0,5a – b = 2.0,06\\
42,34 + 56(a + 0,06) = 1,86 + 18b + 72,32
\end{array} \right. \to \left\{ \begin{array}{l}
a = 0,56\\
b = 0,16
\end{array} \right.(mol)\)
\(\to c=\frac{72,32-113.0,56-\left( 84+110 \right).0,03}{14}=0,23\)
Xét phản ứng đốt cháy một peptit có k mắt xích, ta có:
\(\left\{ \begin{align}
& {{C}_{n}}{{H}_{2n-1}}ON:k \\
& {{H}_{2}}O:1 \\
\end{align} \right.\to {{n}_{C{{O}_{2}}}}-{{n}_{{{H}_{2}}O}}={{n}_{peptit}}.\left( 0,5k-1 \right)(*)\)
Số mắt xích trung bình của peptit là:
\(\overline{mx}=\frac{0,56}{0,16}=3,5\to \) Do \({{n}_{C{{O}_{2}}}}>{{n}_{{{H}_{2}}O}}\to \) X không thể là đipeptit
→ X là tripeptit \(\to {{n}_{X}}=\frac{0,06}{0,5.3-1}=0,12\)
\({{n}_{Y}}=0,16-0,12=0,04\to m{{x}_{Y}}=\frac{0,56-3.0,12}{0,04}=5\to \) Y là pentapeptit.
Tiến hành ghép CH2, ta có:
\(\left\{ \begin{array}{l}
X:Gl{y_3}:0,12\\
Y:Gl{y_5}:0,04\\
Z:{C_6}{H_8}{O_4}:0,03\\
C{H_2}:0,23
\end{array} \right. \to \left\{ \begin{array}{l}
X:Gl{y_2} – Ala:0,12\\
Y:Gl{y_4} – Ala:0,04\\
Z:{C_6}{H_8}{O_4}:0,03\\
C{H_2}:0,07
\end{array} \right. \to \left\{ \begin{array}{l}
X:Gl{y_2} – Ala:0,12\\
Y:Gl{y_3} – Al{a_2}:0,04\\
Z:{C_6}{H_8}{O_4}:0,03
\end{array} \right.\)
\(%{{m}_{Y}}=\frac{0,04.331}{42,34}.100%=31,27%\)
Hòa tan hoàn toàn 43,56 gam hỗn hợp X gồm Mg, CuO, Fe3O4 và FeCO3 (trong đó nguyên tố oxi chiếm 22,04% về khối lượng) vào 960 ml dung dịch HNO3 2M, thu được dung dịch Y chỉ chứa muối và 2,688 lít (đktc) hỗn hợp khí Z gồm N2O, NO và CO2, có tỉ khối so với H2 là 18,5. Cho Y phản ứng tối đa với 1,77 lít dung dịch NaOH 1M (đun nóng), thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 48 gam chất rắn. Phần trăm khối lượng của CuO trong X có giá trị gần nhất với giá trị nào sau đây?
Ta có:
\({n_{O(X)}} = \frac{{43,56.0,2204}}{{16}} = 0,6(mol)\)
\(Z\left\{ \begin{array}{l}
{N_2}O,C{O_2}:a\\
NO:b
\end{array} \right. \to \left\{ \begin{array}{l}
a + b = 0,12\\
44a + 30b = 0,12.2.18,5
\end{array} \right. \to \left\{ \begin{array}{l}
a = 0,06\\
b = 0,06
\end{array} \right.\)
Quy đổi hỗn hợp X, ta có sơ đồ phản ứng sau:
\(X\left\{ \begin{array}{l}
Mg,Fe,Cu\\
O\\
C{O_2}:0,06 – x
\end{array} \right. \to Y\left\{ \begin{array}{l}
K{L^{m + }}\\
NH_4^ + \\
NO_3^ – :1,77
\end{array} \right. + Z\left\{ \begin{array}{l}
{N_2}O:x\\
C{O_2}:0,06 – x\\
NO:0,06
\end{array} \right.\)
\(\begin{array}{l}
\to {n_O} = 0,6 – 2.\left( {0,06 – x} \right) = 2x + 0,48\\
\to {n_{NH_4^ + }} = 1,92 – 1,77 – 2x – 0,06 = 0,09 – 2x
\end{array}\)
\({n_{HN{O_3}}} = 10.\left( {0,09 – 2x} \right) + 10x + 4.0,06 + 2.\left( {2x + 0,48} \right) = 1,92 \to x = 0,03\)
\( \to {n_{C{O_2}}} = 0,06 – 0,03 = 0,03\)
\(\left\{ \begin{array}{l}
{m_x} = 24y + 80z + 232t + 116.0,03 = 43,56\\
{m_{oxit}} = 40y + 80z + 160.\left( {1,5t + 0,015} \right) = 48\\
{n_{O(X)}} = z + 4t + 3.0,03 = 0,6
\end{array} \right. \to \left\{ \begin{array}{l}
y = 0,3\\
z = 0,15\\
t = 0,09
\end{array} \right.\)
\( \to \% {m_{CuO}} = \frac{{80.0,15}}{{43,56}}.100\% = 27,55\% \)

