Đề thi thử THPT QG năm 2022 môn Hóa học - Trường THPT Võ Trường Toản
Đề thi thử THPT QG năm 2022 môn Hóa học - Trường THPT Võ Trường Toản
-
Hocon247
-
40 câu hỏi
-
90 phút
-
47 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Khi cho dung dịch anbumin tác dụng với Cu(OH)2 tạo thành hợp chất có màu
Anbumin (lòng trắng trưng) chính là protein khi tác dụng với Cu(OH)2 sẽ cho hợp chất phức màu tím
Đáp án D
Thủy phân este trong môi trường kiềm được gọi là phản ứng.
Phản ứng thủy phân este trong môi trường kiềm được gọi là phản ứng xà phòng hóa.
Đáp án C
Khi hòa tan vào nước, chất làm cho quỳ tím chuyển màu xanh là
Metyl amin (CH3NH2) hòa tan vào nước có môi trường bazơ nên làm quỳ tím chuyển sang màu xanh
Đáp án B
Kim loại Cu không tan trong dung dịch nào sau đây?
Cu không tan trong dd H2SO4 loãng
Đáp án B
Công thức hóa học của sắt (III) nitrat là
Công thức hóa học của sắt(III) nitrat là: Fe(NO3)3
Đáp án C
Để khử chua cho đất người ta thường sử dụng
Đất chua là đất dư lượng axit (tức H+) => phải bón vôi để khử chua
CaO + H2O → Ca(OH)2
OH- + H+ → H2O
Đáp án B
Chất X có công thức phân tử C4H8O2 tác dụng với NaOH sinh ra chất Y có công thức phân tử C2H3O2Na. Công thức của X là
Y có CTCT là: CH3COONa
=> CTCT của X: CH3COOC2H5
Đáp án D
Dãy gồm các chất đều phản ứng được với Fe(NO3)2 là:
A. Loại KCl không pư
B. Thỏa mãn
AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
3Br2 + 3Fe(NO3)2 → Fe(NO3)3 + 2FeBr3
2NH3 + 2H2O + Fe(NO3)2 → Fe(OH)2 + 2NH4NO3
12HCl + 9Fe(NO3)2 → 5Fe(NO3)3 + 4FeCl3 + 3NO + 6H2O
C. Loại Cu, FeCl3
D. Loại KCl
Đáp án B
Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M. Sau khi phản ứng kết thúc, thể tích khí CO2 thu được là
nHCl = 0,03 (mol)
nNa2CO3 = 0,1.0,2 = 0,02 (mol) ; nNaHCO3 = 0,1.0,2 = 0,02 (mol)
Khi nhỏ từ từ H+ vào dd hỗn hợp CO32- và HCO3- xảy ra phản ứng:
H+ + CO32- → HCO3- (1)
H+ + HCO3- → CO2 + H2O (2)
=> nCO2(2) = ∑nH+ - nCO32- = 0,03 – 0,02 = 0,01 (mol)
=> VCO2(ddktc) = 0,01.22,4 = 0,224 (l) = 224 (ml)
Đáp án A
Cho hỗn hợp X gồm 1 este no, đơn chức Y và 1 ancol đơn chức Z tác dụng vừa đủ với 200 ml dung dịch NaOH 1M, thu được 0,35 mol ancol Z. Khi đun nóng Z với H2SO4 đặc ở nhiệt độ thích hợp thu được chất hữu cơ T có tỉ khối hơi so với Z là 1,7. Mặt khác đốt cháy hoàn toàn X cần dùng 44,24 lít (đktc) khí O2. Công thức phân tử của axit tạo ra Y là
Vì Y no đơn chức và hỗn hợp X + NaOH thu được mỗi ancol Z => ancol Z cũng chính là ancol tạo nên Y
=> ancol Z no, đơn chức
Gọi ancol Z: CmH2m+1OH
Vì MT = 1,7MZ => T là ete
2CmH2m+1OH \(\xrightarrow{{{H_2}S{O_4}\,\,dac}}\) CmH2m+1OCmH2m+1 + H2O
Ta có: \(\frac{{{M_T}}}{{{M_Z}}} = \frac{{28m + 18}}{{14m + 18}} = 1,7 \Rightarrow m = 3\)
=> CTCT ancol Z: C3H7OH
Xét đốt hh X cần 1,975 nO2
Gọi Y: CnH2nO2: 0,2 (mol) ( Vì nY = nNaOH = 0,2)
Z: C3H8O: 0,15 (mol)
CnH2nO2 + (3n-2)/2O2 → nCO2 + nH2O
0,2 → 0,1(3n-2) (mol)
C3H8O + 4,5O2 → 3CO2 + 4H2O
0,15 → 0,675 (mol)
Ta có: ∑nO2 = 0,1.(3n-2) + 0,675 = 1,975
=> 3n – 2= 13
=> n = 5
=> CTPT Y: C5H10O2 => CTCT Y: CH3COOC3H7
Vậy axit tạo ra este Y là: C2H4O2
Đáp án B
Cho dãy các chất : NH2CH(CH3)COOH, C6H5OH (phenol), CH3COOC2H5, C2H5OH, CH3NH3Cl. Số chất trong dãy phản ứng với dung dịch KOH đun nóng là
Các chất có phản ứng với dd KOH đun nóng là:
NH2CH(CH3)COOH , C6H5OH, CH3COOC2H5, CH3NH3Cl => có 4 chất
NH2CH(CH3)COOH + KOH → NH2CH(CH3)COOK + H2O
C6H5OH + KOH → C6H5OK + H2O
CH3COOC2H5 + KOH → CH3COOK + C2H5OH
CH3NH3Cl + KOH → KCl + CH3NH2 + H2O
Đáp án B
Hòa tan 1,12 gam Fe bằng 300 ml dung dịch HCl 0,2M thu được dung dịch X và khí H2. Cho dung dịch AgNO3 dư vào X, thu được khí NO (sản phẩm khử duy nhất của N+5) và m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
nFe = 1,12 : 56 = 0,02 (mol)
nHCl = 0,3.0,2 = 0,06 (mol)
Fe + 2HCl → FeCl2 + H2↑
PƯ 0,02 →0,04→0,02 (mol)
Vậy dd X chứa: FeCl2: 0,02 (mol); HCl dư: 0,02 (mol)
Hay dd X chứa: Fe2+: 0,02 (mol) ; H+: 0,02 (mol); Cl- : 0,06 (mol)
Cho dd X + AgNO3 dư xảy ra pư
Ag+ + Cl- → AgCl↓
0,06→ 0,06 (mol)
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
0,015←0,02
Fe2+ + Ag+ → Fe3+ + Ag↓
(0,02-0,015) → 0,005 (mol)
=> m↓ = mAgCl + mAg = 0,06. 143,5 + 0,005.108 = 9,15 (g)
Đáp án D
Hòa tan hoàn toàn 4,8 gam Mg bằng dung dịch HCl dư thu được V lít khí H2 (đktc). Giá trị của V là
nMg = 4,8 : 24 = 0,2 (mol)
Mg + HCl → MgCl2 + H2↑
0,2 → 0,2 (mol)
=> VH2(ĐKTC) = 0,2× 22,4 = 4,48(l)
Đáp án D
Tên gọi của CH3COOCH2CH3 là
CH3COOCH2CH3 có tên là etyl axetat
Đáp án A
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau:
X làm quỳ tím chuyển đỏ ⟹ X là axit axetic hoặc axit glutamic.
Y tạo kết tủa trắng với dd nước brom ⟹ Y là anilin.
Z có phản ứng tráng bạc ⟹ Z là glucozơ.
T tạo phức màu xanh lam với Cu(OH)2 ⟹ T là saccarozơ.
Từ đáp án X, Y, Z, T lần lượt là: axit glutamic; anilin; glucozơ; saccarozơ.
Đốt cháy hoàn toàn 5,16 gam hỗn hợp X gồm các ancol CH3OH, C2H5OH, C3H7OH, C4H9OH bằng một lượng khí O2 (vừa đủ) thu được 12,992 lít hỗn hợp khí và hơi ở đktc. Sục toàn bộ lượng khí và hơi trên vào bình đựng dung dịch Ca(OH)2 dư thấy khối lượng dung dịch trong bình giảm m gam. Giá trị của m là
* Gọi số mol CO2 và H2O lần lượt là x và y (mol).
Ta có: x + y = 12,992/22,4 = 0,58 (1)
Vì các ancol trong X đều là ancol no, đơn chức, mạch hở ⟹ nO2 = 1,5nCO2 = 1,5x (mol)
BTKL ⟹ 5,16 + 32.1,5x = 44x + 18y (2)
Từ (1) và (2) ⟹ x = 0,24 và y = 0,34
* Sục hỗn hợp CO2 và H2O vào dung dịch Ca(OH)2 dư:
nCaCO3 = nCO2 = 0,24 mol.
Vậy khối lượng dung dịch giảm là ∆m = mCaCO3 – mCO2 – mH2O = 7,32 gam.
Các dung dịch NaCl, HCl, CH3COOH, H2SO4 có cùng nồng độ mol, dung dịch có pH nhỏ nhất là
Dung dịch có pH nhỏ nhất tức là có nồng độ H+ phân li ra nhiều nhất.
Cùng nồng độ các chất thì H2SO4 phân li cho nhiều H+ nhất ⟹ pH nhỏ nhất
Đáp án D
Dung dịch chất nào sau đây không dẫn điện được?
HCl không tan trong benzen nên không phân li ra đươc cation và anion do vậy không dẫn được điện.
Đáp án C
Cho 2,06 gam hỗn hợp X gồm Fe, Al, Zn và Cu tác dụng với dung dịch HNO3 loãng, dư, sau khi phản ứng xảy ra hoàn toàn thu được 0,896 lít khí NO (đktc, sản phẩm khử duy nhất). Khối lượng muối nitrat sinh ra là
nNO = 0,896 : 22,4 = 0,04 (mol)
nNO3-(trong muối) = n e nhường = 3nNO = 0,12 (mol)
=> mmuối = mKL + mNO3- = 2,06 + 0,12.62 = 9,5 (g)
Đáp án B
X là hợp chất hữu cơ chứa nhân thơm có công thức phân tử C7H6O3. Biết X tác dụng với NaOH theo tỉ lệ mol 1 : 3. Số công thức cấu tạo phù hợp với X là
C7H6O3 có độ bất bão hòa k = (7.2 + 2 – 6)/2 = 5
X + NaOH theo tỉ lệ 1: 3 => X phải là este của phenol
CTCT X thỏa mãn là:
HCOOC6H4OH (có 3 vị trí nhóm –OH gắn vào vòng benzen là octor, meta, para) => có 3 CTCT
HCOOC6H4-OH + 3NaOH → HCOONa + NaOC6H4ONa + 2H2O
Đáp án B
Có nhiều loại bánh cần tạo độ xốp, vì vậy trong quá trình nhào bột người ta thường cho thêm hóa chất nào trong số các hóa chất sau:
NH4HCO3 được nhào thêm để tăng độ xốp cho bánh vì khi đun nóng ở nhiệt độ cao bị nhiệt phân tạo theo phương trình:
NH4HCO3 \(\xrightarrow{{{t^0}}}\) NH3↑ + CO2↑ + H2O
Khí NH3 và CO2 thoát ra ngoài làm bánh xốp hơn
Đáp án D
Hỗn hợp X gồm axit axetic và metyl fomat. Cho m gam X tác dụng vừa đủ với 300 ml dung dịch NaOH 0,1M. Giá trị của m là
nNaOH = 0,3. 0,1 = 0,03 (mol)
axit axetic và metyl fomat có cùng CTPT: C2H4O2
nX = nNaOH = 0,03 (mol) => mX = 0,03. 60 = 1,8 (g)
Đáp án C
Cho 14,19 gam hỗn hợp gồm 3 amino axit (phân tử chỉ chứa 1 nhóm NH2 và 1 nhóm COOH) vào dung dịch chứa 0,05 mol axit oxalic, thu được dung dịch X. Thêm tiếp 300ml dung dịch NaOH 1M vào X sau khi phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được 26,19 gam chất rắn khan Y. Hòa tan Y trong dung dịch HCl dư thu được dung dịch chứa m gam muối. Giá trị của m là
\(\left\{ \begin{gathered}
\overbrace {{H_2}N - R - C{\text{OOH}}}^{{\text{14,19(g)}}} \hfill \\
{{\text{(COO}}H)_2}:0,05mol \hfill \\
\end{gathered} \right. + NaOH:0,3 \to \underbrace {Chat\,ran}_{26,19(g)}\, + {H_2}O\)
BTKL: mH2O = m a.a + m(COOH)2 + mNaOH – m chất rắn = 14,19 + 0,05.90 + 0,3.40 – 26,19 = 4,5 gam
=> nH2O = 0,25 mol < nNaOH => NaOH dư, các chất trong X phản ứng hết
nH2O = na.a + 2n(COOH)2 => na.a = 0,25 – 2.0,05 = 0,15 mol
=> M a.a = 14,19 : 0,15 = 94,6 => R = 33,6
Hỗn hợp muối sau phản ứng với HCl gồm:
ClH3N-R-COOH: 0,15 mol
NaCl: 0,3 mol
=> m muối = 0,15(52,5 + R + 45) + 0,3.58,5 = 37,215 gam
Đáp án B
Cho từ từ đến dư dung dịch KOH vào dung dịch hỗn hợp gồm x mol HNO3 và y mol Al(NO3)3, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
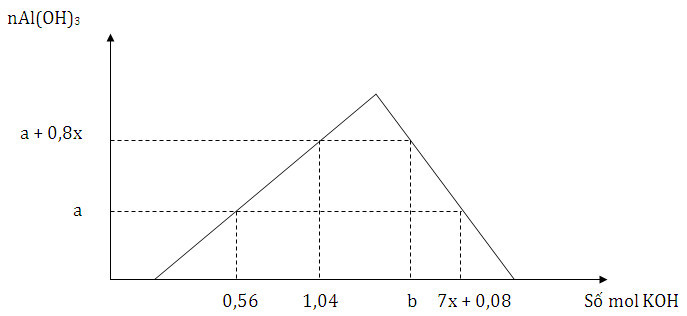
Tỉ lệ b:a có giá trị là
*Tại nKOH = 0,56 mol thì Al(OH)3 chưa đạt cực đại:
nOH- = nH+ + 3nAl(OH)3 ⟹ 0,56 = x + 3a (1)
*Tại nKOH = 1,04 mol thì Al(OH)3 chưa đạt cực đại:
nOH- = nH+ + 3nAl(OH)3 ⟹ 1,04 = x + 3(a + 0,8x) (2)
Giải (1) và (2) được x = 0,2 và a = 0,12
*Tại nKOH = b mol thì kết tủa Al(OH)3 đã bị hòa tan một phần:
nOH- = nH+ + 4nAl3+ - nAl(OH)3 ⟹ b = x + 4y - (a + 0,8x) (3)
*Tại nKOH = 7x + 0,08 mol thì kết tủa đã bị tan một phần:
nOH- = nH+ + 4nAl3+ - nAl(OH)3 ⟹ 7x + 0,08 = x + 4y - a (4)
Giải (1) (2) (3) (4) được a = 0,12; b = 1,32; x = 0,2; y = 0,35
⟹ b : a = 1,32 : 0,12 = 11.
Chia m gam hỗn hợp T gồm các peptit mạch hở thành hai phần bằng nhau. Đốt cháy hoàn toàn phần 1 thu được CO2, N2 và 7,02 gam H2O. Thủy phân hoàn toàn phần 2 thu được hỗn hợp X gồm Ala, Gly, Val. Cho X vào 200 ml dung dịch chứa NaOH 0,5M và KOH 0,6M, thu được dung dịch Y chứa 20,66 gam chất tan. Để tác dụng vừa đủ với Y cần 360 ml dung dịch HCl 1M. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
*Khi cho X tác dụng với NaOH, KOH sau đó tác dụng với HCl:
nHCl = n a.a + nNaOH + nKOH => n a.a = nHCl – nNaOH – nKOH = 0,36 – 0,1 – 0,12 = 0,14 mol
*Xét phản ứng X tác dụng với NaOH và KOH:
n a.a (0,14 mol) < nNaOH + nKOH (= 0,1 + 0,12 = 0,22 mol) => a.a phản ứng hết, bazo dư
Sơ đồ phản ứng:
\(0,14mol\,X\left\{ \begin{gathered}
Ala \hfill \\
Gly \hfill \\
Val \hfill \\
\end{gathered} \right. + \left\{ \begin{gathered}
NaOH:0,1 \hfill \\
KOH:0,12 \hfill \\
\end{gathered} \right. \to 20,66gam\,chat\,tan\, + \,{H_2}O:0,14\)
BTKL: mX = m chất tan + mH2O – mNaOH – mKOH = 20,66 + 0,14.18 – 0,1.40 – 0,12.56 = 12,46 gam
*Quy đổi hỗn hợp X thành:
\(\underbrace {0,14mol\,X}_{12,46\,gam}\left\{ \begin{gathered}
CONH:0,14 \hfill \\
C{H_2}:a(mol) \hfill \\
{H_2}O:0,14 \hfill \\
\end{gathered} \right. \to 0,14.43 + 14a + 0,14.18 = 12,46 \to a = 0,28mol\)
=> nC(X) = 0,14 + 0,28 = 0,42 mol
*Quy đổi ½ hỗn hợp T thành:
nC(T) = nC(X) => nCH2(T) = nCH2(X) = 0,28 mol
\(\frac{1}{2}\,hh\,T\left\{ \begin{gathered}
CONH:0,14 \hfill \\
C{H_2}:0,28 \hfill \\
{H_2}O:b \hfill \\
\end{gathered} \right.\xrightarrow{{ + {O_2}}}{H_2}O:0,39\)
BTNT “H”: b = 0,39 – 0,5.0,14 – 0,28 = 0,04 mol
=> m (1/2 T) = 0,14.43 + 0,28.14 + 0,04.18 = 10,66 gam => mT = 10,66.2 = 21,32 gam
Đáp án D
Hòa tan hết m gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba và BaO (oxi chiếm 8,75% về khối lượng) vào H2O thu được 400 ml dung dịch Y và 1,568 lít H2 (đktc). Trộn 200 ml dung dịch Y với 200 ml dung dịch hỗn hợp gồm HCl 0,2M và H2SO4 0,15M, thu được 400 ml dung dịch có pH = 13. Các phản ứng xảy ra hoàn toàn. Giá trị m gần nhất với giá trị nào sau đây?
*Trộn 200 ml dung dịch Y (chứa y mol OH-) với 200 ml HCl 0,2M và H2SO4 0,15M
nH+ = nHCl + 2nH2SO4 = 0,2.0,2 + 2.0,2.0,15 = 0,1 mol
pH = 13 => pOH = 14 – 13 = 1 => [OH-] = 0,1M
OH- + H+ → H2O
Bđ: y 0,1
Pư: 0,1 ← 0,1
Sau: y – 0,1 0
\( \to \left[ {O{H^ - }} \right] = \frac{{y - 0,1}}{{0,4}} = 0,1 \to y = 0,14\)
=> 400 ml dung dịch Y chứa 0,28 mol OH-
*Hòa tan m gam hỗn hợp X{Na, K, Ba, O: x mol} + H2O → Y{Na+, K+, Ba2+, OH-: 0,28 mol} + H2: 0,07
BT electron: nNa + nK + 2nBa = 2nO + 2nH2 => nNa + nK + 2nBa = 2x + 2.0,07 (1)
BTĐT: nNa+ + nK+ + 2nBa2+ = nOH- => nNa + nK + 2nBa = 0,28 (2)
Từ (1) và (2) => 2x + 2.0,07 = 0,28 => x = 0,07 mol
=> mO = 0,07.16 = 1,12 gam => mX = 1,12.(100/8,75) = 12,8 gam gần nhất với 13 gam
Đáp án C
Đốt cháy hoàn toàn 0,6 mol hỗn hợp E chứa ancol X, este đơn chức Y và andehit Z (X, Y, Z đều no, mạch hở và có cùng số nguyên tử hidro) có tỉ lệ mol tương ứng 3 : 1 : 2 thu được 24,64 lít CO2 (đktc) và 21,6 gam nước. Mặt khác cho 0,6 mol hỗn hợp E trên tác dụng với dung dịch AgNO3 trong NH3 đun nóng thu được m gam Ag. Giá trị m là
\(0,6mol\,E\left\{ \begin{gathered}
Ancol\,X:0,3 \hfill \\
Este\,Y:0,1 \hfill \\
Andehit\,Z:0,2 \hfill \\
\end{gathered} \right. + {O_2} \to \left\{ \begin{gathered}
C{O_2}:1,1 \hfill \\
{H_2}O:1,2 \hfill \\
\end{gathered} \right.\)
BTNT “H”: nH = 2nH2O = 2,4 mol
BTNT “C”: nC = nCO2 = 1,1 mol
=> Số nguyên tử H = nH : nE = 2,4 : 0,6 = 4
Do este là đơn chức, no, mạch hở => Este Y là C2H4O2 (HCOOCH3)
Ta có: Ctb = nC : nE = 1,1 : 0,6 = 1,833 => Ancol hoặc andehit có 1C
Nhưng vì andehit có 4H nên không thể có 1C => Ancol có 1C
=> Ancol X là CH4O
BTNT “C”: nCH4O + 2nC2H4O2 + n.nZ = nCO2 (n là số C trong Z)
=> 0,3.1 + 0,1.2 + 0,2n = 1,1 => n = 3
Do anđehit là no nên ta suy ra anđehit là OHC-CH2-CHO
=> nAg = 2nY + 4nZ = 2.0,1 + 4.0,2 = 1 mol
=> mAg = 108 gam
Đáp án D
Lấy m gam Mg tác dụng với 500ml dung dịch AgNO3 0,2M và Fe(NO3)3 2M. Kết thúc phản ứng thu được (m + 4) gam kim loại. Gọi a là tổng các giá trị m thỏa mãn bài toán trên, giá trị của a là?
nMg = m/24 mol; nAg+ = 0,1 mol; nFe3+ = 1 mol
Thứ tự phản ứng:
(1) Mg + 2Ag+ → Mg2+ + 2Ag
(2) Mg + 2Fe3+ → Mg2+ + 2Fe2+
(3) Mg + Fe2+ → Mg2+ + Fe
TH1: Mg hết, Ag+ dư, Fe3+ chưa phản ứng → chỉ xảy ra phản ứng (1)
→ 2nMg < nAg+ hay m/12 < 0,1 → m < 0,12
nAg = 2nMg = m/12 (mol)
m KL sau pư = mAg → m + 4 = 0,8m/12 → m = 0,5 gam (thỏa mãn)
TH2: Ag+ hết, Mg phản ứng một phần với Fe3+, Fe3+ ở (2) dư → xảy ra (1) và (2)
(1) Mg + 2Ag+ → Mg2+ + 2Ag
0,05 ← 0,1 → 0,1 (mol)
(2) Mg + 2Fe3+ → Mg2+ + 2Fe2+
m/24-0,05 → m/12-0,1 (mol)
Điều kiện để Fe3+ dư là: m/12-0,1 < 1 → m < 13,2
m KL sau pư = mAg → m + 4 = 0,1.108 → m = 6,8 gam (thỏa mãn)
TH3: Ag+ ở (1) hết, Fe3+ ở (2) hết, Mg phản ứng với Fe2+, Fe2+ ở (3) dư → xảy ra (1), (2), (3)
(1) Mg + 2Ag+ → Mg2+ + 2Ag
0,05 ← 0,1 → 0,1 (mol)
(2) Mg + 2Fe3+ → Mg2+ + 2Fe2+
0,5 ← 1 → 1 (mol)
(3) Mg + Fe2+ → Mg2+ + Fe
m/24-0,55 → m/24-0,55 → m/24-0,55
Điều kiện để Fe2+ ở (3) dư là m/24-0,55 < 1 → m < 37,2 gam
m KL sau pư = mAg + mFe → m + 4 = 0,1.108 + 56(m/24-0,55) → m = 18 gam (thỏa mãn)
TH4: Mg dư hết sau tất cả các phản ứng → xảy ra (1) (2) (3)
(1) Mg + 2Ag+ → Mg2+ + 2Ag
0,05 ← 0,1 → 0,1 (mol)
(2) Mg + 2Fe3+ → Mg2+ + 2Fe2+
0,5 ← 1 → 1 (mol)
(3) Mg + Fe2+ → Mg2+ + Fe
1 ← 1 → 1 (mol)
mKL sau pư = mMg dư + mAg + mFe → m + 4 = m – 1,55.24 + 0,1.108 + 1.56 → vô nghiệm
Kết luận: Vậy a = 0,5 + 6,8 + 18 = 25,3 gam
Đáp án A
Một mẫu supephotphat đơn có khối lượng 15,55 gam chứa 35,43% Ca(H2PO4)2 còn lại là CaSO4. Độ dinh dưỡng của loại phân bón trên là
Khối lượng của Ca(H2PO4)2 là 15,55.35,43% = 5,51 g.
Ca(H2PO4)2 → P2O5
234 142
5,51 x (g)
⟹ x = 3,34 g.
Vậy độ dinh dưỡng của loại phân này là (3,34/15,55).100% = 21,48%
Đáp án A
Đun nóng 250 gam dung dịch glucozơ với dung dịch AgNO3/NH3 thu được 15 gam Ag, nồng độ của dung dịch glucozơ là
nAg = 15 : 108 = 5/36 (mol)
nGlu = 1/2 nAg = 5/72 (mol)
mGlu = nGlu. MGlu = 5/72 × 180 = 12,5 (g)
Nồng độ của dd glucozo là: \(C\% = \frac{{{m_{Glu}}}}{{m{\,_{dd}}}}.100\% = \frac{{12,5}}{{250}}.100\% = 5\% \)
Đáp án D
Phenol không phản ứng với
A. 2C6H5OH + 2Na → 2C6H5ONa + H2
B. C6H5OH + 3Br2 → 2,4,6 tribromphenol + 3HBr
C. C6H5OH + NaOH → C6H5ONa + H2O
D. Phenol (C6H5OH) không có phản ứng với HCl đặc
Đáp án D
Cho các phát biểu sau:
(1) Khi có mặt ion kim loại nặng (Pb2+, Cu2+…) hoặc đun nóng protein bị đông tụ.
(2) Amilopectin có mạch không phân nhánh.
(3) Tơ visco và tơ axetat thuộc loại tơ nhân tạo.
(4) Thủy phân este đơn chức trong môi trường kiềm luôn cho sản phẩm là muối và ancol.
(5) Số nguyên tử N có trong phân tử đipeptit Glu–Lys là 2.
(6) Tất cả các peptit đều có phản ứng màu biure.
(7) Hiđro hóa glucơzơ và frutozơ đều thu được poliancol.
(8) Oxi hóa chất béo lỏng trong điều kiện thích hợp thu được chất béo rắn.
Số phát biểu đúng là
(1) đúng vì protein bị đông tụ khi có mặt axit, một số muối hoặc đun nóng.
(2) sai, amilopectin có mạch phân nhánh, amilozo có mạch không phân nhánh
(3) đúng, tơ visco và tơ axetat là tơ bán tổng hợp hay còn gọi là tơ nhân tạo
(4) sai, vì một số trường hợp đặc biệt ta còn có thể thu được anđehit, xeton hay muối của phenol
(5) sai, số nguyên tử N trong Glu-Lys là 3 (Glu có 1N, Lys có 2N)
(6) sai, vì đipeptit không có phản ứng màu biure
(7) đúng
(8) sai chất béo lỏng cộng H2 (là chất khử không phải chất oxi hóa) ta thu được chất béo rắn
Vậy có 3 đáp án đúng
Đáp án C
Cao su lưu hóa (loại cao su được tạo thành khi cho cao su thiên nhiên tác dụng với lưu huỳnh) có khoảng 1,849% lưu huỳnh về khối lượng. Giả thiết rằng cầu nối –S–S– đã thay thế cho H ở cầu metylen trong mạch cao su. Vậy khoảng bao nhiêu mắt xích isopren có một cầu đisunfua –S–S– ?
Cao su thiên nhiên có công thức cấu tạo: CH2=C(CH3)-CH=CH2 (CTPT: C5H8)
Gọi số mắt xích isopren có chứa 1 cầu đisunfua là n
=> Công thức cao su lưu hóa là: C5nH8n-1S2
\(\% {m_S} = \frac{{2.32}}{{12.5n + (8n - 1) + 2.32}}.100\% = 1,849\% \) => n = 50
Đáp án C
Cho các phát biểu sau
(1) H2NCH2CONHCH2-CH2COOH là đipeptit.
(2) Muối natri của axit glutamic được sử dụng sản xuất mì chính.
(3) Tính bazơ của NH3 yếu hơn tính bazơ của metyl amin
(4) Tetrapetit có chứa 4 liên kết peptit.
(5) Ở điều kiện thường metylamin và đimetylamin là những chất khí có mùi khai.
Số phát biểu đúng là?
(1) sai vì mắt xích H2NCH2-CH2COOH không phải là α-amino axit
(2) đúng, muối HOOC-CH2-CH2-CH(NH2)-COONa là thành phần chính của mì chính.
(3) đúng, vì CH3NH2 có gốc CH3- đẩy e làm cho mật độ điện tích âm trên nguyên tử N tăng, khả năng nhận H+ cũng tăng nên tính bazo mạnh hơn so với NH3.
(4) sai, vì tetrapeptit được tạo nên từ 4 mắt xích α-amino axit nhưng chỉ có 3 liên kết peptit.
(5) đúng
Vậy có 3 phát biểu đúng
Đáp án A
Cho sơ đồ chuyển hóa sau
(1). C4H6O2 + NaOH \(\buildrel {{t^0}} \over\longrightarrow \) (X) + (Y)
(2). (X) + AgNO3 + NH3 +H2O \(\buildrel {{t^0}} \over\longrightarrow \) (F) + Ag↓ + NH4NO3
(3). (Y) + NaOH \(\buildrel {{t^0}} \over\longrightarrow \) CH4 + Na2CO3
Công thức cấu tạo thu gọn của Y là
Từ (3) suy ra (Y) là CH3COONa
Từ (2) suy luận X có phản ứng tráng Ag => X là: CH3CHO
Từ (1) suy ra CTCT của C4H6O2 là: CH3COOCH=CH2
Đáp án C
Cho 19,2 gam hỗn hợp gồm hai amino axit no chứa một chức axit và một chức amin (tỷ lệ khối lượng phân tử của chúng là 1,373) tác dụng với 110 ml dung dịch HCl 2M, được dung dịch X. Để tác dụng hết với các chất trong dung dịch X cần dùng 140 ml dung dịch KOH 3M. Phần trăm số mol của mỗi aminoaxit trong hỗn hợp ban đầu bằng:
nHCl = 0,11.2 = 0,22 (mol); nKOH = 0,14.3 = 0,42 (mol)
Ta coi như hỗn hợp 2 amin và ax HCl phản ứng với KOH
Gọi công thức chung của 2 amin là: H2NCnH2nCOOH
HCl + KOH → KCl + H2O
0,22→ 0,22 (mol)
H2NCnH2nCOOH + KOH → H2NCnH2nCOOK + H2O
0,2 ← (0,42 -0,22) (mol)
→ nH2NCnH2nCOOH = 0,2 (mol)
\(\overline M \,aminoaxit = {{19,2} \over {0,2}} = 96\) → phải chứa Gly (M=75) hoặc Ala (M = 89)
TH1: aminoaxit nhỏ là Gly → Mcòn lại = 75. 1,373 = 103 (C4H9NO2)
Đặt: C2H5NO2: a (mol) ; C4H9NO2: b (mol)
\(\eqalign{
& \left\{ \matrix{
a + b = 0,2 \hfill \cr
75a + 103b = 19,2 \hfill \cr} \right. \Rightarrow \left\{ \matrix{
a = 0,05 \hfill \cr
b = 0,15 \hfill \cr} \right. \cr
& \Rightarrow \% {V_{{C_2}{H_5}N{O_2}}} = {{0,05} \over {0,2}}.100\% = 25\% \cr
& \% {C_4}{H_9}N{O_2} = 100\% - 25\% = 75\% \cr} \)
TH2: aminoaxit nhỏ là Ala → Mcòn lại = 89.1,373 = 122,2 vô nghiệm
Đáp án B
Để thu được Ag tinh khiết từ quặng bạc có lẫn Cu, người ta cho quặng bạc đó vào dung dịch chứa chất X dư.X là chất nào sau đây ?
Ta cho quặng Ag tác dụng với muối Fe(NO3)3
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
Đáp án A
Khối lượng glucozơ cần dùng để tạo ra 1,82 gam sobitol với hiệu suất 60% là:
C6H12O6 + H2 → C6H14O6 (Sobitol)
0,01 ← 0,01 (mol)
nSobitol = 1,82 : 182 = 0,01 (mol)
→ mglu lí thuyết = 0,01.180 = 1,8 (g)
Vì %H = 60% → mGlu thực tế = mglu lí thuyết :% H = 1,8 : 0,6=3 (g)
Đáp án B
Đun nóng tristearin với dung dịch NaOH , sau phản ứng thu được muối nào sau đây?
Tristearin có CTCT: (C17H35COO)3C3H5
(C17H35COO)3C3H5 + 3NaOH → 3C17H35COONa + C3H5(OH)3
Vậy muối thu được sau phản ứng là: C17H35COONa
Đáp án A
Giấm ăn là dung dịch chứa khoảng 5% axit
Giấm ăn là dung dịch axit axetic (CH3COOH) có nồng độ từ 2-5%
Đáp án D.

