Đề thi thử tốt nghiệp THPT QG môn Hóa năm 2020 - Trường THPT Hậu Lộc 4
Đề thi thử tốt nghiệp THPT QG môn Hóa năm 2020 - Trường THPT Hậu Lộc 4
-
Hocon247
-
40 câu hỏi
-
90 phút
-
22 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Đun nóng 0,1 mol hỗn hợp T gồm hai peptit mạch hở T1, T2 (T1 ít hơn T2 một liên kết peptit, đều được tạo thành từ X, Y là hai ammo axit có dạng H2N-CnH2n-COOH; Mx < My) với dung dịch NaOH vừa đủ, thu được dung dịch chứa 0,42 mol muối của X và 0,14 mol muối của Y. Mặt khác, đốt cháy hoàn toàn 13,2 gam T cần vừa đủ 0,63 mol O2. Phân tử khối của T1 là
Số mol peptit trong T = 0,42 + 0,14 = 0,56 (mol)
Quy đổi T thành :
CONH: 0,56 mol
CH2: x mol
H2O: 0,1 mol
Đốt cháy:
CONH + 0,75O2 → CO2 + 0,5H2O + 0,5N2
CH2 + 1,5 O2 → CO2 + H2O
Ta thấy: theo PT (43.0,56 + 14x + 0,1.18 ) g T cần ( 0,75.0,56 + 1,5x) mol O2
Theo đề bài 13,2 (g) cần 0,63 mol O2
→ 0,63(43.0,56 + 14x + 0,1.18 ) = 13,2 (0,75.0,56 + 1,5x)
→ x = 0,98 (mol)
Số C trung bình của muối = nC/ nmuối = ( 0,56 + 0,98)/ 0,56 = 2,75
→ Có 1 muối là Gly- Na: 0,42 mol
Muối còn lại : Y- Na: 0,14 mol
Bảo toàn nguyên tố C: 0,42.2 + 0,12. CY = 0,56 + 0,98
→ CY = 5 → Y là Val
T1: GlynVal5-n : a mol
T2: GlymVal6-n : b mol
Ta có: a + b = 0,1 và 5a + 6b = 056
→ a = 0,04 và b = 0,0
nGly = 0,04n + 0,06m = 0,42
→ 2n + 3m = 21 ( n ≤ 5; m ≤ 6)
→ n = 3 và m = 5 là nghiệm duy nhất
→ T1 là Gly3Val2 → MT1 = 387
Tính chất hóa học đặc trưng của kim loại là
Tính chất hóa học đặc trưng của kim loại là tính khử
Để điều chế kim loại kiềm người ta dùng phương pháp
Để điều chế kim loại kiềm người ta dùng phương pháp điện phân nóng chảy
Nhóm những chất khí (hoặc hơi) nào dưới đây đều gây hiệu ứng nhà kính khi nồng độ của chúng trong khí quyển vượt quá tiêu chuẩn cho phép ?
Nhóm những chất khí (hoặc hơi) gây hiệu ứng nhà kính khi nồng độ của chúng trong khí quyển vượt quá tiêu chuẩn cho phép là CO2 và CH4
Chất nào sau đây không phải là este ?
C2H5OC2H5 là ete không phải là este
Để phân biệt dung dịch CaCl2 với dung dịch NaCl, người ta dùng dung dịch
Để phân biệt dung dịch CaCl2 với dung dịch NaCl, người ta dùng dung dịch Na2CO3
Câu nào sau đây là đúng: Tripeptit (mạch hở) là hợp chất
Tripeptit (mạch hở) là hợp chất mà phân tử có 3 gốc α-amino axit liên kết với nhau bởi 2 liên kết peptit
Nhôm có thể hoà tan trong các dung dịch
Nhôm có thể hoà tan trong các dung dịch Ba(OH)2, CuCl2, HNO3 loãng, FeSO4
Cặp kim loại luôn được bảo vệ trong môi trường không khí, nước nhờ lớp màng oxit là:
Cặp kim loại luôn được bảo vệ trong môi trường không khí, nước nhờ lớp màng oxit là Cr- Al
Chất có thể trùng hợp tạo ra polime là
Chất có thể trùng hợp tạo ra polime là CH2=CH-COOH
Dãy gồm các oxit đều bị Al khử ở nhiệt độ cao là
Dãy gồm các oxit đều bị Al khử ở nhiệt độ cao là FeO, CuO, Cr2O3
Tinh bột, xenlulozo, saccarozo đều có khả năng tham gia phản ứng
Tinh bột, xenlulozo, saccarozo đều có khả năng tham gia phản ứng hoà tan Cu(OH)2.
Canxi cacbonat còn được gọi là
Canxi cacbonat còn được gọi là đá vôi
Hoà tan 25 gam muối CuSO4.5H2O vào nước được 500 ml dung dịch. Cho dần mạt sắt vào 50 ml dung dịch trên, khuấy nhẹ cho đến khi hết màu xanh. Khối lượng chất rắn thu được sau phản ứng tăng hay giảm bao nhiêu gam?
Đáp án B
\({n_{{\rm{CuS}}{{\rm{O}}_4}.5{H_2}O}} = 0,1(mol) \to {n_{{\rm{CuS}}{{\rm{O}}_4}}} = 0,1(mol)\)
→ Trong 50ml, \({n_{{\rm{CuS}}{{\rm{O}}_4}}} = 0,01(mol)\)
\({\rm{CuS}}{O_4} + Fe \to Fe{\rm{S}}{O_4} + Cu\)
\( \to \Delta m = {m_{Cu}} - {m_{Fe}} = 0,01.64 - 0,01.56 = 0,08(g)\)
Vậy khối lượng chất rắn tăng 0,08 gam
Nung hỗn hợp gồm 10,8 gam Al và 16,0 gam Fe2O3 (trong điều kiện không có không khí), sau khi phản ứng xảy ra hoàn toàn thu được chất rắn Y. Khối lượng kim loại trong Y là
Đáp án D
\(\left\{ \begin{array}{l}
{n_{Al}} = 0,4\\
{n_{F{e_2}{O_3}}} = 0,1
\end{array} \right.\)
\(\begin{array}{l}
2Al + F{e_2}{O_3} \to 2Fe + A{l_2}{O_3}\\
0,2\,\,\,\,\,\,\,\,\,0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,2\,\,\,\,\,\,\,\,0,1
\end{array}\)
\( \Rightarrow Y\left\{ \begin{array}{l}
Fe:0,2\\
A{l_2}{O_3}:0,1\\
Al:0,2
\end{array} \right. \to {m_{kl(Y)}} = 0,2.56 + 0,2.27 = 16,6(g)\)
Hòa tan 6,12 gam hỗn hợp glucozơ và saccarozơ vào nước thu được 100ml dung dịch X. Cho X tác dụng với AgNO3/NH3 dư thu được 3,24 gam Ag. Khối lượng saccarozơ trong hỗn hợp ban đầu là:
Đáp án B
\({n_{Ag}} = 0,03 \to {n_{glucozo}} = 0,015 \to {m_{glucozo}} = 2,7(g)\)
\( \to {m_{saccarozo}} = 6,12 - 2,7 = 3,42(g)\)
Cho 21,75 gam một amin (X) đơn chức, tác dụng với dung dịch HCl vừa đủ thu được 30,875 gam muối. Phân tử khối của X là
Đáp án A
Ta có:
\({n_X} = {n_{HCl}} = \frac{{30,875 - 21,75}}{{36,5}} = 0,25(mol)\)
\( \to {M_X} = \frac{{21,75}}{{0,25}} = 87\)
Thực hiện thí nghiệm như hình vẽ bên.
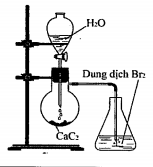
Hiện tượng xảy ra trong bình chứa dung dịch Br2 là?
Dung dịch Br2 bị nhạt màu
Đáp án A
Cặp chất nào sau đây cùng tồn tại trong một dung dịch?
Cặp chất nào sau đây cùng tồn tại trong một dung dịch là NaCl và Al(NO3)3
Đáp án A
Saccarozơ và glucozơ đều có
Saccarozơ và glucozơ đều có phản ứng với Cu(OH)2 ở nhiệt độ thường tạo thành dung dịch xanh lam
Có 4 dung dịch riêng biệt: CuSO4, ZnCl2, FeCl2, AgNO3. Nhúng vào mỗi dung dịch 1 thanh Ni. Số trường hợp xảy ra ăn mòn điện hóa là:
Đáp án D
CuSO4: xảy ra ăn mòn điện hóa: 2 điện cực là Ni và Cu, dung dịch chất điện li là CuSO4.
ZnCl2: không xảy ra, do không có 2 điện cực.
FeCl2: không xảy ra, do không có 2 điện cực (Fe3+ + Ni =Fe2+ + Ni2+)
AgNO3: xảy ra ăn mòn điện hóa: 2 điện cực là Ni và Ag, dung dịch chất điện li là AgNO3. Đáp án D
Trong các este có công thức phân tử là C4H6O2, có bao nhiêu este không thể điều chế trực tiếp từ axit và ancol?
Đáp án: C
Các este không thể điều chế trực tiếp từ axit và ancol là:
HCOOCH=CHCH3 (tính cả đồng phân hình học)
HCOOC(CH3)=CH2
CH3COOCH=CH2
X, Y, Z là các hợp chất chứa crom. X, Y, Z lần lượt là
Đáp án C
Cho các loại tơ: bông, tơ capron, tơ xenlulozơ axetat, tơ tằm, tơ nitron, nilon-6,6. Số tơ tổng hợp là
Các tơ tổng hợp gồm: tơ capron, tơ nitron, nilon-6,6
Đáp án A
Hòa tan m gam hỗn hợp Na2CO3 và KHCO3 vào nước để được 400 ml dung dịch X. Cho từ từ 100 ml dung dịch HCl 1,5M vào dung dịch X, thu được dung dịch Y và 1,008 lít khí (đktc). Cho Y tác dụng với Ba(OH)2 dư thu được 29,55 gam kết tủa. Cho từ từ dung dịch X vào bình đựng 100 ml dung dịch HCl 1,5M, thu được V lít khí (đktc). Giá trị của m và V lần lượt là
Xét TN1:
\(\begin{array}{l}
{H^ + } + CO_3^{2 - } \to HCO_3^ - \\
\,\,\,\,\,\,\,\,\,\,\,\,\,\,x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,15
\end{array}\)
\(\begin{array}{l}
HCO_3^ - \,\,\,\,\,\,\,\, + {H^ + } \to C{O_2} + {H_2}O\\
x + y\,\,\,\,\,\,\,\,\,0,15 - x\\
0,045\,\,\,\,\,\,\,\,\,0,045\,\\
x + y - 0,045\,\,\,\,\,\,\,\,\,\,\,0,045
\end{array}\)
\( \to 0,15x = 0,045 \to x = 0,15 - 0,045 = 0,105\)
\(HCO_3^ - + O{H^ - } \to CO_3^{2 - } + {H_2}O\)
\({n_{CO_3^{2 - }}} = {n_{BaC{O_3}}} = 0,15 \to {n_{HCO{{_3^{2 - }}_{du}}}} = 0,15 \to x + y - 0,045 = 0,15 \to y = 0,09\)
\( \to m = 0,105.106 + 0,09.100 = 20,13(g)\)
Xét TN2: Cho từ từ dd X gồm 0,105 mol Na2CO3 và 0,09 mol KHCO3 vào 0,15 mol HCl
\(CO_3^{2 - } + 2{H^ + } \to C{O_2} + {H_2}O\)
\(HCO_3^ - + {H^ + } \to C{O_2} + {H_2}O\)
\( \to \left\{ \begin{array}{l}
\frac{a}{b} = \frac{{0,105}}{{0,09}}\\
{n_{{H^ + }}} = 2a + b = 0,15
\end{array} \right. \to \left\{ \begin{array}{l}
a = 0,0525\\
b = 0,045
\end{array} \right. \to V = 22,4(a + b) = 2,184(l)\)
Thủy phân hoàn toàn chất béo X trong môi trường axit, thu được glixerol và hỗn hợp hai axit béo. Nếu đốt cháy hoàn toàn a mol X thì thu được 12,32 lít CO2 (đktc) và 8,82 gam H2O. Mặt khác, a mol X tác dụng tối đa với 40 ml dung dịch Br2 1M. Hai axit béo là
Đáp án B
Ta có: \(\left\{ \begin{array}{l}
{n_{C{O_2}}} = 0,55\\
{n_{{H_2}O}} = 0,49
\end{array} \right.\)
Gọi số liên kết đôi C = C trong gốc axit là k
\( \to a.k = {n_{B{r_2}}} = 0,04\)
\( \to \sum {{\pi _x}} = {\pi _{C = C}} + {\pi _{C = O}} = k + 3\)
\({n_{C{O_2}}} - {n_{{H_2}O}} = (k + 3 - 1)a \to 0,06 = 0,04 + 2a \to a = 0,01,k = 4\)
Vì cứ 1 mol X phản ứng với 4 mol Br2 → có 2 gốc axit chứa 2 nối đôi (axit linoleic) và 1 axit panmitic hoặc axit stearic).
Nhận thấy, số \(C = 0,55:0,01 = 55 = 3({C_3}{H_5}) + 16({C_{15}}{H_{31}}COO) + 2.18({C_{17}}{H_{31}}COO)\)
Vậy 2 axit béo thu được là axit panmitic và axit linoleic.
Thực hiện hai thí nghiệm sau:
- Thí nghiệm 1: Cho este X có công thức phân tử C5H8O4 tác dụng hoàn toàn với dung dịch NaOH (dư), thu được hai muối Y, Z (MY < MZ) và ancol E duy nhất.
- Thí nghiệm 2: Thủy phân tinh bột thu được cacbohiđrat X1. Lên men X1 thu được chất hữu cơ T.
Nhận định nào sau đây không đúng?
Đáp án D
Tiến hành các thí nghiệm sau:
(a) Điện phân MgCl2 nóng chảy.
(b) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3 dư.
(c) Nhiệt phân hoàn toàn CaCO3.
(d) Cho kim loại Na vào dung dịch CuSO4 dư.
(e) Dẫn khí H2 dư đi qua bột CuO nung nóng.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được kim loại là
Đáp án A
Cho các phát biểu sau:
(a) Cho khí H2 dư qua hỗn hợp bột Fe2O3 và CuO nung nóng, thu được Fe và Cu.
(b) Cho kim loại Ba tác dụng với dung dịch CuSO4, thu được kim loại Cu.
(c) Cho AgNO3 tác dụng với dung dịch FeCl2, thu được kim loại Ag.
(d) Để gang trong không khí ẩm lâu ngày có xảy ra ăn mòn điện hóa học.
(e) Dùng bột lưu huỳnh để xử lí thủy ngân khi nhiệt kế bị vỡ.
Số phát biểu đúng là
Có 3 phát biểu đúng
Đốt cháy hoàn toàn 0,16 mol hỗn hợp X gồm CH4, C2H2, C2H4 và C3H6, thu được 6,272 lít CO2 (đktc) và 6,12 gam H2O. Mặt khác 10,1 gam X phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của m là
Đáp án B
Có \({n_X}({k_X} - 1) = {n_{C{O_2}}} - {n_{{H_2}O}} \to {n_{\pi (X)}} - {n_X} = n(C{O_2}) - n({H_2}O)\)
\(0,16(mol)\left\{ \begin{array}{l}
C{H_4}\\
{C_2}{H_2}\\
{C_2}{H_4}\\
{C_3}{H_6}
\end{array} \right.\left\langle \begin{array}{l}
0,16(mol) \to \left\{ \begin{array}{l}
C{O_2}:0,28\\
{H_2}O:0,34
\end{array} \right.\\
10,1(g) \to {n_{B{r_2}pu}} = a = \sum {{n_\pi }}
\end{array} \right.\)
\( \to 0,16({k_X} - 1) = 0,28 - 0,34 \to {n_{\pi (X)}} = 0,280 - 0,34 + 0,16 = 0,1(mol)\)
Xét trong 0,16 mol X có: \({m_X} = {m_C} + {m_H} = 0,28.12 + 0,34.2 = 4,04(g)\)
Nhận thấy 10,1 gấp 2,5 lần 4,04 \( \to a = 0,1.2,5 = 0,25(mol)\)
Hòa tan hoàn toàn hỗn hợp Al và Al2O3 vào 200 ml dung dịch HCl nồng độ a mol/1, thu được dung dịch X. Cho từ từ dung dịch NaOH 1M vào X, lượng kết tủa Al(OH)3 (m gam) phụ thuộc vào thể tích NaOH (V ml) được biểu diễn bằng đồ thị bên. Giá trị của a là:

X gồm HCl dư (x mol) và AlCl3 (y mol)
→ x = 0,1 mol
+ Tại nNaOH = 0,25 mol: nNaOH = nHCl + 3nAl(OH)3 → nAl(OH)3 = (0,25-0,1)/3 = 0,05 mol
+ Tại nNaOH = 0,45 mol: nNaOH = nHCl + 4nAl3+ - nAl(OH)3 → 0,45 = 0,1 + 4y – 0,05 → y = 0,1 mol
BT “Cl” → nHCl = 3nAlCl3 + nHCl dư → nHCl = 0,1 + 3.0,1 = 0,4 mol
→ a = 0,4/0,2 = 2M
Cho các phát biểu sau:
(a) Thủy phân triolein, thu được etylen glicol
(b) Tinh bột bị thủy phân khi có xúc tác axit hoặc enzim
(c) Thủy phân vinyl fomat, thu được hai sản phẩm đều có phản ứng tráng bạc.
(d) Trùng ngưng axit -aminocaproic, thu được policaproamit.
(e) Chỉ dùng quỳ tím có thể phân biệt ba dung dịch: alanin, lysin, axit glutamic
(g) Phenylamin tan ít trong nước nhưng tan tốt trong dung dịch HCl.
Số phát biểu đúng là
Có 5 phát biểu đúng
Điện phân 100 ml dung dịch hỗn hợp gồm CuSO4 a mol/l và NaCl 2M (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) với cường độ dòng điện không đổi 1,25A trong 193 phút. Dung dịch sau điện phân có khối lượng giảm 9,195 gam so với dung dịch ban đầu. Giá trị của a là
Ta có: nNaCl = 0,2 mol
Ta có: ne = It : F = (1,25.193.60) : 96500 = 0,15 mol
Tại anot:
2Cl- → Cl2 + 2e
0,075 ← 0,15 mol
Tại catot:
Nếu H2O chưa bị điện phân thì nCu = 0,075 mol
→ m dung dịch giảm = mCu+ mCl2 = 0,075.64 + 0,075.71 = 10,125 > 9,195 → Phải có nước bị điện phân ở catot
Cu2+ + 2e → Cu
2H2O + 2e → H2 + 2OH-
Đặt nCu = x mol; nH2 = y mol
Ta có: ne nhận = 2x + 2y = 0,15 mol
Mặt khác, mdung dịch giảm = 64x + 2y + 0,075.71 = 9,195
Giải hệ trên ta có x = 0,06 và y = 0,015
→ a = x/0,1 = 0,6M
Hỗn hợp X gồm phenyl axetat, metyl benzoat, benzyl fomat và etyl phenyl oxalat. Thủy phân hoàn toàn 36,9 gam X trong dung dịch NaOH (dư, đun nóng), có 0,4 mol NaOH phản ứng, thu được m gam hỗn hợp muối và 10,9 gam hỗn hợp Y gồm các ancol. Cho toàn bộ Y tác dụng với Na dư, thu được 2,24 lít khí H2 (đktc). Giá trị của m là
CH3COOC6H5 (M = 136): a mol
C6H5COOCH3 (M = 136): b mol
HCOOCH2C6H5 (M =136): c mol
C6H5-(COO)2-C2H5 (M = 194): d mol
Khi phản ứng với NaOH ta thu được m gam muối và 10,9 gam ancol
Muối gồm CH3COONa (a mol); C6H5COONa (b mol); (COONa)2 (d mol); HCOONa (c mol); C6H5ONa (a+d mol)
ancol gồm CH3OH (b mol); C6H5CH2OH (c mol); C2H5OH (d mol)
Từ đề bài ta có hệ phương trình sau:
136a + 136b + 136c + 194d = 36,9
2a + b + c + 3d = 0,4
32b + 108c + 46d = 10,9
b + c + d = 0,2
→ a = 0,05, b = 0,1; c = 0,05; d = 005
→ mmuối = mCH3COONa + mC6H5COONa + m(COONa)2 + mHCOONa + mC6H5ONa
→ mmuối = 0,05.82 + 0,1.144 + 0,05.134 + 0,05.68 + (0,05 + 0,05).116 = 40,2 gam
Hỗn hợp X gồm Al2O3, Ba, K (trong đó oxi chiếm 20% khối lượng của X). Hòa tan hoàn toàn m gam X vào nước dư, thu được dung dịch Y và 0,022 mol khí H2. Cho từ từ đến hết dung dịch gồm 0,018 mol H2SO4 và 0,038 mol HCl vào Y, thu được dung dịch Z (chỉ chứa các muối clorua và muối sunfat trung hòa) và 2,958 gam hỗn hợp kết tủa. Giá trị của m là
nSO42- = 0,18 (mol) → nBaSO4 (max) = 0,18 (mol) → nBaSO4 > 2,958 (g)
→ nSO42- dư → nBaSO4 = y (mol)
Đặt Al(OH)3 : t (mol) → 233y + 78t = 2,985 (2)
nH+ = nOH- + nAlO2- + 3nAl(OH)3 bị tan → (z + 2y – 2x) + 2x + 3(2x – t) = 0,018.2 + 0,038 (3)
%O = [(16.3x) : (102x + 137y + 39z)].100% = 20% (4)
Từ (1), (2), (3), (4) => x = 0,015 ; y = 0,006 ; z = 0,032 ; t = 0,02 (mol)
→ m = 0,015.102 + 0,006.39 + 0,02.39 = 3,6 (g)
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau:
Axit glutamic, tinh bột, glucozơ, anilin
Đáp án B
Cho các phản ứng xảy ra theo sơ đồ sau:
2X1 + 2H2O → 2X2 + X3 + H2
X2 + Y1 → X4 + CaCO3 + H2O
2X2 + Y1 → X5 + CaCO3 + 2H2O
Đốt cháy X2 trên ngọn lửa không màu thấy xuất hiện màu vàng. X5 là chất nào dưới đây?
Đáp án B
Hỗn hợp E gồm ba este mạch hở, đều có bốn liên kết pi ( ) trong phân tử, trong đó có một este đơn chức là este của axit metacrylic và hai este hai chức là đồng phân của nhau. Đốt cháy hoàn toàn 12,22 gam E bằng O2, thu được 0,37 mol H2O. Mặt khác, cho 0,36 mol E phản ứng vừa đủ với 234 ml dung dịch NaOH 2,5M, thu được hỗn hợp X gồm các muối của các axit cacboxylic không no, có cùng số nguyên tử cacbon trong phân tử, hai ancol không no, đơn chức có khối lượng m1 gam và một ancol no, đơn chức có khối lượng m2 gam. Tỉ lệ m1:m2 có giá trị gần nhất với giá trị nào sau đây?
Xem 12,22 gam E gồm: CH2=C(CH3)-COO-CH2-C≡CH (C7H8O2 , a mol); CH2=CH-CH2-OOC-CH=CH-COO-CH3 (C8H10O4 , b mol) và CH2 (c mol).
124a + 170b +14c = 12,22 và 4a + 5b + c = 0,37
Lại có: cứ 0,36 mol E -----0,585 mol NaOH
Vậy: (a + b) mol E----(a + 2b) mol NaOH
⇒ (a +b)0,585 = (a + 2b)0,36 ⇒ a = 0,03; b =0,05 ; c = 0
⇒ Nghiệm: E gồm: CH2=C(CH3)-COO-CH2-C≡CH (0,03 mol); CH2=CH-CH2-OOC-CH=CH-COO-CH3 (0,05 mol)
mCH≡C−CH2OH + mCH2=CH−CH2OH = 4, 58
mCH3OH = 1, 6
Tỉ lệ không phụ thuộc lượng chất nên: m1 : m2 = 4,58 : 1,6 = 2,8625
Hòa tan hết 31,36 gam hỗn hợp rắn X gồm Mg, Fe, Fe3O4 và FeCO3 vào dung dịch chứa H2SO4 và NaNO3, thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm CO2, NO, N2, H2) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol NaOH, thu được 46,54 gam kết tủa và 0,56 lít khí (đktc). Nếu cho Z tác dụng với dung dịch BaCl2 dư thì thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Fe3O4 trong X là
166,595 gam kết tủa là 0,715 mol BaSO4 → có nH2SO4 = ∑nSO42– = 0,715 mol.
0,56 lít khí là 0,025 mol NH4+.
Dùng YTHH 02: Natri đi về đâu? 0,715 mol Na2SO4
⇒ nNa+ trong Z = 0,715 × 2 – 1,285 = 0,145 mol → có 0,145 mol NaNO3.
trong Z: 0,145 mol Na+; 0,025 mol NH4+
⇒ ∑nSO42– kết hợp cation Mg2+, Fe?+ = 1,26 mol.
⇒ 46,54 gam kết tủa gồm: Mg, Fe và 1,26 mol OH ⇒ ∑mMg, Fe = 25,12 gam.
⇝ BTKL cả sơ đồ có mH2O = 11,07 gam ⇒ nH2O = 0,615 mol.
⇒ bảo toàn nguyên tố H có nH2 trong Y = 0,05 mol.
Y gồm CO2, N2, NO và 0,05 mol; tổng 0,2 mol; nặng 5,14 gam.
bảo toàn N có thêm giả thiết nNO + 2nN2 = 0,12 mol ⇒ giải hệ số mol 3 khí còn lại:
nNO = 0,1 mol; nN2 = 0,01 mol; nCO2 = 0,04 mol ⇝ có 0,04 mol FeCO3.
từ đó có: nFe3O4 = (31,36 – 25,12 – 0,04 × 60) ÷ 16 ÷ 4 = 0,06 mol.
⇒ %mFe3O4 trong X = 0,06 × 232 ÷ 31,36 × 100% ≈ 44,39%

