Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Trần Quốc Tuấn
Đề thi thử THPT QG năm 2021 môn Hóa học - Trường THPT Trần Quốc Tuấn
-
Hocon247
-
40 câu hỏi
-
90 phút
-
31 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Có bốn lọ dung dịch riêng biệt X, Y, Z và T chứa các chất khác nhau trong số bốn chất: (NH4)2CO3, KHCO3, NaNO3, NH4NO3. Bằng cách dùng dung dịch Ca(OH)2 cho lần lượt vào từng dung dịch, thu được kết quả sau:
X tác dụng với dung dịch Ca(OH)2 thu được kết tủa trắng
→ X là KHCO3:
\(2KHC{O_3} + Ca{(OH)_2} \to \underbrace {CaC{O_3} \downarrow }_{trang} + {K_2}C{O_3} + 2{H_2}O\)
Y tác dụng với dung dịch Ca(OH)2 thu được khí mùi khai
→ Z là NH4NO3:
\(2N{H_4}N{O_3} + Ca{(OH)_2} \to Ca{(N{O_3})_2} + 2\underbrace {NH{}_3 \uparrow }_{mui{\text{ khai}}} + 2{H_2}O\)
Z tác dụng với dung dịch Ca(OH)2 không thấy hiện tượng gì
→ Z là NaNO3:
\(NaN{O_3} + Ca{(OH)_2} \to \) không phản ứng.
T tác dụng với dung dịch Ca(OH)2 thu được kết tủa trắng và mùi khai
\(\begin{gathered} \Rightarrow T{\text{ (N}}{{\text{H}}_4}){}_2C{O_3}: \hfill \\ {(N{H_4})_2}C{O_3} + Ca{(OH)_2} \to \underbrace {CaC{O_3} \downarrow }_{trang} + 2\underbrace {N{H_3} \uparrow }_{mui{\text{ khai}}} + 2{H_2}O \hfill \\ \end{gathered} \)
Đáp án C.
Cho các chất sau: fructozơ, saccarozơ, etyl axetat, Val-Gly-Ala, tinh bột, tripanmitin.Số chất có phản ứng thủy phân trong điều kiện thích hợp là:
Phản ứng thủy phân đặc trưng cho các hợp chất sau:
- Este: Thủy phân trong môi trường axit là phản ứng thuận nghịch (hai chiều), thủy phân trong môi trường kiềm là phản ứng bất thuận nghịch (một chiều).
- Cacbonhiđrat: Đíaccảit như saccarozơ, polisacarit (tinh bột, xenlulozơ) bị thủy phân trong môi trường axit hoặc dưới xúc tác enzim.
- Peptit, protein: Thủy phân trong môi trường axit, thủy phân trong môi trường kiềm, thủy phân dưới tác dụng enzim.
- Amit: Amit là hợp chất hữu cơ chứa nhóm –CO-NH- không phải là của
 amino axit cũng bị thủy phân trong môi trường axit, môi trường kiềm.
amino axit cũng bị thủy phân trong môi trường axit, môi trường kiềm. - Các hợp chất hữu cơ khác có chức este (poli (etylen terephtalat), poli (metyl metacrylat),..), chứa chức amit (nilon-6, nilon-6,6,…) cũng bị thủy phân trong môi trường axit, môi trường kiềm.
Các chất bị thủy phân trong điều kiện thích hợp là: saccarozơ (C12H22O11), etyl axetat (CH3COOC2H5).
Val-Gly-Ala, tinh bột ((C6H10O5)n), tripanmitin ((C15H31COO)3C3H5)
Đáp án B.
Trong môi trường kiềm, dung dịch protein có phản ứng biure với
Từ tripeptit trở lên hoặc dung dịch protein có phản ứng màu biure với Cu(OH)2 tạo thành dung dịch màu tím đặc trưng:
Tripeptit + Cu(OH)2 → Dung dịch màu tím
Protein + Cu(OH)2 →Dung dịch màu tím
Đáp án C.
Cho các kim loại và các dung dịch: Fe, Cu, Fe(NO3)2, Cu(NO3)2, AgNO3, HCl. Cho các chất trên tác dụng với nhau từng đôi một. Số trường hợp xảy ra phản ứng hóa học là:
Các phương trình hóa học:
\(\begin{gathered} Fe + Cu{(N{O_3})_2} \to Fe{(N{O_3})_2} + Cu \hfill \\ Fe + 2AgN{O_3} \to Fe{(N{O_3})_2} + 2Ag \hfill \\ Fe + 2HCl \to FeC{l_2} + {H_2} \uparrow \hfill \\ Cu + 2AgN{O_3} \to Cu{(N{O_3})_2} + 2Ag \hfill \\ Fe{(N{O_3})_2} + AgN{O_3} \to Fe{(N{O_3})_3} + Ag \hfill \\ \end{gathered} \)
\(\begin{gathered} Fe{(N{O_3})_2} + HCl:{\text{ 3F}}{{\text{e}}^{2 + }} + NO_3^ - + 4{H^ + } \to 3F{e^{3 + }} + NO \uparrow + 2{H_2}O \hfill \\ AgN{O_3} + HCl \to AgCl \downarrow + HN{O_3} \hfill \\ \end{gathered} \)
Đáp án A.
Phát biểu nào sau đây sai?
Gly (1 NH2, 1 COOH), Val( 1NH2, 1 COOH), Lys (2NH2, 1COOH) ![]() Phát biểu A sai
Phát biểu A sai
Ở điều kiện thường , amino axit là chất rắn kết tinh ![]() Phát biểu B đúng
Phát biểu B đúng
Trùng ngưng ![]() aminocaproic thu được policaproamit:
aminocaproic thu được policaproamit:
\(\begin{gathered} nN{H_2} - {[C{H_2}]_5} - COOH\xrightarrow{{{t^0}}} - {(NH - {[C{H_2}]_5} - CO - )_n} - + n{H_2}O \hfill \\ {\text{ axit }}\varepsilon {\text{ - aminocaproic policaproamit (nilon - 6)}} \hfill \\ \end{gathered} \)
![]() Phát biểu C đúng.
Phát biểu C đúng.
Amino axit là hợp chất có tính lưỡng tính, do đó amino axit vừa tác dụng với dung dịch NaOH, vừa tác dụng với dung dịch HCl. Thí dụ:
\(\begin{gathered} {H_2}NC{H_2}COOH + NaOH \to {H_2}NC{H_2}COONa + {H_2}O \hfill \\ {H_2}NC{H_2}COOH + HCl \to Cl{H_3}NC{H_2}COOH \hfill \\ \end{gathered} \)
![]() Phát biểu D đúng.
Phát biểu D đúng.
Đáp án A.
Thủy phân hoàn toàn m gam chất béo X bằng 250ml dung dịch KOH 1,5M, đun nóng (lượng KOH được lấy dư 25% so với lượng cần phản ứng). Cô cạn dung dịch sau phản ứng thu được 100,2 gam hỗn hợp chất rắn khan gồm 2 chất. Tên gọi của X là:
\(\begin{gathered} {n_{KOH}} = 0,25.1,5 = 0,375{\text{ mol}} \hfill \\ \left. \begin{gathered} {n_{KOH(ban{\text{ dau)}}}} = {n_{KOH(pu)}} + {n_{KOH{\text{ du}}}} \hfill \\ \xrightarrow{{KOH{\text{ du 25% so voi luong}}\,{\text{pu}}}}{n_{KOH(du)}} = 25\% .{n_{KOH(pu)}} \hfill \\ \end{gathered} \right\} \Rightarrow {n_{KOH(ban{\text{ dau)}}}} = 1,25.{n_{KOH(pu)}} \hfill \\ \end{gathered} \)
\(\begin{gathered} \Rightarrow 0,375 = 1,25.{n_{KOH(pu)}} \Rightarrow {n_{KOH(pu)}} = 0,3{\text{ mol}} \hfill \\ {n_{KOH{\text{ (du)}}}} = 25\% ,0,3 = 0,075{\text{ mol}} \hfill \\ \end{gathered} \)
Chất rắn khan gồm 2 chất (trong đó có KOH dư) ![]() X tạo bởi một axit béo
X tạo bởi một axit béo
Đặt công thức của X là (RCOO)3C3H5
Sơ đồ phản ứng:
\({(RCOO)_2}{C_3}{H_5} + \underbrace {KOH}_{0,375{\text{ mol}}} \to \underbrace {\left\{ \begin{gathered} RCOOK \hfill \\ \underbrace {KOH{\text{ du}}}_{0,075{\text{ mol}}} \hfill \\ \end{gathered} \right\}}_{100,2{\text{ gam ran}}} + {C_3}\)
\(\begin{gathered} \xrightarrow{{BT{\text{ K}}}}{n_{KOH}} = {n_{RCOOK}} + {n_{KOH{\text{ du}}}} \Rightarrow 0,375 = {n_{RCOOK}} + 0,075 \Rightarrow {n_{RCOOK}} = 0,3{\text{ mol}} \hfill \\ {{\text{m}}_{RCOOK}} + mu = {m_{ran}} \Rightarrow (R + 83).0,3 + 56.0,075 = 100,2 \Rightarrow R = 237({C_{17}}{H_{33}} - ) \hfill \\ \Rightarrow X:\underbrace {{{({C_{17}}{H_{33}}COO)}_3}{C_3}{H_5}}_{triolen} \hfill \\ \end{gathered} \)
Đáp án C.
Cho 17,7 gam amin X (no, đơn chức, mạch hở) tác dụng hết với dung dịch HCL thu được 28,65 gam muối. Công thức của phân tử X là gì?
Đặt công thức của X là CxHyN
Sơ đồ phản ứng: \(\underbrace {{C_x}{H_y}N}_{17,7{\text{ gam X}}} + HCl \to \underbrace {{C_x}{H_y}NHCl}_{28,65{\text{ gam muoi}}}\)
\(\begin{gathered} \xrightarrow{{BTKL}}{m_{{C_x}{H_y}N}} + {m_{HCl}} = {m_{{C_x}{H_y}NHCl}} \hfill \\ {\text{ }} \Rightarrow {\text{17}}{\text{,7 + 36}}{\text{,5}}{\text{.}}{{\text{n}}_{HCl}} = 28,65 \Rightarrow {n_{HCl}} = 0,3{\text{ mol}} \hfill \\ \end{gathered} \)
\(\begin{gathered} \xrightarrow{{A\min {\text{ no}}{\text{, mach ho}}}}{n_N} = n{}_{HCl} \Rightarrow {n_N} = 0,3{\text{ mol}} \hfill \\ \xrightarrow{{BT{\text{ N}}}}{n_{{C_x}{H_y}N}} = {n_N} \Rightarrow {C_x}{H_y}N = 0,3{\text{ mol}} \hfill \\ \end{gathered} \)
\( \Rightarrow (12x + y + 14).0,3 = 17,7 \Rightarrow 12x + y = 45 \Rightarrow \left\{ \begin{gathered} x = 3 \hfill \\ y = 9 \hfill \\ \end{gathered} \right. \Rightarrow X:{C_3}{H_9}N.\)
Đáp án C.
Phát biểu nào sau đây sai?
Tính oxi hóa của \(A{g^ + } > F{e^{3 + }} \Rightarrow \) Phát biểu A sai
Kim loại có tính chất vật lí chung như: Tính dẻo, dẫn điện, dẫn nhiệt, ánh kim là do sự mặt của các electron tự do trong mạng tinh thể kim loại ![]() Phát biểu B đúng
Phát biểu B đúng
Tính chất hóa học chung của kim loại là tính khử ![]() Phát biểu C đúng
Phát biểu C đúng
Nguyên tắc để điều chế kim loại là khử ion kim loại thành kim loại: \({M^{n + }} + ne \to M\)
![]() Phát biểu D đúng.
Phát biểu D đúng.
Đáp án A.
Cho 10,8 gam axit cacboxylic đơn chức X tác dụng hết với 200ml dung dịch KOH 1M, cô cạn dung dịch sau phản ứng thu được 19,3 gam chất rắn khan. Tên của X là:
\({n_{KOH}} = 0,2.1 = 0,2{\text{ mol}}\)
X tác dụng hết với KOH ![]() X hết, KOH có thể dư
X hết, KOH có thể dư
Đặt công thức của X là RCOOH
Sơ đồ phản ứng: \(\underbrace {RCOOH}_{10,8{\text{ gam X}}} + \underbrace {KOH}_{0,2{\text{ mol}}} \to \underbrace {\left\{ \begin{gathered} RCOOK \hfill \\ KOH{\text{ du}} \hfill \\ \end{gathered} \right\}}_{19,3{\text{ gam ran}}} + {H_2}O\)
\(\begin{gathered} \xrightarrow{{BTKL}}{m_{RCOOH}} + {m_{KOH}} = {m_{ran}} + {m_{{H_2}O}} \hfill \\ {\text{ }} \Rightarrow {\text{10}}{\text{,8 + 0}}{\text{,2}}{\text{.56 = 19}}{\text{,3 + 18}}{\text{.}}{{\text{n}}_{{H_2}O}} \Rightarrow {{\text{n}}_{{H_2}O}} = 0,15{\text{ mol}} \hfill \\ \end{gathered} \)
\(\begin{gathered} \xrightarrow{{RCOOH + KOH \to RCOOK + {H_2}O}}{n_{RCOOH}} = {n_{{H_2}O}} \Rightarrow {n_{RCOOH}} = 0,15{\text{ mol}} \hfill \\ \Rightarrow {\text{(R + 0}}{\text{,45)}}{\text{.0}}{\text{,15 = 10}}{\text{,8}} \Rightarrow {\text{R = 27(}}{{\text{C}}_2}{H_3} - ) \Rightarrow X:{C_2}{H_3}COOH{\text{ (axit acrylic)}}{\text{.}} \hfill \\ \end{gathered} \)
Đáp án C.
Chất nào sau đây không có phản ứng tráng gương?
Phản ứng tráng gương là phản ứng đặc trưng cho hợp chất có nhóm –CHO hoặc trong môi trường kiềm chuyển thành nhóm –CHO như anđehit (R(CHO)n), axit fomic (HCOOH), muối của axit fomic, este của axit fomic, glucozơ, fructozơ, …
CH3CHO (etanal), CH3COOH (axit axetic), C6H12O6 (fructozơ), HCOOH (axit fomic)
Các chất có phản ứng tráng gương là CH3CHO, C6H12O6, HCOOH:
\(\begin{gathered} C{H_3}CHO\xrightarrow{{ + AgN{O_3}/N{H_3}}}C{H_3}COON{H_4} + 2Ag \downarrow \hfill \\ \underbrace {{C_5}{H_{11}}{O_5}CHO}_{Frutoz{\text{\neg }}}\xrightarrow{{ + AgN{O_3}/N{H_3}}}{C_5}{H_{11}}{O_5}COON{H_4} + 2Ag \downarrow \hfill \\ HCOOH\xrightarrow{{ + AgN{O_3}/N{H_3}}}{(N{H_4})_2}C{O_3} + 2Ag \downarrow \hfill \\ \end{gathered} \)
CH3COOH không có phản ứng tráng bạc nhưng vẫn tác dụng với NH3 trong dung dịch AgNO3/NH3:
\(C{H_3}COOH + N{H_3} \to C{H_3}COON{H_4}\)
Đáp án B.
Để hòa tan vừa hết 24,4 gam hỗn hợp MgO và Al2O3 cần vừa đủ 700ml dung dịch H2SO4 1M. Cô cạn dung dịch sau phản ứng được m gam muối. Giá trị của m là:
\({n_{{H_2}S{O_4}}} = 0,7.1 = 0,7{\text{ mol}}\)
Đặt công thức chung cho MgO và Al2O3 là M2On
Sơ đồ phản ứng: \(\underbrace {{M_2}{O_n}}_{24,4{\text{ gam}}\left\{ \begin{subarray}{l} {M^{n + }} \\ {O^{2 - }} \end{subarray} \right.} + \underbrace {{H_2}S{O_4}}_{0,7{\text{ mol}}} \to \underbrace {{M_2}{{(S{O_4})}_n}}_{muoi\left\{ \begin{subarray}{l} {M^{n + }} \\ SO_4^{2 - } \end{subarray} \right.} + {H_2}O\)
Điện tích dương Mn+ không đổi nên điện tích âm bằng nhau:
\(\begin{gathered} \xrightarrow{{BT{\text{ dien}}\,{\text{tich}}}}2.{n_{{O^{2 - }}}} = 2.{n_{SO_4^{2 - }}} \Rightarrow {n_{{O^{2 - }}}} = {n_{SO_4^{2 - }}} = 0,7{\text{ mol}} \hfill \\ {{\text{m}}_{{M_2}{{(S{O_4})}_n}}} - {m_{{M_2}{O_n}}} = {m_{SO_4^{2 - }}} - {m_{{O^{2 - }}}} \Rightarrow {{\text{m}}_{{M_2}{{(S{O_4})}_n}}} - 24,4 = 96.0,7 - 16.0,7 \hfill \\ \Rightarrow {{\text{m}}_{{M_2}{{(S{O_4})}_n}}} = 80,4{\text{ gam}} \Rightarrow {\text{m = }}{{\text{m}}_{{M_2}{{(S{O_4})}_n}}} = 80,4{\text{ gam}} \hfill \\ \end{gathered} \)
Tiến hành các thí nghiệm sau:
(1) Cho dung dịch NaI vào dung dịch AgNO3.
(2) Cho dung dịch Na2SO4 vào dung dịch BaCl2.
(3) Cho dung dịch Ba(OH)2 dư vào dung dịch NaHCO3.
(4) Cho dung dịch Na2CO3 vào dung dịch CaCl2.
(5) Cho dung dịch NaOH tới dư vào dung dịch AlCl3.
(6) Cho dung dịch AgNO3 vào dung dịch H3PO4.
Sau khi các phản ứng xảy ra hoàn toàn, có bao nhiêu thí nghiệm thu được kết tủa?
(1) \(NaI + AgN{O_3} \to AgI \downarrow + NaN{O_3}\)
(2) \(N{a_2}S{O_4} + BaC{l_2} \to BaS{O_4} \downarrow + 2NaCl\)
(3) \(\left\{ \begin{gathered} HCO_3^ - + O{H^ - } \to CO_3^{2 - } + {H_2}O \hfill \\ B{a^{2 + }} + CO_3^{2 - } \to BaC{O_3} \downarrow \hfill \\ \end{gathered} \right.\)
(4) \(N{a_2}C{O_3} + CaC{l_2} \to CaC{O_3} \downarrow + 2NaCl\)
(5) \(\left\{ \begin{gathered} AlC{l_3} + 3NaOH(du) \to Al{(OH)_3} \downarrow + 3NaCl \hfill \\ Al{(OH)_3} + NaOH(du) \to NaAl{O_2} + 2{H_2}O \hfill \\ \end{gathered} \right.\)
(6) \(AgN{O_3} + {H_3}P{O_4} \to \)không phản ứng
Các thí nghiệm thu được kết tủa là (1), (2), (3), (4).
Đáp án A.
Dung dịch chất nào sau đây được dùng để khắc hình, khắc chữ lên thủy tinh?
Dung dịch được dùng để khắc hình, chữ lên thủy tinh là dung dịch HF vì:
\(Si{O_2} + 4HF \to Si{F_4} + 2{H_2}O\)
(SiO2 có trong thủy tinh)
Đáp án D.
Cho các phát biểu sau:
(a) Cho dung dịch AgNO3 dư vào dung dịch FeCl2 sau phản ứng thu được hai chất kết tủa.
(b) Kim loại Cu tác dụng với dung dịch hỗn hợp NaNO3 và H2SO4 (loãng).
(c) Hỗn hợp Cu, Fe3O4 có số mol bằng nhau tan hết trong nước.
(d) Cho bột Cu vào lượng dư dung dịch FeCl3, thu được dung dịch chứa hai muối.
(e) Hỗn hợp Al và Na2O (tỉ lệ mol tương ứng là 2:1) tan hoàn toàn trong nước dư.
(f) Cho Ba(OH)2 dư vào dung dịch Al2(SO4)3 sau phản ứng thu được hai chất kết tủa.
Số phát biểu đúng là:
(a) Phát biểu (a) đúng
(b) \(\left\{ \begin{gathered} A{g^ + } + F{e^{2 + }} \to F{e^{3 + }} + Ag \downarrow \hfill \\ A{g^ + } + C{l^ - } \to AgCl \downarrow \hfill \\ \end{gathered} \right. \Rightarrow \)\(3Cu + 2NO_3^ - + 8{H^ + } \to 3C{u^{2 + }} + 2NO \uparrow + 4{H_2}O \Rightarrow \)
Phát biểu (b) sai.
(c) Cu và Fe3O4 đều không tan trong nước → Phát biểu (c) sai
(d) Cu + 2FeCl3 (dư) \(\to CuC{l_2} + 2FeC{l_2}\)
→ Dung dịch thu được chứa 3 muối: CuCl2, FeCl2, FeCl3 dư ![]() Phát biểu (d) sai
Phát biểu (d) sai
(e) \(\left\{ \begin{gathered} N{a_2}O + {H_2}O \to 2NaOH \hfill \\ 1 \to {\text{ 2}} \hfill \\ 2Al + 2NaOH + 2{H_2}O \to 2NaAl{O_2} + 3{H_2} \uparrow \hfill \\ 2{\text{ 2}} \hfill \\ \end{gathered} \right.\)
Hỗn hợp Al và Na2O \(({n_{Al}}:{n_{N{a_2}O}} = 2:1)\) tan hoàn toàn trong nước dư
Phát biểu (e) đúng
(f) \(\left\{ \begin{gathered} A{l_2}{(S{O_4})_3} + 3Ba{(OH)_2} \to 2Al{(OH)_3} \downarrow + 3BaS{O_4} \downarrow \hfill \\ 2Al{(OH)_3} + Ba{(OH)_2}(du) \to Ba{(Al{O_2})_2} + 4{H_2}O \hfill \\ \end{gathered} \right.\)
Thu được một chất kết tủa là BaSO4 Phát biểu (f) sai
Các phát biểu đúng là (a), (b), (e).
Đáp án C.
Cho các phản ứng:
(a) \(Fe{(OH)_2} + 2HCl \to FeC{l_2} + 2{H_2}O\)
(b) \(Ba{(OH)_2} + {H_2}S{O_4} \to BaS{O_4} + 2{H_2}O\)
(c) \(KHC{O_3} + KOH \to {K_2}C{O_3} + {H_2}O\)
\(Ba{(OH)_2} + 2HCl \to BaC{l_2} + 2{H_2}O\)
Phản ứng có phương trình ion thu gọn: \({H^ + } + O{H^ - } \to {H_2}O\) là:
(a) \(\left\{ \begin{gathered} Pha{\text{n tu:Fe(OH}}{{\text{)}}_2} + 2HCl \to FeC{l_2} + 2{H_2}O \hfill \\ Ion:Fe{(OH)_2} + 2{H^ + } \to F{e^{2 + }} + 2{H_2}O \hfill \\ \end{gathered} \right.\)
(b) \(\left\{ \begin{gathered} Pha{\text{n tu:Ba(OH}}{{\text{)}}_2} + {H_2}S{O_4} \to BaS{O_4} \downarrow + 2{H_2}O \hfill \\ Ion:\left| \begin{gathered} B{a^{2 + }} + SO_4^{2 - } \to BaS{O_4} \downarrow \hfill \\ {H^ + } + O{H^ - } \to {H_2}O \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} \right.\)
(c) \(\left\{ \begin{gathered} Pha{\text{n tu:KHC}}{{\text{O}}_3} + KOH \to {K_2}C{O_3} + {H_2}O \hfill \\ Ion:HCO_3^ - + O{H^ - } \to CO_3^{2 - } + {H_2}O \hfill \\ \end{gathered} \right.\)
(d) \(\left\{ \begin{gathered} Pha{\text{n tu:Ba(OH}}{{\text{)}}_2} + 2HCl \to BaC{l_2} + 2{H_2}O \hfill \\ Ion:{H^ + } + O{H^ - } \to {H_2}O \hfill \\ \end{gathered} \right.\)
Đáp án B.
Dung dịch nào sau đây phản ứng với dung dịch NH3 dư thu được kết tủa?
\(\begin{gathered} {H_2}S{O_4} + 2N{H_3} \to {(N{H_4})_2}S{O_4} \hfill \\ {K_2}S{O_4} + N{H_3} \to khong\,phan\,ung \hfill \\ {\text{HCl + N}}{{\text{H}}_3} \to N{H_4}Cl \hfill \\ AlC{l_3} + 3N{H_3} + 3{H_2}O \to Al{(OH)_3} \downarrow + 3N{H_4}Cl \hfill \\ \end{gathered} \)
Tác nhân gây hiệu ứng nhà kính chủ yếu do chất nào sau đây?
CO2, CH4, H2O, N2O,… là các tác nhân gây hiệu ứng nhà kính.
Đáp án A.
Nhiệt phân 40,3 gam hỗn hợp X gồm KMnO4 và KClO3, sau một thời gian thu được khí O2 và 29,9 gam chất rắn Y gồm KMnO4, K2MnO4, MnO2 và KCl. Để hòa tan hoàn toàn Y cần vừa đủ dung dịch chứa 0,7 mol HCl. Phần trắm khối lượng KMnO4 bị nhiệt phân là:
Các phương trình phản ứng:
Nhiệt phân hỗn hợp X:
\(\begin{gathered} 2KMn{O_4}\xrightarrow{{{t^0}}}{K_2}Mn{O_4} + Mn{O_2} + {O_2} \uparrow \hfill \\ 2KCl{O_3}\xrightarrow{{{t^0}}}2KCl + 3{O_2} \uparrow \hfill \\ \end{gathered} \)
Chất rắn Y gồm K2MnO4, MnO2, KCl, KMnO4 dư. Chất rắn Y tác dụng với dung dịch HCl đặc:
\(\begin{gathered} {K_2}Mn{O_4} + 8HCl \to 2KCl + MnC{l_2} + 2C{l_2} \uparrow + 4{H_2}O \hfill \\ Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} \uparrow + 2{H_2}O \hfill \\ 2KMn{O_4} + 16HCl \to 2KCl + 2MnC{l_2} + 5C{l_2} \uparrow + 8H{}_2O \hfill \\ \end{gathered} \)
Tính toán:
Gọi số mol các chất trong hỗn hợp X là KMnO4: a mol; KClO3: b mol. Ta có:
\({m_{KMn{O_4}}} + {m_{KCl{O_3}}} = {m_X} \Rightarrow 158a + 122,5b = 40,3{\text{ }}(I)\)
Sơ đồ phản ứng:
\(\begin{gathered} {m_X} = {m_Y} + {m_{{O_2}}} \Rightarrow 40,3 = 29,9 + {m_{{O_2}}} \Rightarrow {m_{{O_2}}} = 10,4{\text{ gam}} \Rightarrow {{\text{n}}_{{O_2}}} = \frac{{10,4}}{{32}} = 0,325{\text{ mol}} \hfill \\ \xrightarrow{{BT{\text{ H}}}}{n_{HCl}} = 2.{n_{{H_2}O}} \Rightarrow 0,7 = 2.{n_{{H_2}O}} \Rightarrow {n_{{H_2}O}} = 0,35{\text{ mol}} \hfill \\ \end{gathered} \)
\(4.{n_{KMn{O_4}}} + 3.{n_{KCl{O_3}}} = 2.{n_{{O_2}}} + \underbrace {{n_{{H_2}O}}}_{{n_{O(Y)}}} \Rightarrow 4a + 3b = 2.0,325 + 0,35 \Rightarrow 4a + 3b = 1{\text{ (II)}}\)
Bảo toàn khối lượng cho giai đoạn nhiệt phân X ta có:
Theo sơ đồ thì cuối cùng O trong Y chuyển hết về H2O. Bảo toàn nguyên tố O cho giai đoạn nhiệt phân X ta có:
\(4.{n_{KMn{O_4}}} + 3.{n_{KCl{O_3}}} = 2.{n_{{O_2}}} + \underbrace {{n_{{H_2}O}}}_{{n_{O(Y)}}} \Rightarrow 4a + 3b = 2.0,325 + 0,35 \Rightarrow 4a + 3b = 1{\text{ (II)}}\)
Tổ hợp (I) và (II) ta được: a=0,1 mol; b=0,2 mol
Xét giai đoạn nhiệt phân X:
Gọi x là số mol KMnO4 phản ứng
\(\begin{gathered} 2KMn{O_4}\xrightarrow{{{t^0}}}{K_2}Mn{O_4} + Mn{O_2} + {O_2} \uparrow \hfill \\ x \to {\text{ }}\frac{x}{2} \hfill \\ 2KCl{O_3}\xrightarrow{{{t^0}}}2KCl + 3{O_2} \uparrow \hfill \\ 0,2 \to {\text{ 0}}{\text{,3}} \hfill \\ \end{gathered} \)
Ta có: \({n_{{O_2}}} = \frac{x}{2} + 0,3 = 0,325 \Rightarrow x = 0,05{\text{ mol}}\)
Hiệu suất nhiệt phân KMnO4 là: \({H_{KMn{O_4}}} = \frac{x}{a}.100 = \frac{{0,05}}{{0,1}}.100 = 50\% \)
Đáp án A.
Tiến hành lên men m gam tinh bột (hiệu suất toàn quá trình đạt 81%) rồi hấp thụ toàn bộ lượng CO2 sinh ra vào nước vôi trong dư thu được 70 gam kết tủa. Giá trị m là:
Xét giai đoạn hấp thụ CO2 vào dung dịch nước vôi trong dư:
Kết tủa thu được là CaCO3 \( \Rightarrow {n_{CaC{O_3}}} = \frac{{70}}{{100}} = 0,7{\text{ mol}}\)
Sơ đồ phản ứng: \(C{O_2} + Ca{(OH)_2}(du) \to CaC{O_3} \downarrow + {H_2}O\)
\(\xrightarrow{{BT{\text{ C}}}}{n_{C{O_2}}} = {n_{CaC{O_3}}} \Rightarrow {n_{C{O_2}}} = 0,7{\text{ mol}}\)
Xét giai đoạn lên men tinh bột;
Sơ đồ phản ứng: \({({C_6}{H_{10}}{O_5})_n}\xrightarrow{{ + {H_2}O}}n{C_6}{H_{12}}{O_6} \to 2n{C_2}{H_5}OH + 2nC{O_2}\)
Lấy n=1
\(\begin{gathered} 2.{n_{{C_6}{H_{10}}{O_5}(pu)}} = {n_{C{O_2}}} \Rightarrow 2.{n_{{C_6}{H_{10}}{O_5}(pu)}} = 0,7 \Rightarrow {n_{{C_6}{H_{10}}{O_5}(pu)}} = 0,35{\text{ mol}} \hfill \\ {\text{H = }}\frac{{{n_{{C_6}{H_{10}}{O_5}(pu)}}}}{{{n_{{C_6}{H_{10}}{O_5}(ban{\text{ au}})}}}}.100 \Rightarrow {n_{{C_6}{H_{10}}{O_5}(ban{\text{ dau}})}} = \frac{{100}}{H}.{n_{{C_6}{H_{10}}{O_5}(pu)}} = \frac{{100}}{{81}}.0,35{\text{ mol}} \hfill \\ {\text{m = }}{{\text{m}}_{{C_6}{H_{10}}{O_5}(ban{\text{ dau}})}} = [\frac{{100}}{{81}}.0,35].162 = 70{\text{ gam}}{\text{.}} \hfill \\ \end{gathered} \)
Đáp án D.
Trong các polime: poli(etylen terephtalat), poliacrilonnitrin, polistiren, poli(metyl metacrylat). Số polime được điều chế bằng phản ứng trùng ngưng là:
Điều kiện về cấu tạo của monome tham gia phản ứng trùng hợp là phân tử phải có C=C, C![]() C hoặc vòng kém bền.
C hoặc vòng kém bền.
Điều kiện về cấu tạo của monome tham gia phản ứng trùng ngưng là trong phân tử phải có ít nhất hai nhóm chức có khả năng phản ứng để tạo thành polime và các phân tử nhỏ như H2O,.. Poliacrilonnitrin, polistiren, poli(metyl metacrylat) được điều chế bằng phản ứng trùng hợp. Poli( etylen terephtalat) được điều chế bằng phản ứng trùng ngưng.
Đáp án B.
Cho dung dịch chứa a mol H3PO4 vào dung dịch chứa 2,5a mol KOH, sau phản ứng thu được dung dịch chứa chất tan là:
\(2 < \frac{{{n_{KOH}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{{2,5a}}{a} = 2,5 < 3 \Rightarrow \)Tạo 2 muối: H2HPO4 và K3PO4
\(\begin{gathered} {H_3}P{O_4} + 2KOH \to {K_2}HP{O_4} + 2{H_2}O \hfill \\ {H_3}P{O_4} + 3KOH \to {K_3}P{O_4} + 3{H_2}O \hfill \\ \end{gathered} \)
Hỗn hợp X gồm ankan (a mol), anken, ankin (a mol). Đốt cháy hoàn toàn m gam X cần V lít (đktc) O2 thu được (2b+5,6) gam CO2 và b gam H2O. Giá trị của V và m lần lượt là:
\(\begin{gathered} ({k_{ankan}} - 1).{n_{ankan}} + ({k_{anken}} - 1).{n_{anken}} + ({k_{ankin}} - 1).{n_{ankin}} = {n_{C{O_2}}} - {n_{{H_2}O}} \hfill \\ \Rightarrow - {n_{ankan}} + {n_{ankin}} = {n_{C{O_2}}} - {n_{{H_2}O}} \Rightarrow - a + a = {n_{C{O_2}}} - {n_{{H_2}O}} \Rightarrow {n_{C{O_2}}} = {n_{{H_2}O}} \hfill \\ \Rightarrow \frac{{2b + 5,6}}{{44}} = \frac{b}{{18}} \Rightarrow b = 12,6{\text{ gam}} \Rightarrow {n_{C{O_2}}} - {n_{{H_2}O}} = \frac{{12,6}}{{18}} = 0,7{\text{ mol}} \hfill \\ \end{gathered} \)
\(\begin{gathered} \xrightarrow{{BT{\text{ O}}}}2.{n_{{O_2}}} = 2.{n_{C{O_2}}} + {n_{H{}_2O}} \Rightarrow 2.{n_{{O_2}}} = 2.0,7 + 0,7 \Rightarrow {n_{{O_2}}} = 1,05{\text{ mol}} \hfill \\ {\text{V = }}{{\text{V}}_{{O_2}}} = 1,05.22,4 = 23,52{\text{ li t}} \hfill \\ \end{gathered} \)
\(m = {m_{C(X)}} + {m_{H(X)}} = 12.0,7 + 2.0,7 = 9,8{\text{ gam}}{\text{.}}\)
Phát biểu nào sau đây không đúng?
Phenol (C6H5OH) có tính axit rất yếu, yếu hơn cả axit cacbonic (H2CO3) ![]() Phenol bị CO2 đẩy ra khỏi dung dịch muối:
Phenol bị CO2 đẩy ra khỏi dung dịch muối:
\(C{O_2} + {C_6}{H_5}ONa + {H_2}O \to {C_6}{H_5}OH \downarrow + NaHC{O_3}\)
Đáp án D.
Cho các phát biểu sau:
(1) Kim loại Na, K đều khử nước ở điều kiện thường.
(2) Để bảo quản natri, người ta ngâm natri trong dầu hỏa.
(3) Điện phân dung dịch CuSO4 thu được Cu ở anot.
(4) Cho Na kim loại vào dung dịch FeSO4 thu được Fe.
(5) Kim loại Fe có thể điều chế bằng phương pháp thủy luyện, nhiệt luyện, điện phân.
Số phát biểu đúng là:
Các kim loại tác dụng với H2O ở điều kiện thường gồm: Li, Na, K, Rb, Cs, Ca, Sr, Ba.
Phát biểu (1) đúng
Vì các kim loại kiềm (Li, Na, K, Rb, Cs) dễ tác dụng với nước, với oxi trong không khí nên để bảo quản, người ta thường ngâm chìm các kim loại kiềm trong dầu hỏa
Phát biểu (2) đúng
Phát biểu (3) sai
Phát biểu (4) sai
Kim loại Fe có thể được điều chế bằng phương pháp thủy luyện, nhiệt luyện, điện phân
Phát biểu (5) đúng
Các phát biểu đúng là (1), (2), (5). Đáp án D.
Kim loại nào sau đây không tan trong dung dịch HCl?
Cu, Ag, Au, Pt, Hg là các kim loại đứng sau hiđro trong dãy điện hóa, do đó chúng không tác dụng với dung dịch HCl, H2SO4 loãng.
Các phương trình hóa học:
\(\begin{gathered} Mg + 2HCl \to MgC{l_2} + {H_2} \uparrow \hfill \\ Fe + 2HCl \to FeC{l_2} + {H_2} \uparrow \hfill \\ Zn + 2HCl \to ZnC{l_2} + {H_2} \uparrow \hfill \\ \end{gathered} \)
\(Ag + HCl \to \)không phản ứng
Đáp án D.
Chất nào sau đây tác dụng với dung dịch HNO3 loãng sinh ra khí NO?
Chất có tính khử (số oxi hóa không phải cáo nhất) tác dụng với dung dịch HNO3 sẽ sinh ra sản phẩm khử của N+5 (NO2, NO, N2O, N2, NH4NO3)
Các phương trình hóa học:
\(\begin{gathered} CuO + 2HN{O_3} \to Cu{(N{O_3})_2} + H{}_2O \hfill \\ Ca{(OH)_2} + 2HN{O_3} \to Ca{(N{O_3})_2} + 2{H_2}O \hfill \\ 3Cu + 8HN{O_3}(loang) \to 3Cu(N{O_3}){}_2 + 2NO + 4{H_2}O \hfill \\ CaC{O_3} + 2HN{O_3} \to Ca{(N{O_3})_2} + C{O_2} \uparrow + {H_2}O \hfill \\ \end{gathered} \)
Đáp án C.
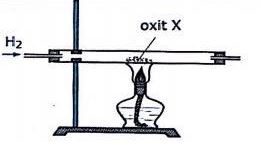
Tiến hành thí nghiệm khử oxit X thành kim loại bằng khí H2 (dư) theo sơ đồ hình vẽ:
Oxit X là:
H2 chỉ khử được oxit của kim loại sau Al trong dãy hoạt động hóa học. Thí dụ:
\(\begin{gathered} {H_2} + CuO\xrightarrow{{{t^0}}}Cu + {H_2}O \hfill \\ {H_2} + {K_2}O\xrightarrow{{{t^0}}}khong\,phan\,ung \hfill \\ \end{gathered} \)
\(\begin{gathered} {H_2} + MgO\xrightarrow{{{t^0}}}khong\,phan\,ung \hfill \\ {H_2} + A{l_2}{O_3}\xrightarrow{{{t^0}}}khong\,phan\,ung \hfill \\ \end{gathered} \)
Đáp án C.
Nguyên tử của nguyên tố lưu huỳnh có số điện tích hạt nhân là 16. Số electron lớp ngoài cùng của nguyên tử lưu huỳnh là:
Cấu hình electron của lưu huỳnh là : \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^4} \Rightarrow \) Cấu hình electron lớp ngoài cùng của nguyên tử lưu huỳnh là \(3{s^2}3{p^4} \Rightarrow \) Số electron lớp ngoài cùng của nguyên tử lưu hunhf là 6.
Đáp án C.
Số đồng phân cấu tạo amin bậc 2 của C4H11N là:
Số đồng phân cấu tạo amin bậc 2 của C4H11N là: 3
Cho các phát biểu sau:
(a) Trong peptit mạch hở amino axit đầu N có nhóm NH2
(b) Dung dịch Lysin làm quỳ tím hóa xanh.
(c) 1 mol Val-Val-Lys tác dụng tối đa với dung dịch chứa 3 mol HCl.
(d) 1 mol Val-Glu tác dụng tối đa với dung dịch chứa 3 mol KOH.
(e) Thủy phân hoàn toàn protein thu được các ![]() amino axit.
amino axit.
(f)Dung dịch protein có phản ứng màu biure tạo sản phẩm có màu tím đặc trưng.
Số phát biểu đúng là:
Trong peptit mạch hở amino axit đầu N có nhóm NH2 →Phát biểu (a) đúng
Lys (2NH2, 1COOH) →Số nhóm NH2 > Số nhóm COOH→ Dung dịch Lysin làm quỳ tím hóa xanh ![]() Phát biểu (b) đúng
Phát biểu (b) đúng
Val-Val-Lys + 2 H2O + 4HCl → 2Val-HCl + Lys(HCl)2 (vì Lys có 2NH2)
Phát biểu (c) sai
\(Val - Glu + 3KOH \to Val - K + Glu{K_2} + 2{H_2}O\) (vì Glu có 2COOH)
→ Phát biểu (d) đúng
Thủy phân hoàn toàn protein thu được các \(\alpha - \)amino axit →Phát biểu (e) đúng
Dung dịch protein có phản ứng màu biure tạo sản phẩm có màu tím đặc trưng
→ Phát biểu (f) đúng
Các phát biểu đúng là (a), (b), (d), (e), (f).
Đáp án D.
Cho sơ đồ phản ứng:
\(\begin{gathered} X + {H_2}{\text{ du}}\xrightarrow{{Ni,{t^0}}}Y \hfill \\ Y + Na\xrightarrow{{}}CH{}_3 - CH{}_2 - C{H_2} - ONa + {H_2} \hfill \\ \end{gathered} \)
Số chất X (mạch hở, có cấu tạo bền) thỏa mãn sơ đồ trên là:
\(Y + Na \to C{H_3} - C{H_2} - C{H_2} - ONa + {H_2} \Rightarrow Y:C{H_3} - C{H_2} - C{H_2} - OH\)
Các chất X thỏa mãn là \(\begin{gathered} C{H_2} = CH - C{H_2}OH \hfill \\ CH \equiv C - C{H_2}OH \hfill \\ C{H_3} - C{H_2} - CHO \hfill \\ C{H_2} = CH - CHO \hfill \\ CH \equiv C - CHO \hfill \\ \end{gathered} \)
Cho các phát biểu sau:
(1) Saccarozơ, amilozơ và xenlulozơ đều tham gia phản ứng thủy phân trong môi trường axit đun nóng.
(2) Tinh bột và xenlulozơ đều có công thức là (C6H10O5)n nhưng chúng không phải đồng phân của nhau.
(3) Xenlulozơ được tạo bởi các gốc glucozơ liên kết với nhau.
(4) Thủy phân đến cùng amylopectin, thu được hai loại monosaccarit.
(5) Dung dịch fructozơ có phản ứng tráng bạc.
(6) Saccarozơ là một polisaccarit.
Số phát biểu đúng là:
Saccarozơ (C12H22O11), amilozơ ((C6H10O5)n) và xenlulozơ ((C6H10O5)n) đều tham gia phản ứng thủy phân trong môi trường axit đun nóng → Phát biểu (1) đúng
(2) Tinh bột và xenlulozơ đều có công thức là (C6H10O5)n nhưng chúng không phải đồng phân của nhau vì n khác nhau → Phát biểu (2) đúng
Xenlulozơ được tạo bởi gốc glucozơ liên kết với nhau → Phát biểu (3) đúng
Thủy phân đến cùng amilopectin, thu được một loại monosaccarit là glucozơ:
\(\underbrace {{{({C_6}{H_{10}}{O_5})}_n}}_{amilopectin} + n{H_2}O\xrightarrow{{{H^ + },{t^0}}}n\underbrace {{C_6}{H_{12}}{O_6}}_{glucozo}\)
![]() Phát biểu (4) sai.
Phát biểu (4) sai.
Dung dịch frutozơ có phản ứng tráng bạc →Phát biểu (5) đúng
Saccarozơ là một đissaccarit → Phát biểu (6) đúng
Các phát biểu đúng là (1), (2), (3), (5). Đáp án B.
Chất nào sau đây thuộc loại polisaccarit?
Xenlulozơ thuộc loại polisaccarit
Poli vinyl clorua (PVC) được điều chế từ?
Poli vinyl clorua (PVC) được điều chế từ CH2=CHCl
Cho dung dịch NaOH vào dung dịch chất X, thu được kết tủa màu trắng xanh, để ngoài không khí chuyển sang màu nâu đỏ. Chất X là
Cho dung dịch NaOH vào dung dịch chất X, thu được kết tủa màu trắng xanh, để ngoài không khí chuyển sang màu nâu đỏ. Chất X là FeCl2
Benzyl axetat là este có mùi thơm của hoa nhài. Công thức của benzyl axetat là
Công thức của benzyl axetat là CH3COOCH2C6H5.
Kim loại nào sau đây là kim loại kiềm thổ?
Ca là kim loại kiềm thổ
Chất bột X màu đỏ, được quét lên phía ngoài của vỏ bao diêm. Chất X là
Chất bột X màu đỏ, được quét lên phía ngoài của vỏ bao diêm. Chất X là photpho
Kim loại nào sau đây có thể điều chế được bằng cách dùng CO khử oxit của nó?
Fe có thể điều chế được bằng cách dùng CO khử oxit của nó
Kim loại Mg không tác dụng được với chất nào sau đây ở nhiệt độ thường?
Kim loại Mg không tác dụng được với NaOH ở nhiệt độ thường