Đề thi thử THPT QG năm 2022 môn Hóa học - Trường THPT Nguyễn Thái Bình
Đề thi thử THPT QG năm 2022 môn Hóa học - Trường THPT Nguyễn Thái Bình
-
Hocon247
-
40 câu hỏi
-
90 phút
-
54 lượt thi
-
Dễ
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Trộn KMnO4 và KClO3 với một lượng bột MnO2 trong bình kính thu được hỗn hợp X. Lấy 52,550 gam X đem nung nóng , sau một thời gian thu được hỗn hợp chất rắn Y và V lít khí O2. Biết KClO3 bị nhiệt phân hoàn toàn tạo 14,9 gam KCl chiếm 36,315% khối lượng Y. Sau đó cho toàn bộ Y tác dụng hoàn toàn với axit HCl đặc du đung nóng , sau phản ứng cô cạn dung dịch thu được 51,275 gam muối khan. Hiệu suất của quá trình nhiệt phân muối KMnO4 trong X là :
\(\begin{array}{l} {n_{KCl}} = 0,2 \to {n_{KCl{O_3}}} = 0,2{\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {m_Y} = \frac{{14,9}}{{0,36315}} = 41,03{\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} \\ \to n_{{O_2}}^ \uparrow = \frac{{52,550 - 41,03}}{{32}} = 0,36 \end{array}\)
Vì cho X hoặc Y tác dụng với HCl thì khối lượng muối như nhau nên.Ta có ngay :
\(\begin{array}{l} {m_X} = 52,55\left\{ \begin{array}{l} KMn{O_4}:a\\ KCl{O_3}:0,2\\ Mn{O_2}:b \end{array} \right. \to \left\{ \begin{array}{l} KCl:a + 0,2\\ MnC{l_2}:a + b \end{array} \right.\\ \to \left\{ \begin{array}{l} 74,5(a + 0,2) + 126(a + b) = 51,275\\ 158a + 87b = 52,55 - 24,5 \end{array} \right. \end{array}\)
\(\begin{array}{l} \to \left\{ \begin{array}{l} a = 0,15\\ b = 0,05 \end{array} \right.{\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} \\ {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} 2KMn{O_4} \to {K_2}Mn{O_4} + Mn{O_2} + {O_2}{\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} {\mkern 1mu} \\ \to H\% = \frac{{0,36 - 0,3}}{{0,075}} = 80\% \end{array}\)
Hỗn hợp X gồm hiđro, propen, axit acrylic, ancol anlylic (C3H5OH). Đốt cháy hoàn toàn 1,0 mol X thu được 39,6 gam CO2. Đun nóng X với Ni một thời gian, thu được hỗn hợp Y. Tỉ khối của Y so với X bằng 1,25. Cho 0,32mol Y phản ứng vừa đủ với V lít dung dịch Br2 0,1M. Giá trị của V là
X gồm hidro, C3H6, C3H4O2,C3H6O. Ta thấy ngoài hidro thì các chất còn lại đều có 3 C và đều phản ứng với hidro theo tỉ lệ mol 1 : 1.
n CO2 = 0,9 mol
=> n chất hữu cơ trong X = 0,3 mol => nH2 = 0,7 mol
Có dY/X = 1,25.
=> số mol liên kết pi có thể phản ứng với hidro trong Y = 0,3 – 0,2 = 0,1 mol
=> 0,8 mol Y phản ứng với Br2 thì nBr2 = 0,1 mol
Với 0,32 mol Y thì nBr2 = 0,04mol
=> V = 0,4 lít
Có các phát biểu sau:
(1) Thủy phân chất béo trong môi trường kiềm luôn thu được glixerol.
(2) Triolein làm mất màu nước brom.
(3) Chất béo không tan trong nước và nhẹ hơn nước.
(4) Benzyl axetat là este có mùi chuối chín.
(5) Đốt cháy etyl axetat thu được số mol nước bằng số mol khí cacbonic.
Số phát biểu đúng là:
(1) Thủy phân chất béo trong môi trường kiềm luôn thu được glixerol.
(2) Triolein làm mất màu nước brom.
(3) Chất béo không tan trong nước và nhẹ hơn nước.
(5) Đốt cháy etyl axetat thu được số mol nước bằng số mol khí cacbonic.
X, Y là hai hữu cơ axit mạch hở. Z là ancol no, T là este hai chức mạch hở không nhánh tạo bởi X, Y, Z. Đun 29,145 gam hỗn hợp E chứa X, Y, Z, T với 300 ml dung dịch NaOH 1M vừa đủ thu được ancol Z và hỗn hợp F chứa hai muối có số mol bằng nhau. Cho Z vào bình chứa Na dư thấy bình tăng 14,43 gam và thu được 4,368 lít H2 (ở đktc). Đốt hoàn toàn hỗn hợp F cần 11,76 lít O2 (đktc) thu được khí CO2, Na2CO3 và 5,4 gam H2O. Phần trăm khối lượng của T trong E là
B1 : Xác định chất Z
Z + Na : nH2 = 0,195 mol
Giả sử Z có n nhóm OH
mbình tăng = mancol – mH2 => mancol = 14,82g
=> nancol = nH2.2/n => Mancol = 38n
Với n = 2 thì M = 76 => ancol C3H8O2 và nancol = 0,195 mol
B2 : Xác định CT và lượng chất của 2 muối hữu cơ
Vì este 2 chức mạch hở => 2 axit phải là axit đơn chức.
=> nX = nY (vì sau phản ứng với NaOH tạo số mol 2 muối bằng nhau)
Bảo toàn Na : nNa2CO3 = ½ nNaOH = 0,15 mol
Có : nCOONa = nNaOH pứ = 0,3 mol => mmỗi muối = 0,15 mol ; nO2 = 0,525 ; nH2O = 0,3 mol
Bảo toàn O : 2nF + 2nO2 = 2nCO2 + 3nNa2CO3 + nH2O
=> nCO2 = 0,45 mol
Bảo toàn khối lượng : mF + mO2 = mCO2 + mNa2CO3 + mH2O
=> mF = 24,3g
=> Mmuối 1 + Mmuối 2 = 162g
=> 2 muối thỏa mãn là : HCOONa và CH2=CHCOONa
B3 : Xác định T và %mT(E)
Gọi số mol este T là x
=> nC3H8O2 = 0,195 – x ; nHCOOH = nC2H3COOH = 0,15 – x
=> mE = 29,145 = 76(0,195 – x) + (46 + 72)(0,15 – x) + 158x
=> x = 0,09375 mol
=> %mT = 50,82%
Hỗn hợp X chứa hai amin kế tiếp thuộc dãy đồng đẳng của metylamin. Hỗn hợp Y chứa glyxin và lysin. Đốt cháy hoàn toàn 0,4 mol hỗn hợp Z (gồm X và Y) cần vừa đủ 2,055 mol O2, thu được 32,22 gam H2O, 35,616 lít (đktc) hỗn hợp CO2 và N2. Phần trăm khối lượng của amin có khối lượng phân tử nhỏ hơn trong Z là
Z bao gồm:
CnH2n+3N: a mol
C2H5NO2: b mol
C6H14N2O2 : c mol
=> nCO2 = na + 2b + 6c và nN2 = a/2 + b/2 + c
= > nCO2 + nN2 = na + a/2 + 5b/2 + 7c = 0,81 (1 )
nH20= a(2n + 3)/2 + 5b/2 + 7c = 0,91 (2)
=> a = 0,1
nz = 0,2 => b + c = 0,1 (3)
Bảo toàn O:
2(b + c) + 2no2 - 2nco2 + 11H20 —> nco2 = 0,68 => nN2 = a/2 + b/2 + c = 0,81 - 0,68 (4)
(2) (4) =>b = 0,04 và c = 0,06
nco2 = na + 2b + 6c = 0,68 => n = 2,4
=> X chứa C2H7N (0,06) và C3H9N (0,04) (Tính dựa vào c trung bình 2,4 và tổng số mol a = 0,1 )
Vậy Z chứa C2H7N (0,06); C3H9N (0,04); C2H5NO2 (0,04) và C6H14N2O2 (0,06)
=> %C2H7N = 14,42%
X là este của a-aminoaxit có công thức phân tử C5H11O2N; Y và Z là hai peptit mạch hở được tạo bởi glyxin và alanin có tổng số liên kết peptit là 7. Đun nóng 63,5 gam hỗn hợp E chứa X, Y, Z với dung dịch NaOH vừa đủ, thu được hỗn hợp chứa 2 muối và 13,8 gam ancol T. Đốt cháy toàn bộ hỗn hợp muối cần dùng 2,22 mol O2, thu được Na2CO3, CO2, H2O và 7,84 lít khí N2 (đktc). Phần trăm khối lượng của peptit có khối lượng phân tử lớn trong hỗn hợp E là
(*)Thủy phân trong H2O ( H+ , OH- ) → a - aa ban đầu
Ax + (x – 1) H2O → x. A
- Số pt H2O = số lk peptit
- BTKL : mpeptit + mH2O = maa ban đầu
(*) Thủy phân trong MT axit ( HCl )
Ax + (x – 1)H2O + xHCl → muối clorua
- số pt HCl = số nguyên tử N/ peptit = x
- BTKL : mpeptit + mH2O + mHCl = mmuối
(*) Thủy phân trong MT bazo : NaOH
Ax + xNaOH → muối natri + H2O
- số pt H2O = số Haxit / Ax
- BTKL : mpeptit + mNaOH = mmuối Natri + mH2O
=> nNaOH pứ = x.nH2O
B1 : Xác định lượng các muối natri của Gly và Ala
Đặt a , b là số mol muối GlyNa và AlaNa
Bảo toàn N : nN = a + b = 2nN2 = 0,7 mol
Có : nO2 = 2,25a + 3,75b = 2,22
=> a = 0,27 ; b = 0,43 mol
B2 : Xác định số mol Y và Z , biện luận số liên kết peptit trong Y và Z
=> mmuối = 73,92g và nNaOH = 0,7 mol
Bảo toàn khối lượng : nH2O = 0,21 mol
=> nY + nZ = 0,21 (1)
X là este của Gly hoặc Ala và ancol T.
Nếu X là H2N-CH(CH3)-COOC2H5 => nX = nC2H5OH = 0,3 mol( loại)
X là H2NCH2COOC3H7 => nX = nC3H7OH = 0,23 mol
=> Y, Z tạo ra từ 0,27 mol Gly và 0,43 – 0,3 = 0,13 mol Ala
=> Số N trung bình của Y, Z = (0,04 + 0,43) : 0,21 = 2,24
=>Y là dipeptit và Z là heptapeptit ( tổng số liên kết peptit bằng 7)
Có : nN = 2nY + 7nZ = 0,04 + 0,43 (2)
Từ (1), (2) => nY = 0,2 ; nZ = 0,01 mol
B3 : Biện luận thành phần Gly và Ala của Y và Z => %mY
Y là (Gly)u(Ala)2 – u
Z là (Gly)v(Ala)7 – v
=> nGly = 0,2u + 0,01v = 0,04
=> 20u + v = 4
=> u = 0 và v = 4 là cặp nghiệm duy nhất.
Vậy Y là (Ala)2 (0,2 mol)
Z là (Gly)4(Ala)3 (0,01 mol)
=> %mY = 50,39%
%mZ = 7,23%; %mX = 55,28
Cho hỗn hợp X gồm 0,15 mol P2O5, 0,15 mol K2O, 0,1 mol Na2O vào nước dư thu được dung dịch Y chứa m (gam) muối. Giá trị của m là :
Chú ý : Với bài toán axit nhiều nấc mình hay dùng kỹ thuật \(O{H^ - }\) cướp \({H^ + }\) do đó dễ thấy.
Ta có : \( \to \left\{ \begin{array}{l} {H_3}P{O_4}:0,3\\ KOH:0,3\\ NaOH:0,2 \end{array} \right. \to \left\{ \begin{array}{l} HPO_4^{2 - }:0,2\\ {H_2}PO_4^ - :0,1\\ {K^ + }:0,3\\ N{a^ + }:0,2 \end{array} \right. \to m = 45,2(gam)\)
Hỗn hợp X gồm Fe2O3 và Cu . Cho m gam hỗn hợp X tan hết trong dung dịch HCl vừa đủ thu được dung dịch Y chứa 122,76 gam chất tan. Cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 loãng vừa đủ thu được dung dịch Z chứa 3 chất tan với tỉ lệ số mol 1:2:3. Dung dịch Y làm mất màu tối đa bao nhiêu gam KMnO4 trong môi trường H2SO4?
Fe2O3 + 3 H2SO4 ![]() Fe2(SO4)3 + 3 H2O
Fe2(SO4)3 + 3 H2O
Cu + Fe2(SO4)3 ![]() CuSO4 + 2 FeSO4
CuSO4 + 2 FeSO4
Dung dịch Z gồm CuSO4, FeSO4, Fe2(SO4)3.
Đặt nCuSO4 = x; nFeSO4 = 2x và nFe2(SO4)3 = 3x
Dung dịch Y gồm FeCl2 2x mol, CuCl2 x mol, FeCl3 6x mol
mKMnO4 = 0,468.158 = 73,944 gam
Dưới đây là đồ thị biểu diễn mối quan hệ giữa thời gian điện phân và pH của dung dịch khi điện phân 400ml (xem thể tích không đổi) dung dịch gồm KCl, HCl và CuCl2 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện bằng I = 1,93A.
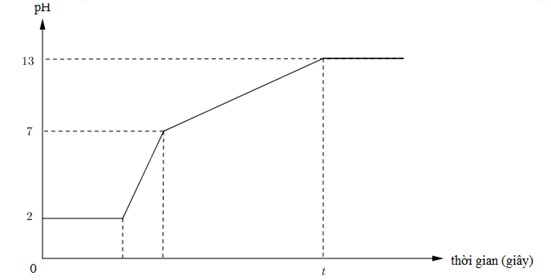
Giá trị của t trên đồ thị là
• đoạn thằng y = 2 ứng với quá trình điện phân CuCl2 → Cu + Cl2, pH của dung dịch không đổi.
và từ pH = 2 → CM (HCl) = 0,01 mol → có 0,004 mol HCl trong dung dịch ban đầu.
• đoạn thằng tiếp theo (2 → 7) là quá trình điện phân HCl → H2 + Cl2, nồng độ H+ giảm dần nên pH từ 2 → 7.
tại pH = 7 là ứng với thời điểm mà HCl điện phân hết, bắt đầu quá trình tiếp theo, dung dịch lúc này chỉ còn KCl.
• tiếp đó là quá quá trình: KCl + H2O → KOH + H2 + Cl2; pH = 13 → CM (KOH) = 0,1 M
→ có 0,04 mol KOH → ứng với 0,04 mol KCl. sau quá trình này, chỉ có H2O bị điện phân,
pH ổn đinh = 13 và không đổi (trừ khi nước bị điện phân nhiều và tính sự thay đổi của H2O).
Tóm lại, ứng tại thời điểm t, ∑nCl2 ra bên anot = 0,008 + 0,004 ÷ 2 + 0,04 ÷ 2 = 0,03 mol.
→ ne trao đổi = 0,06 mol → t = Ans × 96500 ÷ 1,93 = 3000 giây.
Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí H2. Sục khí CO2 dư vào Y, thu được 46,8 gam kết tủa. Cho Z tan hết vào dung dịch HNO3 , thu được dung dịch chứa 146,52 gam muối nitrat và 12,992 lít NO (là sản phẩm khử duy nhất của HNO3). Biết các phản ứng xảy ra hoàn toàn, các thể tích khí đo ở điều kiện tiêu chuẩn. Giá trị của m là
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2 => X chứa Al dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)
Hòa tan hết 17,92 gam hỗn hợp X gồm Fe3O4 , FeO, Fe, CuO, Cu , Al và Al2O3 ( trong đó oxi chiếm 25,446% về khối lượng ) vào dung dịch HNO3 loãng dư, kết thúc các phản ứng thu được dung dịch Y và 1,736 lít (đktc) hỗn hợp khí Z gồm N2 và N2O, tỉ khối Z so với H2 là 15,29. Cho dung dịch NaOH tới dư vào Y rồi đun nóng , không có khí thoát ra. Số mol HNO3 đã phản ứng có giá trị gần nhất với
Coi hỗn hợp X gồm Fe, Cu, Al và O. Gọi số mol của N2 và N2O lần lượt là x, y mol.
=> nO = 0,285
Ta có:
x+y=0,0775
28x+44y=15,29×2×0,0775
=>x=0,065 và y=0,0125
Khi cho NaOH tới dư không thấy có khí thoát ra → không hình thành NH4NO3
=>nHNO3=2nO+12nN2+10nN2O =1,475
Xà phòng hoá hoàn toàn m gam chất béo trung tính bằng dung dịch KOH dư thì thu được 18,77 gam xà phòng. Nếu thay dung dịch KOH bằng dung dịch NaOH dư thì chỉ thu được 17,81 gam xà phòng. Giá trị của m là
Ta có pư xà phòng hóa: (RCOO)3C3H5 + 3XOH → 3RCOOX + C3H5(OH)3.
Theo pt ta thấy:
Cứ 3 mol XOH pư thì khối lượng xà phòng tạo thành chênh lệch 3.(39 – 23) = 48 gam.
0,06 mol …………………………………………………(18,77 – 17,81) = 0,96 gam.
Vậy số mol glixerol tạo thành = 0,02
Theo bảo toàn khối lượng: mchất béo = 18,77 + 0,02 . 92 – 0,06 . 56 = 17,25 gam.
Đáp án B.
Đốt cháy hoàn toản 0,1 mol anđehit đơn chức X cần dùng vừa đủ 12,32 lít khí O2 (đktc), thu được 17,6 gam CO2, X là anđehit nào dưới đây?
\({{\text{n}}_{{{\text{O}}_{\text{2}}}}}= 0,55 mol; {{\text{n}}_{\text{C}{{\text{O}}_{\text{2}}}}}\)= 0,4 mol
Nhận xét: X là anđehit đơn chức → nO(X) = nX = 0,1 mol
Theo ĐLBT nguyên tố với O :
\({{\text{n}}_{{{\text{H}}_{\text{2}}}\text{O}}}= {{\text{n}}_{\text{O(}{{\text{H}}_{\text{2}}}\text{O)}}} = nX + 2{{\text{n}}_{{{\text{O}}_{\text{2}}}}}- 2{{\text{n}}_{\text{C}{{\text{O}}_{\text{2}}}}}\)= 0,1+2.0,55-2.0,4 = 0,4 mol
Nhận thấy: \(\left. \begin{align} & {{\text{n}}_{{{\text{H}}_{\text{2}}}\text{O}}}={{\text{n}}_{\text{C}{{\text{O}}_{\text{2}}}}}=\text{0,4mol} \\ & {{\text{n}}_{\text{C}{{\text{O}}_{\text{2}}}}}=\text{4}{{\text{n}}_{\text{X}}} \\ \end{align} \right\} \Rightarrow \)X là CH3 – CH2 – CH2 – CHO → Đáp án B
Hòa tan hoàn toàn 20g hỗn hợp A gồm Mg và Fe2O3 bằng dung dịch HNO3 đặc dư thu được dung dịch B và V lít khí NO2 (đktc) là sản phẩm khử duy nhất. Thêm NaOH dư vào dung dịch B. Kết thúc thí nghiệm, lọc lấy kết tủa đem nung trong không khí đến khối lượng không đổi thu được 28g chất rắn. Giá trị của V là:
Đáp án C
Ta có : \(\left\{ \begin{align} & {{m}_{Mg}}~+\text{ }{{m}_{Fe2O3}}~~=~20\left( gam \right) \\ & {{m}_{MgO}}+{{m}_{Fe2O3}}=28(gam) \\ \end{align} \right. \to {{n}_{Mg}}=\frac{28-20}{16}=0,5mol\)
Bảo toàn e → nNO2 = 2nMg = 1 mol→ V = 22,4 lít
Dung dịch X có chứa AgNO3 và Cu(NO3)2 có cùng nồng độ mol. Thêm 1 hỗn hợp gồm 0,03 mol Al và 0,05 mol Fe vào 100 ml dung dịch X cho tới khi phản ứng kết thúc thu được chất rắn Y gồm 3 kim loại. Cho m gam Y vào HCl dư giải phóng 0,07g khí. Nồng độ của 2 muối ban đầu là:
Đáp án B
Phân tích: Ta có thể tóm tắt toàn bộ quá trình phản ứng như sau
\(X\left\{ \begin{array}{l} AgN{O_3},{x^{mol}}\\ Cu\left( {N{O_3}} \right),{x^{mol}} \end{array} \right. + \left\{ \begin{array}{l} Al0,03mol\\ Fe0,05mol \end{array} \right.\) → Rắn Y (3 kim loại) H2 0,035 mol
Chất rắn Y gồm 3 kim loại nên Fe dư và Y gồm Fe dư, Ag, Cu.
Gọi số mol Fe phản ứng ở phản ứng đầu là ymol
Ta có: ne nhận = nAg+ + 2nCu2+ = 3x
ne nhường = 3nAl + 2nFe pư = 3.0,03 + 2y
Bảo toàn e, được : 3x=0,09+2y.
Lại có: nFe dư =nH2 =0,035 (chỉ có Fe phản ứng với HCl sinh ra H2 )
→ y=0,05−0,035=0,015→x=0,04mol
Vậy nồng độ của 2 muối ban đầu là 0,4M.
Rót từ từ dung dịch HCl 0,1M vào 200 ml dung dịch KAlO2 0,2M. Khối lượng kết tủa thu được phụ thuộc vào V (ml) dung dịch HCl như hình bên dưới. Giá trị của a và b lần lượt là:
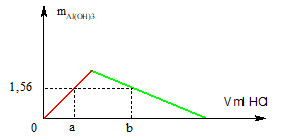
+ Ta có số mol Al(OH)3 trên đồ thị = 1,56 : 78 = 0,02 mol → a = nH+ = 0,02 mol (1)
+ Số mol KAlO2= 0,04 mol→ kết tủa cực đại = 0,04 mol.
+ Từ đồ thị → b = 4 x 0,04 – 3 x 0,02 = 0,1 mol (2)
+ Từ (1, 2) → a = 200 ml hoặc b = 1000 ml.
Đốt cháy hoàn toàn một lượng chất hữu cơ X thu được 3,36 lít khí CO2, 0,56 lít khí N2 (các khí đo ở đktc) và 3,15 gam H2O. Khi X tác dụng với dung dịch NaOH thu được sản phẩm có muối H2N – CH2 – COONa. Công thức cấu tạo thu gọn của X là
CT X : CxHyOzNt Lập tỉ lệ x :y :t = 0,15 : 0,35 :0,05 = 3 : 7 :1
C3H7OzN
Vì thu muối H2N-CH2-COONa, nên đáp án B
Hợp chất khí với hiđro của nguyên tố R có dạng RH4. Oxit cao nhất của R chứa 53,3% khối lượng oxi. Công thức oxit cao nhất là:
Vì RH4 →R nhóm IV trong BTH →CT với Oxi là RO2
dựa vào % ta có : \(53,3 = \frac{{32}}{{R + 32}}.100\) R=28 là Si
Hỗn hợp khí A gồm Cl2 và O2. Cho A phản ứng vừa hết với 1 hỗn hợp gồm 4,8 gam Mg và 8,1 gam Al thu được 37,05 gam hỗn hợp các muối clorua và các oxit của 2 kim loại. Thành phần % theo khối lượng của các khí trong A là?
BTKL : m(Cl2+ O2) = m(hỗn hợp muối, oxit) – (m Mg+mAl) =24,15g
Gọi x,y là số mol 2 khí Cl2+ O2
71x+ 32y = 24,15 ; Bte : 2x+4y= 0,2.2+0,3.3
→x=0,25 ; y= 0,2 →%khối lượng : % Cl2=73,5% và % O2=26,5%.
Hỗn hợp khí X gồm etilen và propin. Cho a mol X tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được 17,64 gam kết tủa. Mặt khác a mol X phản ứng tối đa với 0,34 mol H2. Giá trị của a là:
n↓=n propin =0,12
Khi phản ứng với H2: nH2 = 2n propin + n etilen → n etilen = 0,1
Vậy a=0,22
Cho 2,4 gam hỗn hợp C2H2, C3H8, C2H6, C4H6 và H2 đi qua bột Ni nung nóng, sau một thời gian thu được hỗn hợp khí X. Đốt cháy hoàn toàn X cần vừa đủ V lít khí O2 (đktc), thu được 3,36 lít CO2 (đktc). Gía trị của V là
- Bảo toàn khối lương: mhh = mH + mC
nco2 = 0,15 mol
BTKL mH = mhh- mc = 2.4 - 0,15.12 = 0,6 => n H20 = 0,6/2 = 0,3 mol
BTNT O => no2 = (nC02 + l/2nH20 ) = 0,15 + 1/2.0,3 = 0,15 mol
V oxi (dktc) = 6.72 (lít)
Hòa tan hết 3,24 gam bột Al trong dung dịch HNO3 dư, thu được 0,02 mol khí X duy nhất và dung dịch Y chứa 27,56 gam muối. Khí X là
→nAl(NO3)3=nAl=0,12mol⇒mNH4NO3=mY−mAl(NO3)3= 2g
→nNH4NO3=0,025mol
Goị a là số e nhận ápdụng BTe: →0,02a=3nAl−8nNH4NO3=0,16→a=8
Vậy X là N2O
Hỗn hợp X gồm một este, một axit cacboxylic và một ancol (đều no, đơn chức, mạch hở). Thủy phân hoàn toàn 6,18 gam X bằng lượng vừa đủ dung dịch chứa 0,1 mol NaOH thu được 3,2 gam một ancol. Cô cạn dung dịch sau thủy phân rồi đem lượng muối khan thu được đốt cháy hoàn toàn thu được 0,05 mol H2O. Phần trăm khối lượng của este có trong X là
Do các chất đều đơn chức ⇒ muối có dạng RCOONa với số mol là 0,1.
Bảo toàn nguyên tố hiđro ⇒ số H/muối = 0,05 × 2 ÷ 0,1 = 1 ⇒ R là H.
+ Bảo toàn khối lượng: mX + mNaOH = mmuối + mancol + mH2O ⇒ nH2O = 0,01 mol.
⇒ naxit = 0,01 mol ⇒ neste = 0,09 mol ⇒ nancol > neste = 0,09 mol.
⇒ Mancol < 3,2 ÷ 0,09 = 35,56 ⇒ ancol là CH3OH ⇒ este là HCOOCH3.
⇒ %meste = 0,09 × 60 ÷ 6,18 × 100% = 87,38% ⇒ chọn D.
Hỗn hợp X gồm glyxin, alanin, valin, metylamin và etylamin. Đốt cháy hoàn toàn 0,16 mol hỗn hợp X cần dùng vừa đủ 0,57 mol O2. Sản phẩm cháy gồm CO2, H2O và N2 (trong đó số mol CO2 là 0,37 mol). Cho lượng X trên vào dung dịch KOH dư thấy có a mol KOH tham gia phản ứng. Giá trị của a là
Nhận xét: glyxin= 1NH3+CH2+CO2
alanin=1NH3+2CH2+CO2
valin=1NH3+4CH2+CO2
metylamin= 1NH3+CH2
etyl amin= 1NH3+2CH2
quy đổi hỗn hợp X gồm NH3(0,16 mol); CH2 (x mol) CO2 (y mol)
nO2= 0,16.0,75+ 1,5.x = 0,57 →x = 0,3 mol
nCO2= x+y= 0,37 →y= 0,07
nKOH= nCOOH- = nCO2= 0,07
Hòa tan hoàn toàn 3,60 gam Mg trong 500 ml dung dịch HNO3 0,80M, phản ứng kết thúc thu được 448 ml một khí X (ở đktc) và dung dịch Y có khối lượng lớn hơn khối lượng dung dịch HNO3 ban đầu là 3,04 gam. Để phản ứng hết với các chất trong Y cần vừa đủ V ml dung dịch NaOH 2,00M. Giá trị của V là
Bảo toàn khối lượng: mdung dịch tăng = mMg – mX ⇒ mX = 3,6 – 3,04 = 0,56(g).
⇒ MX = 0,56 ÷ 0,02 = 28 (N2)
Bte: 2nMg= 10nN2+ 8n NH4NO3 →nNH4NO3=0,0125
Mg(NO3)2= 0,15; nNH4NO3=0,0125, nN2=0,02
BT nguyên tố N ta có: 0,4= 0,15.2+ 0,0125.2+ 0,02.2 +x(nHNO3 dư)→x= 0,035
→NaOH= 0,15.2+ 0.0125+ 0,035=0,3475→V=173.75 ml
Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí B ( gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ % của Fe(NO3)3 trong X là:
Fe(x) ;Cu(y), 16g rắn là Fe2O3 và CuO
→ 56x+ 64y = 11,6; 80x+ 80y = 16→ x=0,15, y=0,05
Giả sử Z chứa KOH dư(a), KNO3 (b) khi nhiệt phân thu 41,05 g rắn là KOH và KNO2
BT nguyên tố K: a+b= 0,5 = n KOH bđ ; 56a+ 85b+ 41,05
→ a= 0,05; b=0,45
Nếu trong X chỉ có muối Fe3+ thì nKOH pư (0,45)= 3nFe3+ + 2n Cu2+ =3.0,15+2.0,05= 0,5 (vô lý)
Vậy trong X chứa muối Fe2+, Fe3+ , Cu2+ → HNO3 hết
Khi đó: BT nguyên tố Fe: nFe3+ +nFe2+ =0,15 (1)
nKOH pư (0,45)= 3nFe3+ + nFe2+ + 2n Cu2+
0,45 =3nFe3+ + nFe2+ + 2.0,05 (2)
Từ (1)(2) nFe3+=0,05; nFe2+ = 0,1 →m Fe(NO3)3 = 242.0,05=12,1 g
Hỗn hợp khí là hỗn hợp oxit nito gồm N và O
BT nguyên tố N: nHNO3=nN/muối (=nKNO3)+ n N/khí
→ n N/khí= 0,7- 0,45= 0,25
BT e: 3.0,05+ 0,1.2+ 0,05.2+ 2nO=5nNn →nO=0,4
mdd X=11,6+87,5 – m hh khí
= 11,6+87,5 – (0,25.14+ 0,4.16)=89,2g
→ %Fe(NO3)3= 13,56%.
Hòa tan Fe trong dung dịch HNO3 dư thấy sinh ra hỗn hợp khí chứa 0,03 mol NO2 và 0,02mol NO duy nhất.Khối lượng Fe bị hòa tan là:
3*nFe = 3 nNO + 1nNO2
nFe = 0,03 → m Fe = 1,68 gam
Vậy các kim loại vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch AgNO3 là Mg, Zn, Al, Fe, Ni và Sn.
Khử hoàn toàn 32 gam CuO thành kim loại cần vừa đủ V lít khí CO (đktc). Giá trị của V là
Đáp án B
\(CuO\;\;\; + {\rm{ }}CO \to Cu{\rm{ }} + {\rm{ }}C{O_2} \Rightarrow {\rm{ }}{V_{CO}} = {\rm{ }}22,4 \times \frac{{32}}{{80}}{\rm{ }} = {\rm{ }}8,96{\rm{ }}li t\)
Xà phòng hóa hoàn toàn m gam tristearin bằng dung dịch KOH vừa đủ, thu được 115,92 gam muối. Giá trị của m là
C17H35COO)3C3H5 + 3KOH → 3C17H35COOK + C3H5(OH)3
0,12mol 0,36mol
m tristearin = 0,12*890 = 106,08 (gam)
Vận dụng Tính khối lượng các chất trong phản ứng xà phòng hoá, tìm CTCT
Chất nào sau đây thuộc loại chất điện li mạnh?
- CH3COOH, H2O là những chất điện li yếu.
- C2H5OH là chất không điện li.
- NaCl là chất điện li mạnh, phân li hoàn toàn thành ion
⇒ Chọn D.
Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào dung dịch chứa 0,15 mol NaOH và 0,1 mol Ba(OH)2, thu được m gam kết tủa. Giá trị của m là:
Lập tỷ lệ: \(\frac{{{n}_{O{{H}^{-}}}}}{{{n}_{C{{O}_{2}}}}} = \frac{0,35}{0,15} =2,33 \Rightarrow \) tạo muối trung hòa \({{n}_{C{{O}_{2}}}}= nCO_{3}^{2-}\) = 0,15 mol
Phương trình tạo kết tủa : Ba2+ + CO\(_{3}^{2-}\to \) BaCO3
0,1 0,15 0,1
m\(_{\downarrow }\) = 197.0,1 = 19,700 gam
Đun nóng 0,2 mol este đơn chức X với 135 ml dung dịch NaOH 2M. Sau phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được ancol etylic và 19,2 gam chất rắn khan. Công thức cấu tạo của X là?
Do este phản ứng tạo ancol etylic nên gọi CT este là RCOOC2H5.
meste +mNaOH =mrắn + mancol => meste =17.6gam
Meste=R+44+29=17,6/0.2 =>R=15g/mol
⇒ X là CH3COOC2H5
Có bao nhiêu chất chứa vòng benzen có cùng công thức phân tử C7H8O?
CH3-C6H4-OH (3 đồng phân: octho, meta và para)
C6H5CH2OH và C6H5-O-CH3
Cho 12,55 gam CH3CH(NH3Cl)COOH tác dụng với 150 ml dung dịch Ba(OH)21M. Cô cạn dung dịch sau phản ứng, thu được m gam chất rắn. Giá trị của m là
nCH3CH(NH3Cl)COOH =0.1mol, nBa(OH)2 =0.15mol
m + mBa(OH)2 = mrắn + mH2O => mrắn = 12,55+0.15*197-0.2*18=34,6gam
Dãy nào sau đây chỉ gồm các chất vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch AgNO3 ?
Đáp án A.
- Các kim loại đứng trước cặp H+/H2 có thể tác dụng được với HCl.
- Các kim loại đứng trước cặp Ag+/Ag có thể tác dụng được với AgNO3.
Cho 6,03 gam hỗn hợp saccarozơ và glucozơ tác dụng với lượng dư dung dịch AgNO3/NH3, sau khi phản ứng xảy ra hoàn toàn thu được 1,08 gam Ag. Số mol saccarozơ và glucozơ trong hỗn hợp lần lượt là
C6H12O6 ⇒ 2Ag =>nglucozo=0.0(5mol)
nsaccarozo= (6,03-0.05*180)/342 = 0.015mol
Đốt cháy hỗn hợp kim loại gồm 1,92 g Mg và 4,48 g Fe với hỗn hợp khí X gồm clo và oxi, sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua(không còn khí dư). Hoà tan Y bằng một lượng vừa đủ 120ml dung dịch HCl 2M thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z sau phản ứng hoàn toàn thu được 56,69 g kết tủa. Phần trăm theo thể tích khí clo trong hỗn hợp X:
nMg = 0,08 mol; nFe = 0,08 mol
Khi phản ứng với X thì có x mol Cl2 và y mol O2 phản ứng
Giả sử tạo a mol Fe2+ và (0,08 – a) mol Fe3+
Bảo toàn điện tích: 2.0,08 + 2a + 3(0,08 – a) = 2x + 4y
nO = ½ nHCl = 0,12 mol = 2y
⇒ 0,4 – a = 2x + 4.0,06(1)
Sau đó: phản ứng với AgNO3 tạo: (2x + 0,24) mol AgCl và a mol Ag
⇒ 56,69 = 143,5(2x + 0,24) + 108a (2)
Từ (1),(2) ⇒ x = 0,07; a = 0,02 mol
⇒%VCl2(X)=53,85 %
Hỗn hợp X gồm hai chất hữu cơ no, mạch hở (đều chứa C, H, O), trong phân tử mỗi chất có hai nhóm chức trong số các nhóm –OH, –CHO, –COOH. Cho m gam X phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 4,05 gam Ag và 1,86 gam muối amoni hữu cơ. Cho toàn bộ lượng muối amoni hữu cơ vào dung dịch NaOH (dư, đun nóng), thu được 0,02 mol NH3. Giá trị của m là
Có nAg = 0,0375 mol → nCHO = 0,01875 mol
Có nRCOONH4 = nNH3 = 0,02 mol → MRCOONH4 = 1,86 : 0,02 = 91 ⇒ MR = 31 ( HO-CH2)
Vì mỗi chất trong X đều chứa hai nhóm chức trong số các nhóm –OH, –CHO, –COOH
⇒ X gồm HO-CH2-CHO : 0,01875 mol và HO-CH2-COOH:
( 0,02 - 0,01875) = 1,25. 10-3 mol
⇒ m = 0,01875. 60 + 1,25. 10-3 . 76 = 1,22 gam.
Cho ba kim loại Al, Fe, Cu vào 2 lít dung dịch HNO3 phản ứng vừa đủ thu được 1,792 lít khí X ở(đktc) gồm N2 và NO2 có tỉ khối so với He bằng 9,25. Nồng độ mol HNO3 trong dung dịch đầu:
n N2=nNO2=0,04anHNO3=12nN2+2nNO2=0,56aCM= 0,28M
Hỗn hợp X gồm glyxin; axit glutamic và axit metacrylic. Hỗn hợp Y gồm etilen và đimetylamin. Đốt cháy a mol X và b mol Y thì tổng số mol khí oxi cần dùng vừa đủ là 2,625 mol, thu được H2O; 0,2 mol N2 và 2,05 mol CO2. Mặt khác, khi cho a mol X tác dụng với dung dịch NaOH dư thì lượng NaOH phản ứng là m gam. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là:
Quy đổi hỗn hợp X, Y thành: C2H2O2 (x mol); CH2 (y mol); NH3 (0,4 mol)
C2H2O2 + 3/2O2 → 2CO2 + H2O
CH2 + 3/2 O2 → CO2 + H2O
2NH3 + 3/2 O2 → 3 H2O + N2
0,4 0,3 0,2
Số mol O2 1,5x + 1,5y = 2,625 – 0,3 = 2,325
Số mol CO2 2x + y = 2,05 x = 0,5 và y = 1,05
mNaOH = 0,5.40 = 20

