Đề thi thử tốt nghiệp THPT QG môn Hóa năm 2020 - Trường THPT Nguyễn Huy Tự
Đề thi thử tốt nghiệp THPT QG môn Hóa năm 2020 - Trường THPT Nguyễn Huy Tự
-
Hocon247
-
40 câu hỏi
-
90 phút
-
29 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Kim loại Cu tác dụng được với dung dịch nào sau đây?
Kim loại Cu tác dụng được với dung dịch HNO3 loãng
Đáp án C
Đốt dây Fe trong bình đựng khí clo dư, thu được sản phẩm là
Đốt dây Fe trong bình đựng khí clo dư, thu được sản phẩm là FeCl3
Đáp án C
Dung dịch chất nào sau đây làm quỳ tím hoá đỏ?
HNO3 là axit nên làm quỳ tím hoá đỏ
Este nào sau đây là no, đơn chức, mạch hở?
Este no, đơn chức, mạch hở là CH3COOCH3
Đáp án B
Oxit kim loại nào sau đây tác dụng với nước tạo dung dịch có môi trường kiềm mạnh?
CaO tác dụng với nước tạo dung dịch có môi trường kiềm mạnh
2CaO + 2H2O → 2Ca(OH)2 + H2
Chất nào sau đây có tính lưỡng tính?
Chất lưỡng tính là Glyxin
Đáp án A
Nhóm những chất khí nào dưới đây đều gây hiệu ứng nhà kính khi nồng độ của chúng trong khí quyền vượt quá tiêu chuẩn cho phép?
Đáp án D
Hợp chất nào sau đây chứa crom ứng với số oxi hóa +3?
Cr2(SO4)3 chứa crom ứng với số oxi hóa +3?
Quặng nào sau đây có chứa oxit sắt?
Quặng hematit có chứa oxit sắt.
Ở nhiệt độ thường, nhỏ vài giọt dung dịch l2 vào hồ tinh bột thấy xuất hiện màu
Ở nhiệt độ thường, nhỏ vài giọt dung dịch l2 vào hồ tinh bột thấy xuất hiện màu xanh tím
Đáp án D
Chất nào dưới đây khi tham gia phản ứng trùng ngưng tạo thành tơ nilon–6?
H2N[CH2]6COOH tham gia phản ứng trùng ngưng tạo thành tơ nilon–6
Công thức hoá học của nhôm hiđroxit là
Công thức hoá học của nhôm hiđroxit là Al(OH)3
Tàu biển với lớp vỏ thép dễ bị ăn mòn bởi môi trường không khí và nước biển. Để bào vệ các tàu thép ngoài việc sơn bỏ vệ, người ta còn gắn vào vỏ tàu một số tấm kim loại. Tấm kim loại đó là
Tấm kim loại đó là kẽm
Đáp án D
Cho 8,96 gam Fe vào dung dịch H2SO4 đặc, nóng dư, sau khi kết thúc phản ứng thu được V lít khí SO2 (sản phẩm khử duy nhất của S+6 ở đktc). Giá trị của V là
nFe = 0,16 mol
Bảo toàn electron: 2nSO2 = 3nFe
→ nSO2 = 0,24
→ V = 5,376 lít
Lên men dung dịch chứa 360 gam glucozơ thu được 147,2 gam ancol etylic. Hiệu suất quá trình lên men tạo thành ancol etylic là
C6H12O6 → 2C2H5OH + 2CO2
180 2.46
m 147,2
→ mC6H12O6 phản ứng = 180.147,2/(2.46) = 288
→ H = 288/360 = 80%
Thủy phân hoàn toàn một lượng tristearin trong dung dịch NaOH (vừa đủ), thu được 1 mol glixerol và
Thủy phân hoàn toàn một lượng tristearin trong dung dịch NaOH (vừa đủ), thu được 1 mol glixerol và 3 mol natri stearat.
Đốt cháy hoàn toàn m gam một aminoaxit X mạch hở, thu được 3,36 lít khí N2 (đktc). Mặt khác, cho m gam X tác dụng vừa đủ với dung dịch chứa a mol HCl. Giá trị của a là
nHCl = nN = 2nN2 = 0,3 mol
Để chứng tỏ nhóm -OH đã ảnh hưởng đến vòng benzen trong phenol (C6H5OH) có thể sử dụng phản ứng của phenol với
Để chứng tỏ nhóm -OH đã ảnh hưởng đến vòng benzen trong phenol (C6H5OH) có thể sử dụng phản ứng của phenol với nước brom
Cho hình vẽ mô tả thí nghiệm điều chế kim loại bằng cách dùng khí H2 để khử oxit kim loại:
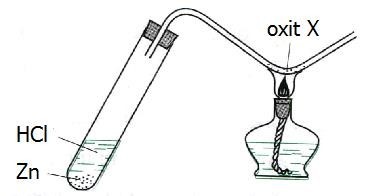
Oxit X là
Đáp án B
Phát biểu nào sau đây là đúng?
Protein là một loại polime thiên nhiên.
X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y lần lượt là (biết thứ tự trong dãy thế diện hóa: Fe3+/Fe2+ đứng trước Ag+/Ag)
Đáp án A
Chất X trong công nghiệp thực phẩm là nguyên liệu để làm bánh kẹo, nước giải khát và pha chế thuốc. Dung dịch chất Y làm đổi màu quỳ tím, trong đời sống muối mononatri của Y được dùng làm gia vị thức ăn (gọi là mì chính hay bột ngọt). Tên của X và Y theo thứ tự là
X và Y lần lượt là Saccarozơ và axit glutamic.
Cho m gam Al vào dung dịch HCl dư đến khi khí ngừng thoát ra thấy khối lượng phần dung dịch tăng 14,4 gam so với dung dịch HCl ban đầu. Khối lượng muối tạo thành trong dung dịch là
Chọn B.
2Al + 6HCl → 2AlCl3 + 3H2
Khối lượng dung dịch giảm = mAl – mkhí = 14,4 → 27x – 1,5x.2 = 14,4 → x = 0,6
Muối thu được là AlCl3 có m = 80,1 (g)
Hấp thụ hoàn toàn 7,84 lít (đktc) CO2 vào 200ml dung dịch hỗn hợp NaOH 1M và KOH xM. Sau khi phản ứng kết thúc, làm bay hơi dung dịch được 33,7 gam chất rắn. Cho rằng quá trình làm bay hơi dung dịch, các chất không có sự biến đổi về mặt hóa học. Giá trị của x là
Chọn B.
Giả sử trong dung dịch thu được có Na+ (0,2 mol), K+ (0,2x mol), CO32- (a mol) và HCO3- (b mol)
Ta có:
\(\left\{ \begin{array}{l}
0,2 + 0,2x = 2a + b\\
a + b = 0,35\\
0,2.23 + 0,2x.39 + 60a + 61b = 33,7
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
a = 0,05\\
b = 0,3\\
x = 1
\end{array} \right.\)
Cho 16,32 gam hỗn hợp gồm BaO và Al2O3 vào lượng nước dư, thu được dung dịch X. Cho từ từ dung dịch HCl 1M vào X đến khi bắt đầu xuất hiện kết tủa thì đã dùng 80 ml. Nếu cho 200 ml dung dịch chứa HCl 0,5M và H2SO4 0,3M vào dung dịch X, thu được a gam kết tủa. Giá trị của a là
Chọn C.
Dung dịch X chứa Ba2+ (x mol), AlO2- (y mol) và OH- (2x – y mol) (tính từ BTĐT)
Theo đề ta có: 153x + 0,5y.102 = 16,32 (1)
Đến khi bắt đầu kết tủa (tức là chưa có kết tủa xuất hiện) thì: 2x – y = 0,08 (2)
Từ (1), (2) suy ra: x = y = 0,08.
Cho dung dịch chứa H+ (0,22 mol); SO42- (0,06 mol) vào X thì thu được:
\(\left\{ \begin{array}{l}
{n_{BaS{O_4}}} = {n_{S{O_4}^{2 - }}} = 0,06\;mol\\
{n_{Al{{(OH)}_3}}} = \frac{{4{n_{Al{O_2}^ - }} + {n_{O{H^ - }}} - {n_{{H^ + }}}}}{3} = 0,06\;mol
\end{array} \right. \Rightarrow {m_ \downarrow } = 18,66\;(g)\)
Cho các phát biểu sau:
(a) Cho dung dịch AgNO3 dư vào dung dịch FeCl2 sau phản ứng thu được hai chất kết tủa.
(b) Cho Cu tác dụng với dung dịch hỗn hợp NaHSO4 và KNO3 thấy có khí thoát ra.
(c) Hỗn hợp Cu và Fe3O4 có số mol bằng nhau có thể tan hết trong dung dịch HCl dư.
(d) Hỗn hợp Al và Na2O (tỉ lệ mol tương ứng là 2 : 1) tan hoàn toàn trong nước dư.
(e) Cho Ba dư vào dung dịch Al2(SO4)3 sau phản ứng thu được hai chất kết tủa.
Số phát biểu đúng là
Chọn A.
(a) 3AgNO3 dư + FeCl2 → Fe(NO3)3 + 2AgCl + Ag
(b) 3Cu + 8H+ + NO3- → 3Cu2+ + 2NO + 4H2O
(c) Fe3O4 + 8HCl dư → FeCl2 + 2FeCl3 + 4H2O ; Cu + 2FeCl3 ® CuCl2 + 2FeCl2.
(d) 2Al + Na2O + 3H2O → 2NaAlO2 + 3H2
(e) 4Ba dư + Al2(SO4)3 + 4H2O → 3BaSO4 + Ba(AlO2)2 + 4H2
Thực hiện các phản ứng sau:
(1) X + Y → Z + H2O
(2) Y → Z + H2O + E
(3) E + X → Y
(4) E + X → Z + H2O
Biết X, Y, Z là các hợp chất vô cơ của một kim loại, khi đốt nóng ở nhiệt độ cao cho ngọn lửa màu vàng.
Các chất X, Y, Z, E lần lượt là
Chọn C.
(1) NaOH (X) + NaHCO3 (Y) → Na2CO3 (Z) + H2O
(2) NaHCO3 (Y) → Na2CO3 (Z) + H2O + CO2 (E)
(3) CO2 (E) + NaOH (X) → NaHCO3 (Y)
(4) CO2 (E) + NaOH (X) → Na2CO3 (Z) + H2O
Đốt cháy hoàn toàn m gam hỗn hợp X gồm axit béo Y và triglixerit Z, thu được lượng CO2 và H2O hơn kém nhau 0,84 mol. Mặt khác, đun nóng 17,376 gam X với dung dịch NaOH (vừa đủ), thu được natri oleat và x gam glixerol. Biết m gam X phản ứng tối đa với 0,6 mol Br2. Giá trị của x là
Chọn C.
Vì muối thu được là natri oleat (C17H33COONa) nên Y, Z lần lượt là axit oleic và triolein.
\(X\left\{ \begin{array}{l}
axit{\rm{ }}oleic:a\;mol\\
triolein:b\;mol
\end{array} \right. \to \left\{ \begin{array}{l}
a + 5b = 0,84\\
a + 3b = 0,6
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
a = 0,24\\
b = 0,12
\end{array} \right. \Rightarrow {m_X} = 173,76\;(g)\)
Vậy trong 17,376 gam X có \({m_{{C_3}{H_5}{{(OH)}_3}}} = 0,012.92 = 1,104\;(g)\)
Cho các sơ đồ phản ứng theo đúng tỉ lệ mol:
(1) X + 2NaOH →
(2) X2 + NaOH → X3 + H2O.
(3) X3 + NaOH
(4) X1 + X2 → X4.
Biết X là muối có công thức phân tử là C3H12O3N2; X1, X2, X3, X4 là những hợp chất hữu cơ khác nhau. X1, Y1 đều làm quì tím ẩm hóa xanh. Phân tử khối của X4 là
Chọn D.
(1) NH4-CO3-NH3C2H5 + 2NaOH → C2H5NH2 (X1) + NH3 (Y1) + Na2CO3 (Y2) + 2H2O.
(2) CH3COOH (X2) + NaOH → CH3COONa (X3) + H2O.
(3) CH3COONa (X3) + NaOH → CH4 + Na2CO3 (Y2).
(4) C2H5NH2 (X1) + CH3COOH (X2) → CH3COONH3C2H5 (X4).
Cho các phát biểu sau:
(a) Tinh bột khi thủy phân hoàn toàn trong môi trường kiềm thu được glucozơ.
(b) Phenol dùng để sản xuất thuốc nổ (2,4,6-trinitro phenol).
(c) Vinyl axetat có khả năng làm mất màu nước brom.
(d) “Đường mía” là thương phẩm có chứa thành phần hoá học là saccarozơ.
(e) Hợp chất H2N–CH(CH3)–COOH3N–CH3 là este của alanin.
Số phát biểu đúng là
Chọn A.
(a) Sai, Tinh bột khi thủy phân hoàn toàn trong môi trường axit thu được glucozơ.
(e) Sai, Hợp chất H2N-CH(CH3)-COO-H3N-CH3 là muối amoni hữu cơ còn este của lanin có dạng H2N-CH(CH3)-COO-CH2-R (với R là gốc hiđrocacbon).
Hỗn hợp X gồm C2H2 và H2 lấy cùng số mol. Lấy một lượng hỗn hợp X cho đi qua chất xúc tác thích hợp, đun nóng được hỗn hợp Y gồm 4 chất. Dẫn Y qua bình đựng nước brom thấy khối luợng bình tăng 10,8 gam và thoát ra 4,48 lít khí Z (đktc) có tỉ khối so với H2 là 8. Thể tích O2 (đktc) cần để đốt cháy hoàn toàn hỗn hợp Y là
Chọn A.
Theo BTKL: \({m_{{C_2}{H_2}}} + {m_{{H_2}}} = 10,8 + 0,2.8.2 = 14\;(g) \Rightarrow {n_{{C_2}{H_2}}} = {n_{{H_2}}} = 0,5\;mol\)
Đốt cháy Y cũng chính là đốt cháy X:
\(\left\{ \begin{array}{l}
{C_2}{H_2} + 5/2{O_2} \to 2C{O_2} + {H_2}O\\
{H_2} + 1/2{O_2} \to {H_2}O
\end{array} \right.\)
\({n_{{O_2}}} = \frac{5}{2}{n_{{C_2}{H_2}}} + \frac{1}{2}{n_{{H_2}}} = 1,5\;mol \Rightarrow {V_{{O_2}}} = 33,6\;(l)\)
Điện phân dung dịch hỗn hợp CuSO4 và KCl bằng dòng điện một chiều có cường độ 5A (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch). Toàn bộ khí sinh ra trong quá trình điện phân (ở cả hai điện cực) theo thời gian được biểu diễn bằng đồ thị sau:
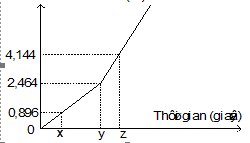
Giá trị của z là
Chọn B.
Dựa vào đồ thị ta thấy có 2 đoạn thẳng. Đoạn thẳng thứ nhất: Cu2+ và Cl- đều điện phân hết; đoạn thẳng thứ hai: chỉ có H2O điện phân ở cả hai điện cực.
+ Tại thời điểm t = y (s) chỉ có khí Cl2 thoát ra ở anot với . Lúc này ở bên catot Cu bị điện phân hết Þ
+ Tại thời điểm t = z (s) có khí Cl2 (0,11 mol); O2 (x mol) thoát ra ở anot và H2 (y mol) ở catot
Ta có: x + y = 0,185 – 0,11 (1) và 4x = 2y (2)
Từ (1), (2) ta tính được: y = 0,05. Vậy z = 6176 (s).
Hỗn hợp E gồm amino axit X, đipeptit Y (C4H8O3N2) và muối của axit vô cơ Z (C2H8O3N2). Cho E tác dụng với 200 ml dung dịch NaOH 1,5M và KOH 1M đun nóng (phản ứng vừa đủ), thu được 4,48 lít khí T (đo ở đktc, phân tử T có chứa một nguyên tử nitơ và làm xanh quỳ tím ẩm). Cô cạn dung dịch sau phản ứng, thu được m gam chất rắn khan gồm bốn muối. Giá trị của m là
Chọn B.
\(\left\{ \begin{array}{l}
Gly:x\\
{(Gly)_2}:y\\
{C_2}{H_5}N{H_3}N{O_3}:0,2
\end{array} \right. + \left\{ \begin{array}{l}
NaOH:0,3\\
KOH:0,2
\end{array} \right. \to \left\langle \begin{array}{l}
{C_2}{H_5}N{H_2}:0,2\\
\left\{ \begin{array}{l}
N{a^ + }:0,3\\
{K^ + }:0,2\\
N{O_3}^ -
\end{array} \right. \to {H_2}NC{H_2}{\rm{CO}}{{\rm{O}}^ - }:0,3 \Rightarrow m = 49,3\;(g)
\end{array} \right.\)
Hỗn hợp E gồm X, Y, Z, T, P, Q đều có cùng số mol (MX < MY = MZ < MT = MP < MQ). Đun nóng E với dung dịch NaOH vừa đủ, thu được một ancol mạch hở F và 29,52 gam hỗn hợp G gồm hai muối của hai axit cacboxylic no, đơn chức, mạch hở. Cho F vào bình đựng Na dư, thấy khối lượng bình tăng thêm 10,68 gam và 4,032 lít khí H2 (đktc) thoát ra. Số nguyên tử C có trong Q là
Chọn A.
Ta có:
\(\left\{ \begin{array}{l}
{n_{OH}} = 2{n_{{H_2}}} = 0,36\;mol\\
{m_{ancol}} = 10,68 + {m_{{H_2}}} = 11,04\;(g)
\end{array} \right. \Rightarrow {M_F} = \frac{{92}}{3}.t \to 92:{C_3}{H_5}{(OH)_3}\)
và \({n_{OH}} = {n_{RCOONa}} = 0,36\; \Rightarrow {M_G} = 82 = \frac{{68 + 96}}{2} \Rightarrow \) 2 muối trong G là HCOONa và C2H5COONa.
Vì các chất trong E có số mol bằng nhau → X là (HCOO)3C3H5, Y là (HCOO)2(C2H5COO)C3H5, T là (HCOO)(C2H5COO)2C3H5 và Q là (C2H5COO)3C3H5. Vây Q có 12 nguyên tử C.
Cho m gam hỗn hợp X gồm Mg và Fe (tỉ lệ mol tương ứng 4 : 3) tác dụng với dung dịch chứa FeCl3 0,6M và CuCl2 0,1M, kết thúc phản ứng thu được dung dịch Y chứa hai muối và m gam rắn Z. Cho lượng dư dung dịch AgNO3 vào Y, thu được 136,4 gam kết tủa. Cho m gam rắn Z vào dung dịch HCl dư, kết thúc phản ứng thu được V lít khí (đktc). Giá trị của V là
Chọn A.
Hỗn hợp X gồm Mg (4x mol) và Fe (3x mol) và dung dịch chứa FeCl3 (6y mol) và CuCl2 (y mol).
Dung dịch Y chứa Fe2+, Mg2+ (4x mol) và Cl- (20y mol) \( \to {n_{F{e^{2 + }}}} = 10y - 4x\;mol\)
Vi mX = mZ ⇒ 56.(10y - 4x) + 24.4x = 6y.56 + 64y (1)
Kết tủa thu được gồm \(\left\{ \begin{array}{l}
AgCl:20y\\
Ag:10y - 4x
\end{array} \right. \to 143,5.20y + 108.(10y - 4x) = 136,4\) (2)
Từ (1), (2) suy ra: x = 0,05 và y = 0,04
Rắn Z có chứa Fe với \( \to {n_{Fe}} = {n_{{H_2}}} = 0,19\;mol \Rightarrow {V_{{H_2}}} = 4,256\;(l)\)
Cho 12,48 gam X gồm Cu và Fe tác dụng hết với 0,15 mol hỗn hợp khí gồm Cl2 và O2, thu được chất rắn Y gồm các muối và oxit. Hòa tan vừa hết Y cần dùng 360 ml dung dịch HCl 1M, thu được dung dịch Z. Cho dung dịch AgNO3 dư vào Z, thu được 75,36 gam chất rắn. Mặt khác, hòa tan hết 12,48 gam X trong dung dịch HNO3 nồng độ 31,5%, thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất, ở đktc). Nồng độ % của Fe(NO3)3 trong T gần nhất với giá trị nào sau đây?
Chọn B.
Khi cho Y tác dụng với HCl thì: \({n_{{O_2}}} = \frac{{{n_{{H^ + }}}}}{4} = 0,09\;mol \Rightarrow {n_{C{l_2}}} = 0,06\;mol\)
Trong 75,36 (g) chất rắn gồm \( \to AgCl:0,48\;mol|) và Ag (0,06 mol) \(\Rightarrow {n_{F{e^{2 + }}}} = 0,06\;mol\)
Xét
\(X\left\{ \begin{array}{l}
Cu:a\;mol\\
Fe:b\;mol
\end{array} \right. \to \left\{ \begin{array}{l}
64a + 56b = 12,48\\
2a + 2.0,06 + 3(b - 0,06) = 2.0,06 + 4.0,09
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
a = 0,09\\
b = 0,12
\end{array} \right.\)
Khi cho X tác dụng với HNO3 thu được dung dịch T gồm Fe(NO3)2 (x); Fe(NO3)3 (y); Cu(NO3)2 (0,09).
Ta có: \(\left\{ \begin{array}{l}
x + y = 0,12\\
2x + 3y + 0,09.2 = 0,15.3
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
x = 0,09\\
y = 0,03
\end{array} \right.\) và \({m_{dd\;T}} = {m_X} + {m_{dd\;HN{O_3}}} - {m_{NO}} = 127,98\;(g)\)
Vậy C% Fe(NO3)3 = 5,67%
X, Y là 2 axit cacboxylic đều mạch hở, đơn chức, hơn kém nhau một nguyên tử C trong phân tử; Z là ancol no, 2 chức, mạch hở; T là este mạch hở tạo bởi X, Y, Z. Đốt cháy hoàn toàn 45,72 gam hỗn hợp E chứa X, Y, Z, T cần dùng vừa đủ 2,41 mol O2 thu được 27,36 gam H2O. Hiđro hóa hoàn toàn 45,72 gam E cần dùng 0,65 mol H2 (xt Ni, to) thu được hỗn hợp F. Đun nóng F với 400 ml dung dịch NaOH 1M (vừa đủ); cô cạn dung dịch sau phản ứng thu được 41,90 gam muối khan. Các phản ứng xảy ra hoàn toàn, phần trăm khối lượng của T trong E có giá trị gần nhất với giá trị nào sau đây?
Chọn A.
Khi đốt cháy E ta tính được CO2: 2,17 mol; H2O: 1,52 mol → nO (E) = 1,04 mol
Đặt số mol của (X, Y), Z, T lần lượt là a, b, c mol → 2a + 2b + 4c = 1,04 (1)
và (k + 1 – 1).a – b + (2k + 2 – 1).c = 2,17 – 1,52 → (ka + 2kc) – b + c = 0,65 (2) với ka + 2kc = nH2
Khi cho F tác dụng với NaOH thì: a + 2c = 0,4 (3) và Mmuối = 104,75
→ 2 muối đó là C2H5COONa (0,15 mol) và C3H7COONa (0,25 mol)
Từ (1), (2), (3) suy ra: a = 0,16; b = 0,12; c = 0,12
Theo BTKL: 47,02 + 0,4.40 = 41,9 + 0,16.18 + 0,24.MT → MT = 76: C3H6(OH)2
Theo các dữ kiện tính được suy ra: X là C3HxO2 (0,03 mol) và Y là C4HyO2 (0,13 mol)
Theo BTNT H: 0,03x + 0,13y + 0,12.8 + 0,12.(x + y – 2 + 6) = 1,52.2 → x = y = 4
Vậy T là C2H3-COO-C3H6-OOC-C3H3 (0,12 mol) → %mT = 51,44%.
Tiến hành 2 thí nghiệm sau:
Chọn A.
Khi đun nóng thì protein bị đông tụ nên không thử được phản ứng màu biure.
Cho 30 gam hỗn hợp E gồm Mg, FeCO3, Fe và Fe(NO3)2 tác dụng vừa đủ với dung dịch HCl, kết thúc phản ứng thu được dung dịch X chứa 54,33 gam muối và 6,78 gam hỗn hợp khí Y gồm NO, H2 và 0,08 mol CO2. Cho dung dịch X tác dụng tối đa với 510 ml dung dịch NaOH 2M, thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi thu được 26,4 gam rắn. Phần trăm khối lượng của đơn chất Fe trong E có giá trị gần nhất với giá trị nào sau đây?
Chọn C.
Dung dịch X gồm Fen+, Mg2+, NH4+, Cl-
\( \to {n_{C{l^ - }}} = {n_{O{H^ - }}} = 1,02\;mol\)
\( \to {n_{{H_2}O}} = 0,34\;mol \to {n_{{H_2}}} = \frac{{{n_{HCl}} - 2{n_{{H_2}O}}}}{2} = 0,17 - 2{n_{N{H_4}^ + }}\)
Đặt
\(\left\{ \begin{array}{l}
Mg:x\;mol\\
FeC{O_3}:0,08\;mol\\
Fe:y\;mol\\
Fe{(N{O_3})_2}:z\;mol
\end{array} \right. \to \left\{ \begin{array}{l}
24x + 56y + 180z = 20,72\\
40x + 160.(0,04 + 0,5y + 0,5z) = 26,4\\
24x + 56.(0,08 + y + z) + 18{n_{N{H_4}^ + }} = 18,12\\
{n_{NO}} = 2z - {n_{N{H_4}^ + }} \Rightarrow 30(2z - {n_{N{H_4}^ + }}) + 2(0,17 - 2{n_{N{H_4}^ + }}) = 3,26
\end{array} \right.\)
Giải hệ ta được x = 0,18; y = 0,1; z = 0,06 → %mFe = 18,67%

