Chuẩn độ
I. Chuẩn độ acid - base (chuẩn độ trung hòa)
1. Nguyên tắc chung
- Dùng dung dịch kiềm (NaOH hoặc KOH) đã biết chính xác nồng độ làm dung dịch chuẩn để chuẩn độ dung dịch acid hoặc dùng dung dịch acid mạnh (HCl, H2SO4, HNO3) đã biết chính xác nồng độ để chuẩn độ dung dịch base.
Ví dụ:
(1) Chuẩn độ dung dịch HCl chưa biết nồng độ bằng dung dịch chuẩn NaOH:
HCl + NaOH → NaCl + H2O
(2) Chuẩn độ dung dịch CH3COOH bằng dung dịch chuẩn NaOH:
CH3COOH + NaOH → CH3COONa + H2O
- Để nhận ra điểm tương đương (thời điểm dung dịch chuẩn vừa phản ứng hết với dung dịch cần xác định) của phản ứng chuẩn độ trung hòa, người ta dùng chất chỉ thị acid – base (hay chỉ thị pH, là những acid yếu có màu sắc thay đổi theo pH).
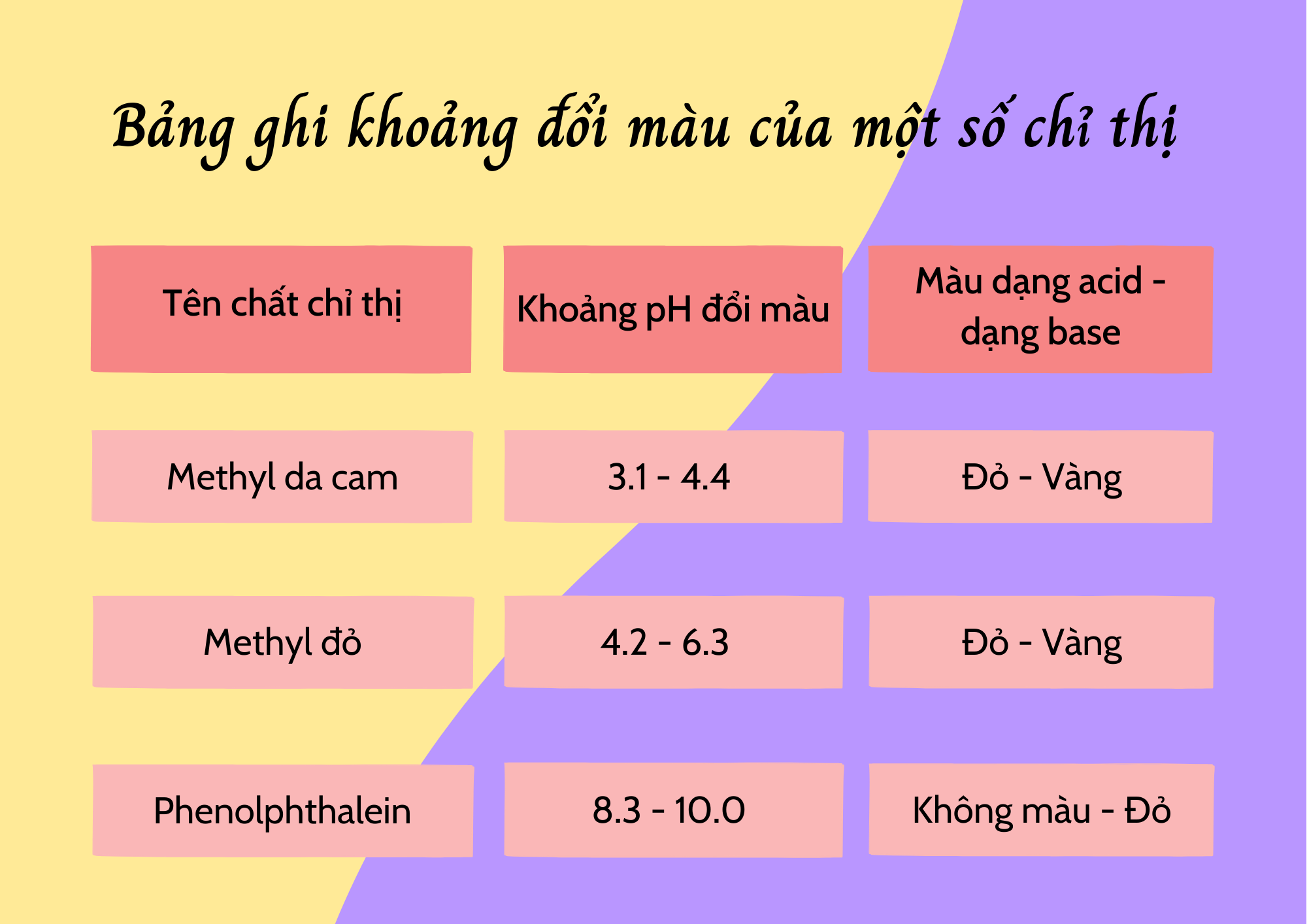
- Với mỗi phản ứng chuẩn độ acid – base, người ta chọn chất chỉ thị nào có khoảng pH đổi màu trùng hoặc rất sát với pH của điểm tương đương.
2. Bài tập áp dụng
Cần thêm vào bao nhiêu ml dung dịch NaOH 0,25M vào 50 ml dung dịch hỗn hợp HCl 0,1M và H2SO4 0,05M để thu được dung dịch có pH = 2?
A. 0,0365 lit B. 0,073 lit
C. 0,0024 lit D. 0,3 lit
Hướng dẫn giải:
Bước 1: Tính nồng độ mol H+
- nH+ = nHCl + 2nH2SO4 = 0,05.0,1 + 0,05.2.0,05 mol
- pH = 2 ⇒ [H+] = 10 - 2 M = 0,01 mol
Bước 2: Tính thể tích dd NaOH 0,025M
- \({n_{NaOH}}\, = \,{n_{O{H^ - }}}\, = \,0,25.V\,(mol)\)
- Ta có: \(\frac{{0,01\, - \,0,025V}}{{0,05\, + \,V}}\, = \,{10^{ - 2}}\)
⇒ 0,01 - 0,25.V = 0,01.0,05 + 0,01.V ⇒ 0,26.V = 0,01 - 0,01.0,05
-Vậy V = 0,0365 lit
Đáp án: A
II. Chuẩn độ oxi hóa khử bằng phương pháp pemanganat
1. Nguyên tắc chung
- Chuẩn độ oxi hóa - khử (phương pháp pemangant): được dùng để chuẩn độ dung dịch của các chất khử (Ví dụ: Fe2+, H2O2, H2C2O4, .. ) trong môi trường acid mạnh (thường dùng dung dịch H2SO4 loãng), khi đó MnO4- bị khử về Mn2+ không màu:
MnO4- + 8H+ + 5e → Mn2+ + 4H2O
- Trong phương pháp này chất chỉ thị chính là KMnO4 vì ion Mn2+ không màu do đó khi dư một giọt KMnO4 dung dịch từ không màu chuyển sang màu hồng rất rõ giúp ta kết thúc chuẩn độ.
Ví dụ:
MnO4- + 5Fe2+ + 8H+ → Mn2+ + 5Fe3+ + 4H2O
2MnO4- + 5H2O2 + 6H+ → 2Mn2+ + 5O2 + 8H2O
5H2C2O4 + 2MnO4- + 16H+ → 10CO2 + 2Mn2+ + 8H2O

2. Bài tập áp dụng
Để xác định nồng độ dung dịch H2O2, người ta hòa tan 0,5 gam nước oxi già vào nước, thêm H2SO4 tạo môi trường axit. Chuẩn độ dung dịch thu được cần vừa đủ 10 ml dung dịch KMnO4 0,1M. Xác định hàm lượng H2O2 trong nước oxi già.
A. 9% B. 17%
C. 12% D. 21%
Hướng dẫn giải:
Bước 1: Tính số mol của H2O2
\({n_{KMn{O_4}}} = 0,01.0,1 = 0,001\left( {mol} \right)\)
Bước 2: Xác định hàm lượng H2O2
\({m_{{H_2}{O_2}}} = 0,0025.34 = 0,085\left( g \right)\)
⟹ Hàm lượng H2O2 trong nước oxi già là:
\(\frac{{0,085}}{{0,5}}.100\% = 17\% {\text{ }}\)
Đáp án: B
