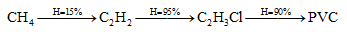Đề thi thử THPT QG môn Hóa học năm 2018 - Trường THPT Nguyễn Trung Trực
Đề thi thử THPT QG môn Hóa học năm 2018 - Trường THPT Nguyễn Trung Trực
-
Hocon247
-
40 câu hỏi
-
90 phút
-
47 lượt thi
-
Trung bình
Tham gia [ Hs Hocon247.com ] - Cộng Đồng Luyện Thi Trực Tuyến để được học tập những kiến thức bổ ích từ HocOn247.com
Cho các kim loại: Na, Mg, Fe, Al; kim loại có tính khử mạnh nhất là
Thứ tự giảm dần tính khử của các kim loại: Na, Mg, Al, Fe.
Cho 5,5 gam hỗn hợp gồm hai kim loại Al và Fe vào đung dịch HCl (dư), thu được 4,48 lít khí H2 (đktc). Khối lượng của Al và Fe trong hỗn hợp lần lượt là
\(\left\{ \begin{array}{l}
27{n_{Al}} + 57{n_{Fe}} = 5,5g\\
3{n_{Al}} + 2{n_{Fe}} = 2{n_{{H_2}}} = 2.\frac{{4,48}}{{22,4}} = 0,4{\rm{ mol}}
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
{n_{Al}} = 0,1{\rm{ mol}}\\
{{\rm{n}}_{Fe}} = 0,05{\rm{ mol}}
\end{array} \right.\)
\( \Rightarrow \left\{ \begin{array}{l}
{m_{Al}} = 2,7g\\
{m_{Fe}} = 2,8g
\end{array} \right.\)
Nhôm oxit không phản ứng được với dung dịch
Nhôm oxit không phản ứng được với dung địch NaCl.
Các dung dịch còn lại đều có phản ứng:
\(\begin{array}{l}
A{l_2}{O_3} + 2NaOH \to 2NaAl{O_2} + {H_2}O\\
A{l_2}{O_3} + 6HN{O_3} \to 2Al{(N{O_3})_3} + 3{H_2}O
\end{array}\)
\(A{l_2}{O_3} + 3{H_2}S{O_4} \to A{l_2}{(S{O_4})_3} + 3{H_2}O\)
Hỗn hợp X gồm Al, Fe2O3, Cu có số mol bằng nhau. Hỗn hợp X có thể tan hoàn toàn trong dung dịch
Hỗn hợp X tan hoàn toàn trong dung dịch HCl dư.
\(2Al + 6HCl \to 2AlC{l_3} + 3{H_2}\)
\(\begin{array}{l}
F{e_2}{O_3} + 6HCl \to 2FeC{l_3} + 3{H_2}O\\
{\rm{ x 2x mol}}
\end{array}\)
\(\begin{array}{l}
Cu + 2FeC{l_3} \to CuC{l_2} + 2FeC{l_2}\\
{\rm{ x 2x mol}}
\end{array}\)
Kim loại Cu phản ứng được với dung dịch
Kim loại Cu chỉ phản ứng với dung dịch AgNO3.
\(Cu + 2AgN{O_3} \to Cu{(N{O_3})_2} + 2Ag\)
Hoà tan hoàn toàn 3 kim loại Zn, Fe, Cu bằng dung dịch HNO3 loãng. Sau khi phản ứng xảy ra hoàn toàn, thu được chất rắn không tan là Cu. Dung dịch sau phản ứng chứa
Sau phản ứng còn Cu dư, chứng tỏ HNO3 phản ứng hết.
\(3Zn + 8HN{O_3} \to 3Zn{(N{O_3})_2} + 2NO + 4{H_2}O\)
\(Fe + 4HN{O_3} \to Fe{(N{O_3})_3} + NO + 2{H_2}O\)
\(3Cu + 8HN{O_3} \to 3Cu{(N{O_3})_2} + 2NO + 4{H_2}O\)
\(Cu + 2Fe{(N{O_3})_3} \to Cu{(N{O_3})_2} + 2Fe{(N{O_3})_2}$\)
=> Dung dịch sau phản ứng chứa: Zn(NO3)2; Fe(NO3)2; Cu(NO3)2.
Phát biểu nào sau đây là đúng?
A sai. Trong nhóm kim loại kiềm thổ chỉ có Ca, Ba tác dụng với nước ở nhiệt độ thường.
B sai. Thạch cao nung có công thức là CaSO4.H2O hoặc CaSO4.0,5H2O.
C sai. Các oxit của kim loại kiềm không bị khử bởi CO ở nhiệt độ cao.
D đúng. Kim loại kiềm không phản ứng với dầu hỏa, đồng thời bảo quản trong dầu hỏa còn tránh được tác động của hơi ẩm trong không khí.
Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc, nóng. Số trường hợp xảy ra phản ứng thuộc loại phản ứng oxi hóa - khử là
Các trường hợp xảy ra phản ứng thuộc loại phản ứng oxi - hóa khử: HNO3 đặc, nóng phản ứng với Fe, FeO, Fe(OH)2, Fe3O4, Fe(NO3)2, FeSO4, FeCO3.
Este no, đơn chức, mạch hở có công thức tổng quát là:
Este no, đơn chức, mạch hở có CTTQ là CnH2nO2.
Amin CH3-CH2-CH(NH2)-CH3 có tên là:
Amin CH3-CH2-CH(NH2)-CH3 có tên là 2-amino butan.
Cacbohiđrat X không tham gia phản ứng thủy phân trong môi trường axit và X làm mất màu dung dịch brom. Vậy X là
Cacbohiđrat X không tham gia phản ứng thủy phân trong môi trường axit nên X là đường đơn.
X làm mất màu dung dịch brom => X có chức -CHO.
=> X là glucozơ.
Polime thiên nhiên X được sinh ra trong quá trình quang hợp của cây xanh. Tiến hành thí nghiệm: Nhỏ vài giọt nước clo vào dung dịch chứa Natri iotua, sau đó cho polime X tác dụng với dung dịch thu được thấy tạo màu xanh tím. Polime X là
Polime X là tinh bột.
Nước clo tác dụng với dung dịch NaI tạo I2 làm xanh hồ tinh bột.
Cho axit cacboxylic tác dụng với propan-2-ol có xúc tác H2SO4 đặc, đun nóng tạo ra este X có công thức phân tử C5H10O2. Tên gọi của X là.
Axit cacboxylic + CH3CH(OH)CH3 → C5H10O2
=> Este X có công thức là CH3COOCH(CH3)2 (isopropyl axetat)
Đốt cháy hoàn toàn 0,06 mol một cste X (chứa C, H, O) đơn chức, mạch hở cần dùng vừa đủ V lít khí O2 (ở đktc) thu được 4,032 lít khí CO2 (ở đktc) và 3,24 gam H2O. Giá trị của V là
Có
\({n_{C{O_2}}} = \frac{{4,032}}{{22,4}} = 0,18{\rm{ mol,}}{{\rm{n}}_{{H_2}O}} = \frac{{3,24}}{{18}} = 0,18{\rm{ mol}}\)
\(\to {n_{{O_2}}} = \frac{{2.0,18 + 0,18 - 2.0,06}}{2} = 0,21{\rm{ mol}} \Rightarrow {{\rm{V}}_{{O_2}}} = 4,701\)
Hợp chất hữu cơ X mạch hở có công thức phân tử C8H14O4, trong phân tử chỉ chứa một loại nhóm chức. Đun 43,5 gam X với dung dịch NaOH dư, thu được 40,5 gam muối và chất hữu cơ Y. Thành phần phần trăm khói lượng oxi trong Y là
X + NaOH → muối + chất hữu cơ Y
=> X là este 2 chức.
· Trường hợp 1: Axit tạo este 2 chức.
Có nmuối \( = {n_X} = \frac{{43,5}}{{174}} = 0,25{\rm{ mol}} \Rightarrow \) Mmuối \(= \frac{{40,5}}{{0,25}} = 162\)
=> Công thức của muối là C2H4(COONa)2.
=> Công thức este X là C2H4(COOC2H5)2, Y là C2H5OH
=> \(\% {m_{O\left( Y \right)}} = \frac{{16}}{{46}}.100\% = 34,783\% \)
· Trường hợp 2: Axit tạo este đơn chức.
Có nmuối \( = 2{n_X} = 0,5{\rm{ mol}} \Rightarrow \) Mmuối \(= \frac{{40,5}}{{0,5}} = 81\)
=> Không tìm được công thức thỏa mãn.
Để phân biệt glucozơ và saccarozơ thì nên chọn thuốc thử nào dưới đây?
Chọn thuốc thử là dung dịch brom.
Glucozơ làm mất màu dung địch brom còn saccarozơ thì không.
Cho m gam glucozơ lên men thành rượu (ancol) etylic với hiệu suất 60%. Hấp thụ hoàn toàn khí CO2 sinh ra vào dung dịch Ba(OH)2 dư thu được 39,4 gam kết tủa. Giá trị của m là
Có \({n_{C{O_2}}} = {n_{BaC{O_3}}} = \frac{{39,4}}{{197}} = 0,2{\rm{ mol}} \Rightarrow {{\rm{n}}_{{C_6}{H_{12}}{O_6}{\rm{ lt}}}} = \frac{1}{2}{n_{C{O_2}}} = 0,1{\rm{mol}}\)
\(\Rightarrow m = \frac{{180.0,1}}{{60\% }} = 30g\)
Peptit nào sau đây không có phản ứng màu biure?
Đipeptit không có phản ứng màu biure.
Cho các chất: C6H5NH2 (1), C2H5NH2 (2), (C6H5)2NH (3), (C2H5)2NH (4), NH3 (5) (C6H5- là gốc phenyl), Dãy các chất sắp xếp theo thứ tự lực bazơ giảm dần là:
Thứ tự lực bazơ giảm dần:
|
\({({C_2}{H_5})_2}NH\) (4) |
C2H5NH2 (2) |
NH3 (5) |
C6H5NH2 (1) |
(C6H5)2NH (3) |
|
Có 2 nhóm C2H5- đẩy e, làm tăng lực bazơ của N |
Có 1 nhóm C2H5- đẩy e |
|
Có 1 nhóm C6H5- hút e |
Có 2 nhóm C6H5- hút e, làm giảm mạnh lực bazơ của N. |
Cho các phát biểu sau:
(1) Ở điều kiện thường, anilin là chất rắn, tan ít trong nước.
(2) Nhỏ nước brom vào dung dịch anilin, thấy xuất hiện kết tủa trắng.
(3) Dung dịch anilin làm phenolphtalein đổi màu.
(4) Ứng với công thức phân tử C2H7N, có 01 đồng phân là amin bậc 2.
(5) Các peptit đều cho phân ứng màu biure.
Tổng số phát biểu đúng là
Sai. Ở điều kiện thường, anilin là chất lỏng.
(1) Đúng. Anilin phản ứng với brom tạo kết tủa trắng 2,4,6-tribromanilin.
(2) Sai. Dung dịch anilin không làm phenolphtalein đổi màu.
(3) Đúng. 1 đồng phân amin bậc 2 là CH3NHCH3.
(4) Sai. Chỉ các peptit có từ 2 liên kết peptit trở lên mới cho phản ứng màu biure.
Cho 0,01 mol một aminoaxit X tác dụng vừa đủ với 40 ml dung dịch NaOH 0,25M. Mặt khác 1,5 gam X tác dụng vừa đủ với 40 ml dung dịch KOH 0,5M. Tên gọi của X là
\(\frac{{{n_{NaOH}}}}{{{n_X}}} = \frac{{0,01}}{{0,01}} = 1 \Rightarrow \) X có 1 chức -COOH.
1,5 g X + vừa đủ 0,02 mol KOH
Nếu X có 1 chức -NH2: \({n_X} = {n_{KOH}} = 0,02{\rm{ mol}} \Rightarrow {M_X} = \frac{{1,5}}{{0,02}} = 75\)
=> Công thức của X là H2NCH2COOH (glyxin).
Nếu X có 2 chức -NH2: \({n_X} = \frac{1}{2}{n_{KOH}} = 0,01{\rm{ mol}} \Rightarrow {M_X} = \frac{{1,5}}{{0,01}} = 150\)
=> Không tìm được công thức phù hợp.
Polivinyl clorua được điều chế từ khí thiên nhiên (metan chiếm 95%) theo sơ đồ chuyển hóa và hiệu suất mỗi giai đọan như sau:
Muốn tổng hợp 1 tấn PVC thì cần bao nhiêu m3 khí thiên nhiên (đktc) ?
\({n_{PVC}} = \frac{{1000}}{{62,5n}} = \frac{{16}}{n}kmol \Rightarrow {n_{C{H_4}{\rm{ lt}}}} = 2n.{n_{PVC}} = 32kmol\)
\(\Rightarrow {n_{C{H_4}{\rm{ tt}}}} = \frac{{32}}{{0,15.0,95.0,9}} = 249,51kmol\)
\(\Rightarrow {V_{{\rm{khi thien nhien}}}} = \frac{{249,51}}{{0,95}}.22,4 = 5883lit = 5883{m^3}\)
Trong các chất sau: (1) saccarozơ, (2) glucozơ, (3) Anilin, (4) etyl axetat. Số chất xảy ra phản ứng khi đun nóng với dung dịch H2SO4 loãng là
Các chất phản ứng khi đun nóng với dung dịch H2SO4 loãng là: (1) saccarozơ, (3) Anilin, (4) etyl axetat.
Kết quả thí nghiệm của các chất hữu cơ X, Y, Z như sau:
X phản ứng với Cu(OH)2 ở nhiệt độ thường tạo dung dịch màu xanh lam => X là saccarozơ hoặc glucozơ.
Y làm mất màu nước brom => Y là glucozơ => X là saccarozơ.
Z hóa xanh quỳ tím => Z là metyl amin.
Cho 16,2 gam kim loại M (có hoá trị n không đổi) tác dụng với 3,36 lít O2 (đktc). Hoà tan chất rắn sau phản ứng bằng dung dịch HCl dư thấy thoát ra 13,44 lít H2 (đktc). Kim loại M là
\({n_{{O_2}}} = \frac{{3,36}}{{22,4}} = 0,15{\rm{ mol,}}{{\rm{n}}_{{H_2}}} = \frac{{13,44}}{{22,4}} = 0,6{\rm{ mol}}\)
\(\to n.{n_M} = 4{n_{{O_2}}} + 2{n_{{H_2}}} \Rightarrow n.\frac{{16,2}}{M} = 4.0,15 + 2.0,6 \Rightarrow M = 9n\)
=> n = 3, M = 27 (Al)
Cho biết các phản ứng xảy ra sau:
\(2FeB{r_2} + B{r_2} \to 2FeB{r_3};2NaBr + C{l_2} \to NaCl + B{r_2}\)
Phát biểu nào sau đây đúng ?
\(2FeB{r_2} + B{r_2} \to 2FeB{r_3}\)
=> Tính khử của Br- yếu hơn Fe2+, tính oxi hóa của Br2 mạnh hơn Fe3+ (1)
\(2NaBr + C{l_2} \to NaCl + B{r_2}\).
=> Tính khử của Cl- yếu hơn Br-, tính oxi hóa của Cl2 mạnh hơn Br2. (2)
Từ (1), (2) suy ra tính oxi hóa của Cl2 mạnh hơn Fe3+.
Natri, kali và canxi được sản xuất trong công nghiệp bằng phương pháp
Natri, kali và canxi đều là những kim loại có tính khử mạnh, chúng chỉ có thể điều chế được bằng cách điện phân nóng chảy từ hợp chất của chúng.
Cho 8,96 lít CO2 (đktc) sục vào dung dịch chứa 100 ml dung dịch chứa hỗn hợp Ca(OH)2 2M và NaOH 1,5M thu được a gam kết tủa và dung dịch X. Đun nóng kĩ dung dịch X thu được thêm b gam kết tủa. Giá trị (a + b) là
Có \(\left\{ \begin{array}{l}
{n_{CO_3^{2 - }}} + {n_{HCO_3^ - }} = {n_{C{O_2}}} = \frac{{8,96}}{{22,4}} = 0,4{\rm{ mol}}\\
{{\rm{n}}_{O{H^ - }}} = 2{n_{CO_3^{2 - }}} + {n_{HCO_3^ - }} = 0,1.\left( {2.2 + 1,5} \right) = 0,55{\rm{ mol}}
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
{n_{CO_3^{2 - }}} = 0,15{\rm{ mol}}\\
{{\rm{n}}_{HCO_3^ - }} = 0,25{\rm{ mol}}
\end{array} \right.\)
\( \Rightarrow \left\{ \begin{array}{l}
a = 100.0,15 = 15g\\
b = 100.0,05 = 5g
\end{array} \right. \Rightarrow a + b = 20\)
Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư.
(b) Dẫn khí H2 (dư) qua bột MgO nung nóng.
(c) Cho dung dịch AgNO3 tác dụng với dung dịch Fe(NO3)2 dư.
(d) Cho Na vào dung dịch MgSO4.
(e) Đốt FeS2 trong không khí.
(f) Điện phân dung dịch Cu(NO3)2 với các điện cực trơ
Số thí nghiệm không tạo thành kim loại là
\(Mg + F{e_2}{(S{O_4})_3} \to MgS{O_4} + 2FeS{O_4}\)
(a) Không xảy ra phản ứng.
(b) \(AgN{O_3} + Fe{(N{O_3})_2} \to Ag + Fe{(N{O_3})_3}\)
(c) \(2Na + 2{H_2}O \to 2NaOH + {H_2}\)
\(2NaOH + MgS{O_4} \to Mg{(OH)_2} + N{a_2}S{O_4}\)
(d) \(4Fe{S_2} + 11{O_2} \to 2F{e_2}{O_3} + 8S{O_2}\)
(e) \(2Cu{(N{O_3})_2} + 2{H_2}O \to 2Cu + 4HN{O_3} + {O_2}\)
Có 4 thí nghiệm không tạo kim loại.
Tiến hành 6 thí nghiệm sau:
- TN1: Nhúng thanh sắt vào dung dịch FeCl3.
- TN2: Nhúng thanh sắt vào dung dịch CuSO4.
- TN3: Cho chiếc đinh làm bằng thép vào bình chứa khí oxi, đun nóng.
- TN4: Cho chiếc đinh làm bằng thép vào dung dịch H2SO4 loãng.
- TN5: Nhúng thanh đồng vào dung dịch Fe2(SO4)3.
- TN6: Nhúng thanh nhôm vào dung dịch H2SO4 loãng có hoà tan vài giọt CuSO4.
Số trường hợp xảy ra ăn mòn điện hóa là
• TN1: Xảy ra ăn mòn hóa học: Fe + 2FeCl3 → 3FeCl2
• TN2: Xảy ra ăn mòn điện hóa.
Ban đầu xảy ra phản ứng: Fe + CuSO4 → FeSO4 + Cu
Xuất hiện 2 điện cực:
Tại catot (Cu): Cu2+ + 2e → Cu
Tại anot (Fe): Fe → Fe2+ + 2e
Fe bị ăn mòn dần.
• TN3: Xảy ra ăn mòn hóa học: 3Fe + 2O2 → Fe3O4
• TN4: Xảy ra ăn mòn điện hóa.
Thép là hợp kim Fe – C gồm những tinh thể Fe tiếp xúc trực tiếp với tinh thể C (graphit). Khi cho thanh thép vào dung dịch H2SO4 loãng xảy ra quá trình:
Tại catot (C): 2H+ + 2e → H2
Tại anot (Fe): Fe → Fe2+ + 2e
Fe bị ăn mòn dần.
• TN5: Xảy ra ăn mòn hóa học: Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
• TN6: Xảy ra ăn mòn điện hóa:
Đầu tiên xảy ra phản ứng: 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Xuất hiện 2 điện cực:
Tại catot (Cu): 2H+ + 2e → H2
Tại anot (Al): Al → Al3+ + 3e
Al bị ăn mòn dần.
Vậy có 3 trường hợp xảy ra ăn mòn điện hóa.
Phát biểu nào sau đây là sai ?
A sai. Các kim loại kiềm có nhiệt độ nóng chảy giảm dần từ Li đến Cs do bán kính kim loại tăng dần, liên kết trong mạng tinh thể càng lỏng lẻo.
B đúng. So với các kim loại cùng chu kì, kim loại kiềm có điện tích hạt nhân nhỏ nhất nên khả năng hút e kém nhất, bán kính lớn nhất.
C đúng.
D đúng.
Cho l,68g bột sắt và 0,36g bột Mg tác dụng với 375ml dung dịch CuSO4 khuấy nhẹ cho đến khi dung dịch mất màu xanh, thấy khối lượng kim loại thu được sau phản ứng là 2,82g. Nồng độ mol/1 của CuSO4 trong dung dịch trước phản ứng là
\({n_{Fe}} = \frac{{1,68}}{{56}} = 0,03{\rm{ mol,}}{{\rm{n}}_{Mg}} = \frac{{0,36}}{{24}} = 0,015{\rm{ mol}}\)
Nếu Fe và Mg phản ứng hết: \({n_{Cu}} = 0,03 + 0,015 = 0,045{\rm{ mol}}\)
=> mCu = 64.0,045 = 2,88 g > 2,82 g
=> Chứng tò Fe phản ứng còn dư.
=> \({m_{kim{\rm{ loai}}}} = {m_{Cu}} + {m_{Fe{\rm{ d}}}} = 64.\left( {0,015 + x} \right) + 56.\left( {0,03 - x} \right) = 2,82g\)
\(\Rightarrow x = 0,0225 \Rightarrow {C_{M(CuS{O_4})}} = \frac{{0,015 + 0,0225}}{{0,375}} = 0,1M\)
Cho 3,48 gam bột Mg tan hết trong dung dịch hỗn hợp gồm HCl (dư) và KNO3, thu được dung dịch X chứa m gam muối và 0,56 lít (đktc) hỗn hợp khí Y gồm N2 và H2. Hỗn hợp khí Y có tỉ khối so với H2 bằng 11,4. Giá trị của m là
\({n_{Mg}} = \frac{{3,48}}{{24}} = 0,145{\rm{ mol}}\)
\(\left\{ \begin{array}{l}
{n_{{N_2}}} + {n_{{H_2}}} = \frac{{0,56}}{{22,4}} = 0,025{\rm{ mol}}\\
{\rm{28}}{{\rm{n}}_{{N_2}}} + 2{n_{{H_2}}} = 11,4.2.0,025 = 0,57g
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
{n_{{N_2}}} = 0,02{\rm{ mol}}\\
{{\rm{n}}_{{H_2}}} = 0,005{\rm{ mol}}
\end{array} \right.\)
\(\to {n_{NH_4^ + }} = \frac{{2.0,145 - 10.0,02 - 2.0,005}}{8} = 0,01{\rm{ mol}}\)
\(\to {n_{KN{O_3}}} = 2{n_{{N_2}}} + {n_{NH_4^ + }} = 0,05{\rm{ mol}}\)
m muối \( = {m_{MgC{l_2}}} + {m_{N{H_4}Cl}} + {m_{KCl}} = 95.0,145 + 53,5.0,01 + 74,5.0,05 = 18,035g\)
Nhận xét nào sau đây là sai ?
A sai. Trong môi trường kiềm, ion \(C{r_2}O_7^{2 - }\) (màu da cam) phản ứng với H2O sinh ra ion \(CrO_4^{2 - }\) (màu vàng).
B đúng. \(3{H_2}S + 8{H^ + } + C{r_2}O_7^{2 - } \to 3S + 2C{r^{3 + }} + 7{H_2}O\)
C đúng. \(4Cr{(OH)_2} + {O_2} + 4NaOH \to 4NaCr{O_2} + 6{H_2}O\)
D đúng. \({K_2}C{r_2}{O_7} + 2Ba{(N{O_3})_2} + {H_2}O \to 2BaCr{O_4} + 2KN{O_3} + 2HN{O_3}\)
Hòa tan hoàn toàn 7,6 gam chất rắn X gồm Cu, Cu2S và S bằng HNO3 dư thấy thoát ra 5,04 lít khí NO duy nhất (đktc) và dung dịch Y. Thêm dung dịch Ba(OH)2 dư vào dung địch Y được m gam kết tủa. Giá trị m là
Quy đổi E tương ứng với hỗn hợp gồm x mol Cu, y mol S.
\( \Rightarrow \left\{ \begin{array}{l}
64x + 32y = 7,6\\
\to 2x + 6y = 3{n_{NO}} = 3.\frac{{5,04}}{{22,4}} = 0,675{\rm{ mol}}
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
x = 0,075\\
y = 0,0875
\end{array} \right.\)
\(m = {m_{Cu{{(OH)}_2}}} + {m_{BaS{O_4}}} = 98x + 233y = 27,7375g\)
Nung hỗn hợp X gồm FeO, CuO, MgO và Al ở nhiệt độ cao, sau khi các phản ứng xảy ra hoàn toàn cho phần rắn vào dung dịch NaOH dư thấy có khí H2 bay ra và chất rắn không tan Y. Cho Y vào dung dịch H2SO4 loãng, dư. Tồng số phản ứng đã xảy ra là
Nung X ở nhiệt độ cao:
3CuO + 2Al → 3Cu + Al2O3
3FeO + 2Al → 3Fe + Al2O3
Phần rắn + NaOH dư:
\(A{l_2}{O_3} + 2NaOH \to 2NaAl{O_2} + {H_2}O\)
\(2Al + 2NaOH + 2{H_2}O \to 2NaAl{O_2} + 3{H_2}\)
=> Y gồm: Cu, Fe, MgO
\(Y + {H_2}S{O_4}\) loãng dư:
\(MgO + {H_2}S{O_4} \to MgS{O_4} + {H_2}O\)
\(Fe + {H_2}S{O_4} \to FeS{O_4} + {H_2}\)
Có tất cả 6 phản ứng xảy ra.
Hỗn hợp X gồm ba peptit mạch hở. Thủy phân hoàn toàn 0,05 mol X có khối lượng là 24,97g trong dung dịch NaOH dư, đun nóng, thì có 0,3 mol NaOH phản ứng. Sau phản ứng thu được m(g) hỗn hợp Y gồm các muối của glyxin, alanin và axit glutamic, trong đó muối của axit glutamic chiếm 1/9 tổng số mol các muối trong Y. Giá tri của m là
Glu = Gly + 3 CH2 + COO
Quy đổi X
\(\left\{ \begin{array}{l}
{C_2}{H_3}ON:9a{\rm{ mol}}\\
{\rm{C}}{H_2}:{\rm{ b mol}}\\
{{\rm{H}}_2}O:{\rm{ 0,05}}\\
{\rm{C}}{{\rm{O}}_2}:{\rm{ a mol}}
\end{array} \right.\)
X + 0,3 mol NaOH: \(9a + a = 0,3 \to a = 0,03{\rm{ mol}}\)
Bảo toàn khối lượng: \({m_X} + {m_{NaOH}} = {m_m} + {m_{{H_2}O}}\)
\(24,97 + 0,3.40 = {m_m} + 18.\left( {0,03 + 0,05} \right) \Rightarrow {m_m} = 35,53\left( {gam} \right)\)
Cho 77,1 gam hỗn hợp X gồm Mg, Al, ZnO và Fe(NO3)2 tan hoàn toàn trong dung dịch chứa 725 ml H2SO4 2M loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 193,1 gam muối sunfat trung hòa và 7,84 lít (đktc) khí Z gồm hai khí trong đó có một khí hóa nâu ngoài không khí, tỉ khối của Z so với He là 4,5. Phần trăm khối lượng của Mg trong hỗn hợp X gần nhất vởi giá trị nào sau đây
Khí trong Z hóa nâu ngoài không khí là NO.
\({M_Z} = 4,5.4 = 18 < {M_{NO}}\) => Khí còn lại có PTK < 18 => Khí đó là H2.
\(\Rightarrow \left\{ \begin{array}{l}
{n_{NO}} + {n_{{H_2}}} = \frac{{7,84}}{{22,4}} = 0,35{\rm{ mol}}\\
{\rm{30}}{{\rm{n}}_{NO}} + 2{n_{{H_2}}} = 18.0,35 = 6,3g
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
{n_{NO}} = 0,2{\rm{ mol}}\\
{{\rm{n}}_{{H_2}}} = 0,15{\rm{ mol}}
\end{array} \right.\)
\( \to {m_{{H_2}O}} = 77,1 + 98.1,45 - 193,1 - 6,3 = 19,8g \Rightarrow {n_{{H_2}O}} = 1,1{\rm{ mol}}\)
\( \to {n_{{{(N{H_4})}_2}S{O_4}}} = \frac{{2.1,45 - 2.0,15 - 2.1,1}}{8} = 0,05{\rm{ mol}}\)
\(\to {n_{Fe{{(N{O_3})}_2}}} = \frac{1}{2}{n_{NO}} + {n_{{{(N{H_4})}_2}S{O_4}}} = 0,15{\rm{ mol}}\)
Đặt số mol của Mg, Al, ZnO lần lượt là x, y, z
Có khí H2 thoát ra nên sau phản ứng số mol Fe2+ không đổi.
\(\Rightarrow \left\{ \begin{array}{l}
24x + 27y + 81z = 77,1 - 180.0,15 = 50,1\\
120x + 171y + 161z = 193,1 - 152.0,15 - 132.0,05 = 163,7\\
\to 2x + 3y = 3.0,2 + 2.0,15 + 16.0,05
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
x = 0,4\\
y = 0,3\\
z = 0,4
\end{array} \right.\)
\(\Rightarrow \% {m_{Mg}} = \frac{{24.0,4}}{{77,1}} = 12,45\% \) gần nhất với giá trị 12,5%.
Điện phân 300 ml dung dịch X chứa m gam chất tan là FeCl3 và CuCl2 với điện cực trơ, màng ngăn xốp với cường độ dòng điện là 5,36 ampe. Sau 14763 giây, thu dược dung dịch Y và trên catôt xuất hiện 19,84 gam hỗn hợp kim loại. Cho Y tác dụng với dung dịch AgNO3 dư thu dược 39,5 gam kết tủa. Giá trị CM của FeCl3 và CuCl2 lần lượt là
Sau khi điện phân thu được hỗn hợp kim loại => Fe3+, Cu2+ bị điện phân hết, Fe2+ đã bị điện phân.
\(2F{e^{3 + }} + 2C{l^ - } \to 2F{e^{2 + }} + C{l_2}\)
\(C{u^{2 + }} + 2C{l^ - } \to Cu + C{l_2}\)
\(F{e^{2 + }} + 2C{l^ - } \to Fe + C{l_2}\)
\(Y + AgN{O_3} \to \) 39,5 g kết tủa
→ Chứng tỏ Y chứa FeCl2 dư.
\({m_ \downarrow } = {m_{AgCl}} + {m_{Ag}} = 143,5.2{n_{FeC{l_2}\left( Y \right)}} + 108{n_{FeC{l_2}\left( Y \right)}} = 39,5g \Rightarrow {n_{FeC{l_2}\left( Y \right)}} = 0,1{\rm{ mol}}\)
Có \({n_{{\rm{e Dien phan}}}} = \frac{{It}}{E} = \frac{{5,36.14763}}{{96500}} = 0,82{\rm{ mol}}\)
\( \Rightarrow {n_{F{e^{3 + }}}} + 2{n_{C{u^{2 + }}}} + 2.\left( {{n_{F{e^{3 + }}}} - 0,1} \right) = 0,82{\rm{mol }}\left( 1 \right)\)
\({m_{Kim{\rm{loai}}}} = 64{n_{C{u^{2 + }}}} + 56.\left( {{n_{F{e^{3 + }}}} - 0,1} \right) = 19,84g{\rm{ }}\left( 2 \right)\)
Từ (1), (2) suy ra: \(\left\{ \begin{array}{l}
{n_{F{e^{3 + }}}} = 0,18{\rm{ mol}}\\
{{\rm{n}}_{C{u^{2 + }}}} = 0,24{\rm{ mol}}
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
{C_{M(FeC{l_3})}} = 0,6M\\
{C_{M(CuC{l_2})}} = 0,8M
\end{array} \right.\)
Cho X, Y là hai axit hữu cơ mạch hở (MX < MY); Z là ancol no; T là este hai chức mạch hở không phân nhánh tạo bởi X, T, Z. Đun nóng 38,86 gam hỗn hợp E chứa X, Y Z, T với 400ml dung dịch NaOH 1M vừa đủ thu được ancol Z và hỗn hợp F chứa hai muối có số mol bằng nhau. Cho Z vào bình chứa Na dư thấy bình tăng 19,24 gam và thu được 5,824 lít H2 ở đktc. Đốt hoàn toàn hỗn hợp F cần 15,68 lít O2 (đktc) thu được khí CO2, Na2CO3 và 7,2 gam H2O. Thành phần phần trăm khối lượng của T trong E gần nhất với giá trị
Cách 1:
T là este 2 chức tạo bởi X, Y, Z => Z là ancol 2 chức.
Có mbình tăng \( = {m_Z} - {m_{{H_2}}} \Rightarrow {m_Z} = 19,24 + 2.0,26 = 19,76g\)
\({n_Z} = {n_{{H_2}}} = 0,26{\rm{ mol}} \Rightarrow {{\rm{M}}_Z} = \frac{{19,76}}{{0,26}} = 76\)
=> Công thức của Z là C3H6(OH)2.
Sau phản ứng với NaOH thu được 2 muối có số mol bằng nhau nên:
\(38,86g{\rm{ E}}\left\{ \begin{array}{l}
RCOOH:x{\rm{ mol}}\\
{\rm{R'COOH:}}x{\rm{ mol}}\\
{{\rm{C}}_3}{H_6}{(OH)_2}:y{\rm{ mol}}\\
{\rm{(RCOO)(R'COO)}}{{\rm{C}}_3}{H_6}:\left( {0,26 - y} \right){\rm{ mol}}
\end{array} \right.\)
F + 0,7 mol O2 → 0,4 mol H2O
\(BTNT{\rm{ }}O:2.0,4 + 2.0,7 = 0,4 + 2{n_{C{O_2}}} + 3.0,2 \Rightarrow {n_{C{O_2}}} = 0,6{\rm{ mol}}\)
\(BTKL:{m_F} = 44.0,6 + 7,2 + 106.0,2 - 32.0,7 = 32,4g \Rightarrow {\overline M _F} = \frac{{32,4}}{{0,4}} = 81\)
\(\Rightarrow {\overline M _{X,Y}} = 81 - 23 + 1 = 59 \Rightarrow {m_E} = 59.0,4 + 76.0,26 - 18.2.\left( {0,26 - y} \right) = 38,86\)
\(\Rightarrow y = 0,135 \Rightarrow \% {m_T} = \frac{{\left( {59,2 + 76 - 18.2} \right).\left( {0,26 - 0,135} \right)}}{{38,86}}.100\% = 50,82\% \)
Gần nhất với giá trị 51
Đề thi liên quan
-
Đề thi thử THPT QG môn Hóa học năm 2018 - Trường THPT Nguyễn Trung Trực
-
40 câu hỏi
-
90 phút
-